Основы технологии стекла, ситаллов и эмали.
1.История развития стеклоделия.
Основы технологии стекла, ситаллов и эмали.
2.Стекло, стеклообразное состояние.
3. Строение стекла.
4. Кристаллохимическое описание строения стекла.
5. Кварцеваое стекло.
6. Бинарные щелочно-силикатные стекла системы Ме20—SiO2 .
(Me-Li-Na-K-Rb-Cz-Tn).
7. Стекла в системах Ме20—МеО—SiO2.
8. Щелочно-алюмосиликатные стекла.
9.Валентно-химическое описание строения стекла.
10. Химическая связь в стеклах, в соответствии с электронной теорией.
11.Теория валентных связей и структура стекол.
12. Теория молекулярных орбиталей и цветность стекла.
13. Зонная теория.
Свойства расплавов стекол.
14. Кристаллизационная способность.
15. Вязкость.
16. Поверхностное натяжение
Свойства стекол в твёрдом состоянии.
17. Физические свойства стекла.
18. Теплофизические свойства стекла.
1.История развития стеклоделия.
История худ-го и промышл. Производства стеклоделия может быть условно поделена на след. периоды:
1 период: 4-3е тысячелетие до н.э. В первобытном обществе делаются первые попытки выплавления стеклянных заменителей природных полудрагоценных камней, таких как яшма, агат, аметист. Из этих имитаторов изготавливаются религиозные украшения: бусы, подвески. Стекло еще мутное, непрозрачное;
2 период: 2-1 тыс. до н.э. Из стекла изготавливают первые сосуды(чашки), отверстия в них делают с помощью каменных стержней. Стеклоизделия очень примитивные. К концу этого периода научились изготавливать прозрачное стекло.
3 период: конец 1 до н.э.- нач. 19в. Н.э. Начался этот этап изготовлением стеклодувной трубки. Первые трубки были из камыша, а тот конец, который опускали в стекломассу, для защиты от возгорания мазали глиной. Затем трубки были заменены на железные. Из стекла начали готовить высокохудож. изделия. Центром развития сначала был Египет, затем в 1 в. Н.э. Римская империя, а затем стеклоделие перемещается в Венецию. Венецианское стекло отличается интенсивностью окраски, насыщ. Цвета, оно отделывалось золотом. Для сохранения секретов стеклоделия. венец. правительство переселило мастеров – стеклоделов на отдельно стоящий остров. Мурано ( колыбель худ. стекла). Стеклолам запрещалось покидать остров. но сосед. страны, в 1ю очередь Франция, всячески завлекали стеклоделов высоким жалованием, а в случае принятия французского подданства и женитьбе на француженке, готовы были платить 50тыс. франков золота. Поэтому худ. стекло стало развиваться в соседних странах в Испании и Франции.
4 период: нач. 19 в. до н.вр. Начинается изобретение в 1870г варная регенеративная печь(Силенс). До этого все печи были горшковые. В отличие от Горшковых, вырабатывали намного больше стекломассы. поэтому встал вопрос о её механической выработке. Изоб-на машина вертик-го стекла (ВВС) – Фурко. В 1902г. однако в массовое производство она была введена после сметри изобретателя.
В России основоположником стеклоделия стал М,В,Лермонтов. Он основал в 1748г 1ю научную лабораторию, где сам составлял рецепты и плавни стекла. Он же, в 1754г, около С.Петербурга, построил 1й завод, где изготавливал цветные и мозаичные стекла. До революции самыми крупными заводами были: Гусь-Хрустальный, Даг-огни в Дагестане. После революции. владелец завода гусь-хрустальный Исаак Ильич Китайгородский остался директором завода и основал в московском хим-техн институте, первую кафедру стекла, где стали готовить инженеров стекольщиков.
Современными направлениями развития стеклоделия явл: архитектурно-строит стекло с различными декоративными пленками, автомобильный, железнодорожный и строит триплекс, гнутое эмалированное,накладное стекло, биосеталлы и функциональные покрытия, витражные мозаичные изделия и др. изделия.
К наст.вр. развились современные направления стеклоделия. Это производство разл. стекла листового для архит-строит целей, например, для строительства небоскребов, для обеспечения безопасности необходимо применение строит. триплекса *(Три́плекс (от лат. triplex — тройной) — многослойное стекло (два или более органических или силикатных стекла, склеенные между собой специальной полимерной плёнкой или фотоотверждаемой композицией, способной при ударе удерживать осколки). Как правило, изготавливается путём прессования при нагреве. Триплексное стекло применяется при остеклении транспортных средств (лобовых стекол автомобилей, железнодорожного подвижного состава, самолётов, судов и т. п.), окон и фасадов зданий, бронировании.)* , т.е. двух или более слойного стекла соединенного поливинил бутирольной или др. органической пленкой. для защиты от солнечного облучения триплекс может включать дополнительные металлы: кобальт, никель, хром. В строит. небоскребов большое значение имеет форма стекла, поэтому важным явл. моделирование больших стекол с изгибами.
2. Основы технологии стекла, ситаллов и эмали.
2.Стекло, стеклообразное состояние.
В природе и технике все вещества могут быть в сост: плазменном, газообразном, жидком и твердом. Твердые тела могут иметь кристаллич. или агрегатную структуру. Частный случай аморфного состояния-стеклообразное. Комиссия по терминологии АН СССР дала такое определение стеклу: Стекло - все аморфные тела, получаемые путем переохлаждения, расплава, независимо от хим. состава и температурной области затвердевания и обладающими в результате постепенного увеличения вязкости механическими свойствами тв. тел. Причем процесс перехода из жидк. сост. в стеклообразное должен быть обратимым.
С точки зрения современных понятий, различают термины «стекло» и стеклообразное состояние. Т.к. М.М. Шульц и О.В. Мазурин дают следующее определение «стеклообразного состояния»: «веществом в стеклообразном состоянии (стеклообразным веществом) называется твердое некристаллическое вещество, образовавшееся в результате охлаждения жидкости со скоростью, достаточной для предотвращения кристаллизации во время охлаждения». Согласно Н.В. Соломину, «стеклом называется материал, в основном состоящий из стеклообразного вещества». Таким образом, термин «стекло» следует считать техническим термином в отличие от научного термина «стеклообразное состояние». В стекле могут оказаться пузыри, мелкие кристаллики. В материале, в основном состоящем из стеклообразного вещества, может быть даже специально образовано очень большое число мельчайших кристалликов, делающих материал непрозрачным или придающих ему ту или иную окраску. Такой материал называют «молочным» стеклом, окрашенным стеклом и т.д.
3. Строение стекла.
Представление о стекле как о сложной системе изложил и научно обосновал Д.И, Менделеев. По Д.И. Менделееву, стекло не есть определенное химическое соединение как полагали многие химики первой половины 19 в., а является сплавом оксидов, подобно металлическим сплавам. Д.И. Менделеев рассматривает структуру стекол и силикатов как сложную систему, различая в ней две составные части: неизменную (главную) и изменяемую. Под главной частью подразумевается основной каркас кремнеземистого сплава. Изменчивая часть может подвергаться изменениям и претерпевать замещения. Д.И. Менделеев указывал на полимеризацию молекул стекла, т.е. рассматривал стекло как неорганический полимер, оценивая с современных позиций. В настоящее время существуют несколько гипотез о строении стекла. Гипотеза кристаллитного строения предложена в 1921 году академиком А.А. Лебедевым. Согласно ей, стекло - скопление кристаллитов. Кристаллиты - это не микрообломки кристаллов, а крайне малые и деформированные структурные образования размером 1,2... 1,5 нм. В центральной части кристаллит имеет структуру, соответствующую нормальной кристаллической рещетке, а к перефелии структура сильно искажается.
Согласно гипотезе Захариассена, структура стекла представляется в виде непрерывной неправильной сетки. Кроме этих двух, существуют еще гипотезы Г. Таммана, агрегативная гипотеза Ботвинкина, скелетно-координационная гипотеза А.А. Аппена.
Современные представления о структуре стекла базируются на фундаментальных положениях неорганической и физической химии, кристаллохимии, физики и химии твердого состояния.
4. Кристаллохимическое описание строения стекла.
В основе данного описания лежат понятия ближнего и дальнего порядка в структуре веществ. Ближний порядок в общем случае означает правильное расположение отдельных атомов относительно некоторого фиксированного атома. Для жидких стекол ближний порядок характеризует расположение атомов кислорода относительности катионов. Например, атомы кремния всегда окружены четырьмя атомами кислорода, образуя кремнекислородный тетраэдр, параметры которого неизменны как в структуре кристаллических соединений, так и в стекле.
Дальним порядком называется строго периодическое и последовательное расположение атомов или группировок из атомов в пространстве, которое обусловливает образование единой трехмерной решетки. Если для кристаллических структур характерно наличие
ближнего и дальнего порядков, то особенность строения стекол состоит в том, что в их структуре имеется ближний порядок, но отсутствует дальний порядок в расположении координационных групп атомов. Отсутствие дальнего порядка в структуре характерно для жидкостей и аморфных тел. Лучше всего это можно понять на примере кремнезема и кварцевого стекла, имеющих один и тот же химический состав SiO2 (рис. 5.1). Основу структуры их составляет тетраэдр [SiO4]4- (рис. 5.1а), строение которого неизменно как в кристаллической решетке кремнезема, так и в стекле — это ближний порядок. Сочленение же тетраэдров в кварце и других полиморфных модификациях кремнезема при образовании пространственной решетки происходит под строго постоянным углом, различным для модификации кварца, тридимита и кристобалита — это дальний порядок (рис. 5.1,6). В стекле это не соблюдается, поэтому и образуется деформированная пространственная сетка (рис. 5.1в).
Рис. 5.1. Тетраэдр [SiO4]4-(а), схематическое изображение на плоскости структур кристаллического кварца (б) и кварцевого 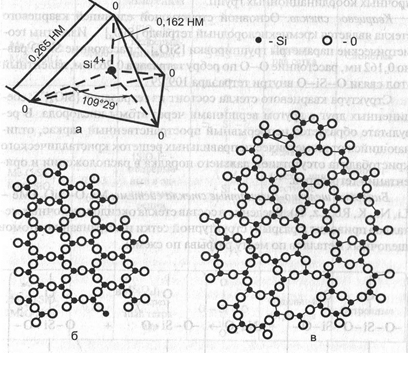
стекла (в).
Основными элементами структуры силикатных стекол являются тетраэдры [SiO4]4- которые, соединяясь друг с другом вершинами, способны образовывать непрерывную в одном, двух или трех измерениях пространственную структуру. Компоненты стекла, способные самостоятельно образовывать непрерывную структурную сетку, такие как SiO2, В203, GeO2(германий), Р205 и другие, принадлежат к группе стеклообразователей. Компоненты стекла, не способные самостоятельно образовывать непрерывную структурную сетку называются модификаторами. К группе модификаторов, как правило, принадлежат оксиды элементов первой и второй группы периодической системы, а также некоторые элементы других групп. Катионы модификаторов располагаются в свободных полостях структурной сетки, компенсируя избыточный отрицательный заряд сложного аниона. Прочность связи модификатор — кислород значительно ниже прочности связи стеклообразователь — кислород, поэтому модификаторы не образуют прочных координационных групп.
5. Кварцеваое стекло.
Основной структурной единицей кварцевого стекла является кремнекислородный тетраэдр [SiO4]4-. Известны геометрические параметры группировки [SiO4]4-: расстояние Si-O равно 0,162 нм, расстояние О—О по ребру тетраэдра 0,265 нм, валентный угол связи О—Si—О внутри тетраэдра 109°29’.
Структура кварцевого стекла состоит из тетраэдров [SiO4]4- соединенных друг с другом вершинами через атомы кислорода. В результате образуется непрерывный пространственный каркас, отличающийся от геометрически правильных решеток кристаллического кристобалита отсутствием дальнего порядка в расположении и ориентации тетраэдров.
6. Бинарные щелочно-силикатные стекла системы Ме20— SiO 2 .
(Me-Li-Na-K-Rb-Cz-Tn).
Введение в состав стекла оксидов щелочных металлов приводит к разрыву структурной сетки и встраиванию атомов щелочных металлов по месту разрыва по схеме:
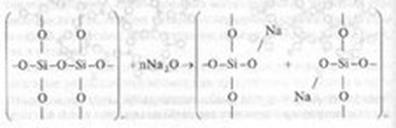
В том месте, где встраивались ионы щелочного металла, отсутствует химическая связь между элементами структуры. По мере увеличения концентрации Ме20 — модификатора в составе стекла растет число разрывов в структурной сетке и число немостиковых атомов кислорода, приходящихся на один тетраэдр SiO44-. При концентрациях Ме20 более 60% (по массе) создаются условия для образования изолированных тетраэдров SiO44- . Кристаллизуются подобные расплавы чрезвычайно быстро, т.к. облегчаются условия переориентации структурных единиц, в то время как застывание расплава в виде стекла при этом затруднено.
Структурным параметром, позволяющим характеризовать протяженность кремнекислородного радикала и тип анионной сетки, является степень связности fSi, выражающаяся отношением числа атомов кремния к числу атомов кислорода, взятых по молекулярному составу стекла, т.е. fSi = [Si]/[0]. Максимальная степень связности сетки характерна для кварцевого стекла fSi = 0,5.
Изменение степени связности структурной сетки приводит к изменению кремнекислородного радикала и типа структуры.
7. Стекла в системах Ме20—МеО— SiO 2 .
Катионы щелочноземельных металлов в структуре стекла выполняют роль модификаторов, т.е. выбывают разрыв структурной сетки, встраиваясь в свободные полости. При замещении щелочных катионов на щелочноземельные степень связности структурной сетки может несколько возрасти, т.к. щелочноземельные ионы, обладая более высоким зарядом, могут связывать отдельные кремнекислородные цепочки.
Роль катионов в структуре стекла и их влияние на свойства определяются следующими параметрами: зарядом и радиусом иона, координационным числом, поляризуемостью и поляризующей способностью, ионным потенциалом, силой поля катиона, степенью ионности или ковалентности связи, направленностью и прочностью химической связи.
8. Щелочно-алюмосиликатные стекла.
Структурная роль алюминия (Al) в стекле идентична его роли в кристаллических алюмосиликатах, т.е. катионы А13+ могут находиться в четверной или шестерной координации по кислороду и образовывать координационные тетраэдры типа А104 (тетраэдры) и А106 (октаэдры).
Условием существования алюминия в том или ином координационном состоянии в силикатных стеклах является соотношение между концентрацией щелочных (или щелочноземельных) оксидов и оксида А1203. При соотношениях Ме20/А1203>1 А13+ присутствует в стекле в тетраэдрическом окружении. Следует обратить внимание на то, что группировка [А104]5- в силикатных стеклах не существует самостоятельно. Она устойчива только в том случае, если вблизи тетраэдра [А104]5- расположен ион щелочного металла, например, натрия. Стабильной в этом случае является не просто группировка [А104]5- а группа атомов [(А104)5-На+]4- , в которой ион натрия не связан с каким-либо определенным атомом кислорода, а локализован на тетраэдре [А104]5- частично компенсируя отрицательный заряд анионной группировки.
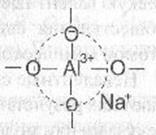
Атомы кислорода в вершинах тетраэдра А104 в этом случае являются мостиковыми и могут принимать участие в образовании химической связи с кремнекислородными тетраэдрами. Как и в кристаллических силикатах, тетраэдрические группировки алюминия могут, наравне с тетраэдрами SiO4, участвовать в построении структурного каркаса стекла, сочленяясь с ними вершинами. Образуется смешанная алюмокремнекислородная сетка.
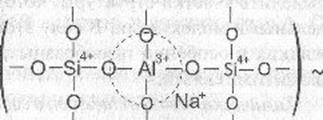
При введении оксида алюминия в щелочно-силикатное стекло повышается степень связности структурной сетки, т.к. он встраивается в кремне-кислородный каркас и наряду с этим изменяет структурную роль щелочного компонента.
Наиболее благоприятные возможности для изоморфного замещения ионов кремния на ионы алюминия создаются в присутствии катионов №+, К+, Са2+.
Существование алюминия в стеклах в шестерной координации наиболее вероятно в бесщелочных и малощелочных составах с выраженным кислотным характером. Щелочноземельные катионы малого радиуса Ве2+, Мg2+ способствуют стабилизации в стекле алюминия, являющегося модификатором.
9.Валентно-химическое описание строения стекла.
Химическая связь между атомами возникает как результат электростатического (кулоновского) взаимодействия электронов и ядер атомов.
Химические связи в веществах могут быть: валентные и ковалентные. Валентные связи возникают в результате перераспределения электронной плотности в системе атомов, участвующих в химической реакции. Различают ионную, ковалентную, донорно-акцепторную, дативную, металлическую валентные связи, отличающиеся друг от друга степенью обобществления связевых электронов парой атомов или группой атомов химического соединения.
Невалентные связи возникают в результате электростатического взаимодействия между молекулами или молекулярными группировками вещества. Образование невалентных связей не сопровождается передачей электронов, но обусловлено индукционным, ориентационным или дисперсионным взаимодействием молекул или молекулярных образований.
В стеклах, как и в кристаллических твердых телах, невозможно выделить участки структуры, которые можно было бы считать отдельными молекулами. В силу этого в твердых телах, в отличие от жидких и особенно газообразных, преобладает действие прочных валентных связей.
10. Химическая связь в стеклах, в соответствии с электронной теорией.
Согласно классической электронной теории, химическая связь в кварцевом стекле является преимущественно ковалентной (степень ионности 50%). В бинарных щелочно-силикатных стеклах типа Ме20—SiO2можно выделить два вида ионно-ковалентных связей: преимущественно ковалентные в цепочках атомов
-Si-О-Si-
и более ионные связи между щелочными катионами и анионным каркасом, т.е. связи типа -Ме-О-Si-.
— Степень ионности — ковалентности связей Si—О , Ме—О не является постоянной для всех видов стекол и зависит от состава стекла в целом.
11.Теория валентных связей и структура стекол.
Эта теория позволяет объяснить образование пространственных координационных группировок (полиэдров), исходя из особенности строения атомов, учитывает энергетические характеристики внешних орбиталей атомов, определяет порядок заполнения орбиталей.
Например, образование тетраэдров SiO4по данным теории, является следствием зр3-гибридизации внешних электронных орбита-лей атомов Si. Тип гибридизации орбиталей определяет пространственную структуру полиэдров, позволяет с высокой точностью предсказать значения углов связи в координационных полиэдрах.
12. Теория молекулярных орбиталей и цветность стекла.
Теория (МО) рассматривает химическую связь как результат движения электронов в суммарном поле, создаваемом всеми ядрами и электронами атомов с учетом геометрии их пространственного расположения.
В рамках этой теории удается рассчитать энергетическое распределение орбиталей, предсказать последовательность их заполнения электронами, оценить эффективность заряда атомов, степень ионности и кратности связи и другие характеристики.
13. Зонная теория.
Особенности строения внешних зон и характер их заполнения электронами позволяет классифицировать вещества на изоляторы, полупроводники и проводники, а также уверенно предсказать оптические электрические, теплофизические и магнитные свойства веществ (рис. 5.2).
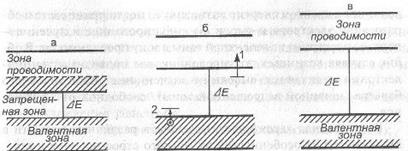 Рис. 5.2. Положение верхних энергетических зон в твердых телах: а) проводники (металлы); б) полупроводники с примесной проводимостью р-, п-типа; в) диэлектрики.
Рис. 5.2. Положение верхних энергетических зон в твердых телах: а) проводники (металлы); б) полупроводники с примесной проводимостью р-, п-типа; в) диэлектрики.
У проводников электроны располагаются как в валентной зоне, так и в зоне проводимости. При взаимодействии полупроводников
с квантом энергии возможно: а) поглощение света и образование электрона и дырки; б) индуцированное излучение — переход электрона из валентной зоны в зону проводимости. В обоих случаях возникает полупроводниковая проводимость. Диэлектрики отличаются высокими значениями энергетического барьера (шириной запрещенной зоны), свободной от электронов.
Качественная характеристика свойств различных веществ в зависимости от особенностей их зонного строения дана в табл. 5.2.
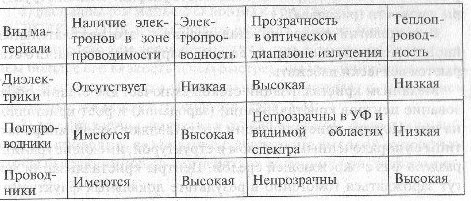
Оксидные стекла - диэлектрики. Отличаются высокими значениями энергетического барьера (шириной запрещенной зоны) между валентной зоной и зоной проводимости, свободной от электронов. Тепловая энергия, а также энергия излучения в оптическом диапазоне длин волн оказываются недостаточными для возбуждения перехода электронов из валентной зоны в зону проводимости. Этим обстоятельством объясняется высокая прозрачность, высокие электроизоляционные свойства, низкая теплопроводность оксидных стекол.
14. Свойства расплавов стекол.
14. Кристаллизационная способность.
Возможность кристаллизации расплава или, наоборот способность его к образованию стекловидного состояния зависит от состава расплава, его свойств и условий охлаждения.
Кристаллизация — это процесс, в ходе которого создается упорядоченная решетка кристалла из менее упорядоченной структуры жидкости (расплава).
В технологии стекла кристаллизация — это нежелательный процесс, приводящий к браку стекла(т.к. стекло застывает не в виде гомогенного стекла, а в виде неравномерных отличающихся по размеру кристаллов)— заруханию стекла. Его стараются всячески избежать.
Механизм кристаллизации стекол включает две стадии: образование центров кристаллизации (зародыша) и рост кристаллов на них.
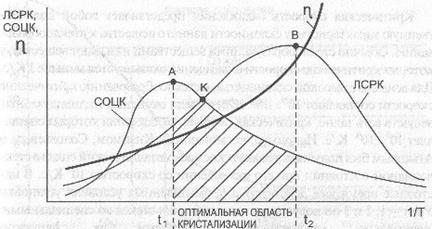
Рис. 5.3. Зависимость скорости образования центров кристаллизации (СОЦК), линейной скорости роста кристаллов (ЛСРК) и вязкости стекломассы n от температуры
По Тамману, способность жидкости к стеклованию в области переохлаждения зависит от:
1. скорости образования центров кристаллизации (СОЦК);
2. линейной скорости роста кристаллов (ЛСРК);
3. вязкости (n)
Из приведенного графика (рис. 5.3) следует, что:
1) расплавы тем меньше склонны к кристаллизации, чем меньше ЛСРК и СОЦК и чем дальше расположены их максимумы;
2) вещество тем легче переходит в стеклообразное состояние, чем больше его вязкость и чем быстрее она увеличивается с падением температуры, что убедительно подтверждается твердением различных жидкостей, расплавов (табл. 5.3);
3) для получения вещества в стеклообразном состоянии необходимо проводить охлаждение с достаточно высокой скоростью, чтобы быстро миновать температуру оптимума кристаллизации.
Зависимость характера твердения жидкости от вязкости
 Критическая скорость охлаждения представляет собой количественную характеристику склонности данного вещества к стеклообразованию. Обычно стеклообразующими веществами называют вещества, у которых критические скорости охлаждения оказываются меньше 1 К/с. Для веществ с высокой склонностью к стеклообразованию критические скорости составляют 10(-1) ...10(-2) К/с, а среди оксидных индивидуальных веществ есть такие, критическая скорость охлаждения которых составляет 10(3) ...10(6) К/с. Например, космонавтами Кизимом, Соловьевым и Атьковым был получен в условиях космоса металлический сплав в стекловидном состоянии при его охлаждении со скоростью 106 К/с. В настоящее время уже существуют в промышленных условиях установки Урал — 1, 2 и 3 по получению металлических стекол со специальными, значительно улучшенными свойствами на Ачинском металлургическом заводе Челябинской области.
Критическая скорость охлаждения представляет собой количественную характеристику склонности данного вещества к стеклообразованию. Обычно стеклообразующими веществами называют вещества, у которых критические скорости охлаждения оказываются меньше 1 К/с. Для веществ с высокой склонностью к стеклообразованию критические скорости составляют 10(-1) ...10(-2) К/с, а среди оксидных индивидуальных веществ есть такие, критическая скорость охлаждения которых составляет 10(3) ...10(6) К/с. Например, космонавтами Кизимом, Соловьевым и Атьковым был получен в условиях космоса металлический сплав в стекловидном состоянии при его охлаждении со скоростью 106 К/с. В настоящее время уже существуют в промышленных условиях установки Урал — 1, 2 и 3 по получению металлических стекол со специальными, значительно улучшенными свойствами на Ачинском металлургическом заводе Челябинской области.
15. Вязкость.
Вязкость — важнейшая характеристика, предопределяющая процессы варки и выработки стекла, отжига и закалки.
По закону Ньютона при движении одного слоя жидкости относительно другого возникает противодействующая сила f, пропорциональная площади соприкосновения слоев S и градиенту скорости — dV/ dx (dх — расстояние между слоями): f=nS(dV/dx)
Коэффициент пропорциональности n называется коэффициентом внутреннего трения или вязкостью жидкости.
Если S=1, dV/dx=1, то f=n. Т.о., вязкость — это сила трения между двумя параллельными слоями жидкости, соприкасающимися по площади S=1 см , при градиенте скорости
dV/dx =1
Вязкость очень сильно зависит от температуры.
Зависимость вязкости от температуры.
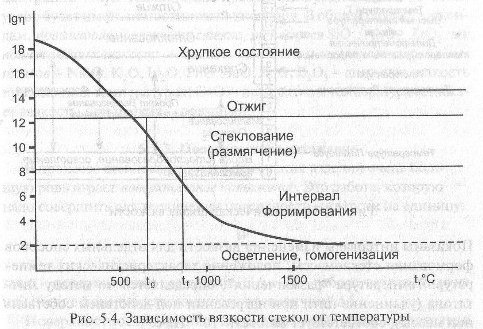
На кривой зависимости n= f(t) отмечают две характерные точки, соответствующие значениям температур t(g)и t(f) для которых вязкости соответственно равны 10(12) и 10(8) Пас. При температуре ниже t(g) (температура стеклования 400...600 С) стекло представляет собой твердое хрупкое тело, а при температуре выше t(f) стекло имеет свойства, типичные для жидкости. В интервале температур t(g) - t(f) стекло находится в пластичном состоянии.
Формование же изделий из стекломассы, при применяемых в настоящее время методах, осуществляется в интервале вязкостей 102...108 Пас.
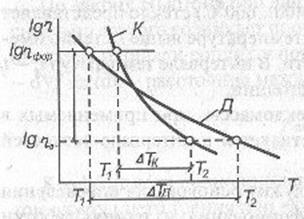
Особую роль при формовании играет температурный градиент вязкости дельта(n)/дельта(t), характеризующий степень изменения вязкости с температурой. В зависимости от изменения вязкости в интервале формования (n=10(2) ...10(8) Пас) различают «длинные» и «короткие» стекла. Мерой "длины" является температурный интервал в котором вязкость изменяется от 102 до108Пас. Для "длинных" стекол он составляет 250...500°С, для "коротких" 100...150°С (рис. 5.6).
Рис. 5.6. Температурная зависимость вязкости длинного Д и короткого К:
Из всех физико-химических свойств вязкость особенно сильно зависит от состава стекла.
Из всех стекол к настоящему времени, тщательно изучена только вязкость чистого кварцевого стекла, его вязкость при температуре 1200С составляет 10(12,3) Пас. Однако уже очень малые примеси щелочных оксидов могут значительно уменьшить эту вязкость.
Так, достаточно в чистое кварцевое стекло ввести 0,001% (мол.) Nа20, чтобы вязкость его уменьшилась на порядок. При такой концентрации Na20 только один кремнекислородный узел из 50000 узлов будет иметь немостиковый кислород. В общем случае, к оксидам, повышающим вязкость стекла, относятся SiO2, Al203, Zr02, а к cнижающим вязкость — оксиды щелочных и щелочноземельных металлов – Na2O, K2O, Li2O, Pb0, Ba0, Zn0; В203 – снижают вязкость при высоких температурах; СаО — при высоких температурах снижает вязкость, при низких — повышает.
16. Поверхностное натяжение
В процессе стекловарения и формования изделий очень боль-шую фоль играет поверхностное натяжение. Это работа, которую надо совершить для увеличения поверхности жидкости на единицу:
Сигма = W/ дельта S,
где сигма— поверхностное натяжение, Н/м;W — работа, затраченная на изменение поверхности жидкости на величину дельта S .
Поверхностное натяжение силикатных расплавов в значительно меньшей степени, чем вязкость, зависит от температуры. Так, у расплавов промышленных стекол в интервале температур 1000... 1400°С поверхностное натяжение составляет 0,22...0,38 Н/м.
Поверхностное натяжение так же, как и вязкость, зависит от химического состава: увеличивают сигма — А1203, Мg0, СаО; уменьшают — К20, РЬО, В203. особенно сильно снижают сигма Сr203, Мо03, V2О5, Аs203,WO3 , сульфиды, селениды. Поверхностное натяжение играет большую роль в процессах стекловарения и формования изделий: высокое поверхностное натяжение препятствует удалению газовой фазы (осветлению) и гомогенизации стекломассы при варке. При отливке изделий, наоборот, стекломассы с большим поверхностном натяжением образуют гладкую и блестящую поверхность.
17. Свойства стекол в твёрдом состоянии.
17. Физические свойства стекла.
Плотность — масса вещества в единице объема кг/м(3):
d = М/V.
Плотность стекла зависит от его химического состава. Среди силикатных стекол минимальную плотность имеет кварцевое стекло
— 2200 кг/м(3) . Плотность боросиликатных стекол меньше плотности кварцевого стекла; плотность стекол, содержащих оксиды Pb, Вi, Та и др., достигает 7500 кг/м . Плотность обычных натрий — кальций - силикатных стекол колеблется в пределах 2500...2600 кг/м(3) . При повышении температуры от 20 до1300°С плотность большинства стекол уменьшается на 6…12%, т.е. в среднем на каждые 100% плотность уменьшается на 15 кг/м(3) .
Упругость — свойство материалов восстанавливать форму и объем после прекращения действия деформирующих сил. Коэффициент пропорциональности между напряжениями и деформациями называется модулем упругости. Упругость стекол в зависимости от их химического состава изменяется в пределах 48*103...12*104 МПа. Упругость кварцевого стекла 71,4 ГПа. Модуль упругости, как и некоторые другие свойства стекол, можно определить, пользуясь принципом аддитивности — суммированием значений свойств образующих компонентов (оксидов) пропорционально их содержанию:
р = а1Х1 + а2Х2+ а3Х3… аnХn , где Р—искомое свойство; а1…аn— содержание оксидов в стекле, %; Х1...Хn— удельный (парциальный) фактор некоторого свойства для соответствующего оксида в стекле.
Увеличивают упругость стекол СаО, В203, А1203, МgО при введении вместо Si02 (частично). Щелочные оксиды снижают модуль упругости, т.к. прочность связей Ме—О значительно ниже прочности связи Si—О.
Прочность характеризует свойство материалов сопротивляться разрушению при воздействии внешних нагрузок. Мерой прочности является предел прочности — максимальное напряжение, вызывающее разрушение материала под действием статической нагрузки. Различают: пределы прочности при сжатии, растяжении, изгибе, кручении, ударе и т.д. Прочность стекол на изгиб изменяется в зависимости от состава в пределах от 0,03 до 0,12 ГПа, на сжатие — от 0,5 до 2,5 ГПа, на растяжение 3,5-10(-2) ...8,5-10(-2) ГПа. Прочность закаленного стекла при прочих равных условиях в 3...4 раза больше прочности отожженного. Значительно повышает прочность стекол обработка их поверхности химическими реагентами с целью удаления дефектов поверхности (мельчайших трещин, царапин и т.д.).
Твердость стекла зависит от химического состава. Стекла имеют различную твердость в пределах 4000...10000 МПа (по шкале Мооса твердость стекол составляет 6...7, что находится между твердостью апатита и кварца). Наиболее твердыми являются кварцевое и малощелочное боросиликатное стекло (до 10...12% В203). С увеличением содержания щелочных оксидов твердость стекол снижается. Наиболее мягкими являются многосвинцовые стекла.
Хрупкость. В области низких температур (ниже t(g) — температуры стеклования) стекло, наряду с алмазом и кварцем, относится к идеально хрупким материалам, т.е. способно разрушаться под действием механических напряжений без заметной пластической деформации. Поскольку хрупкость четче всего проявляется при ударе, ее характеризуют прочностью на удар, которую определяют работой удара, отнесенной к единице объема разрушаемого образца, называемой удельной ударной вязкостью. Прочность стекла на удар зависит от многих факторов. Введение В203 (до 12%) повышает прочность на удар почти вдвое, введение Мg0, Fе203, увеличение содержания SiO2 — на 5...20%. Для силикатных стекол ударная вязкость составляет 1,5...2 кН/м, что на 2 порядка ниже, чем у металлов.
18. Теплофизические свойства стекла.
Теплоемкость стекол различного химического состава колеблется от 0,3 до 1,05 кДж/(кг К). С повышением температуры до tg теплоемкость увеличивается незначительно, в интервале t8 - t f быстро возрастает. С увеличением содержания щелочных оксидов теплоемкость растет, с увеличением содержания РЬО и ВаО — уменьшаем ся.
Теплопроводность характеризует способность вещества проводить тепло в градиентном температурном поле.
Теплопроводность стекла характеризуется коэффициентом теплопроводности ,который для различных силикатных стекол колеблется от 0,7 до 1,3 Вт/(Щ;К). Наибольшую теплопроводность имеет различное кварцевое стекло. Стекло является плохим проводником тепла. С повышением температуры теплопроводность увеличивается и при нагревании выше tg примерно удваивается. Коэффициент теплопроводности зависит от химического состава стекла и может быть подсчитан по формуле аддетивности.
Термическое расширение тел. Нагревание тела при постоянном объеме вызывает увеличение линейных размеров и объема. Термическое расширение характеризуется объемным и линейным коэффициентами температурного расширения. Истинные значения определяют как дифференциальные величины, учитывающие приращение размеров тела при повышении температуры:
β= 1/v0(∆V/∆t); α = ∆/l0 (∆l/∆t)p
v0 и l0 нач. объемы и длинатела.
На практике пользуются средними значениями β и α а, вычисленными в некотором интервале температур о<∆t <10
Экспериментально проще определять темперащшый коэффициент линейного расширения ТКЛР, чем объемный. Поскольку стекло является изотропным телом, то хорошим приближением, объем коэффициент выражается через линейный.








