Опыт 1. Влияние концентрации реагирующих веществ
Лабораторная работа 4
"Химическое равновесие"
| Группа | |
| ФИО студента | |
| ФИО студента |
Опыт 1. Влияние концентрации реагирующих веществ
на состояние химического равновесия
Реакция FeCl3(p) + 3NH4NCS(p) Û Fe(NCS)3(p) + 3NH4Cl(p)
жёлтый бесцветный красный бесцветный
является обратимой. Наиболее интенсивно окрашенное соединение в системе - Fe(NCS)3 - тиоцианат железа (III). По изменению интенсивности окраски раствора вследствие внешних воздействий можно судить об увеличении или уменьшении концентрации Fe(NCS)3 и, следовательно, о направлении смещения равновесия.
Ход опыта
· Стакан вместимостью 100 мл наполовину заполнить дистиллированной водой, добавить по 1-2 капли концентрированных растворов FeCl3 и NH4NCS, полученный раствор перемешать до однородной окраски и разлить в четыре пробирки.
· Прибавить:
в первую пробирку - 1-2 капли раствора FeCl3;
во вторую пробирку - 1-2 капли раствора NH4NCS;
в третью пробирку - микрошпатель кристаллического NH4Cl.
Четвёртую пробирку оставить в качестве эталона окраски раствора в состоянии начального равновесия.
Результаты и наблюдения
· В состоянии начального равновесия (четвёртая пробирка) раствор окрашен в
цвет.
· Наблюдаемые изменения (увеличение или уменьшение по сравнению с эталонной) интенсивности окраски в пробирках 1-3:
| Номер пробирки | Изменение интенсивности окраски раствора |
| 1 | |
| 2 | |
| 3 |
Обработка результатов
· В обратимой реакции
 (уравнение)
(уравнение)
в равновесии находятся:
 (формулы и названия веществ)
(формулы и названия веществ)
 | |
 | |
 |
· Состояние равновесия характеризуется константой равновесия:
 |
 где [FeCl3], [NH4NCS], [Fe(NCS)3], [NH4Cl] -
где [FeCl3], [NH4NCS], [Fe(NCS)3], [NH4Cl] -
 |
· Изменение концентрации веществ и смещение химического равновесия (анализ на основании изменения окраски растворов):
|
Номер пробирки |
Внешнее воздействие | Изменение концентрации (увеличение - или уменьшение - ¯) | Направление смещения равновесия (вправо, влево) | |||
| FeCl3 | NH4NCS | Fe(NCS)3 | NH4Cl | |||
| 1 | 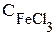
| ¾ | ||||
| 2 | 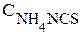
| ¾ | ||||
| 3 | 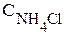
| ¾ | ||||
Вывод
При увеличении концентрации исходных веществ (FeCl3, NH4NCS) равновесие системы смещается в сторону реакции,
(прямой, обратной)
при увеличении концентрации продукта реакции (NH4Cl) - в сторону
реакции, что с принципом
(прямой, обратной) (согласуется, не согласуется)
Ле Шателье.








