Способность дисперсных систем сохранять определенное распределение частиц по объему дисперсионной среды называется седиментационной устойчивостью.
Седиментационная устойчивость коллоидных систем зависит от размеров их частиц чем меньше размер частиц, тем более устойчив коллоидный раствор.
13. Явление коагуляции коллоидных систем. Две стадии коагуляции: скрытая и явная коагуляции. Факторы, вызывающие коагуляцию.
Коагуляция - процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет седиментационную устойчивость. Коагуляция самопроизвольный процесс, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Факторы коагуляции: Коагуляция возникает под действием разнообразных внешних воздействий. К ним относятся: изменение температуры; действие электрического и электромагнитного полей; действие видимого света; облучение элементарными частицами; механическое воздействие; добавление электролитов и др.
Процесс коагуляции имеет две стадии: скрытую и явную.
На скрытой стадии происходит формирование коллоидного раствора гидроксидов и образование микрохлопьев.
А затем на явной стадии процесса образуются крупные хлопья размером 1—3 мм, которые, обладая высокой сорбционной способностью, могут дополнительно извлекать примеси из воды.
14.Коагуляция коллоидных систем электролитами, порог коагуляции. Правило Шульце-Гарди. Определение порога коагуляции. Коагуляция смесями электролитов.
Коагуляция электролитами происходит при сравнительно невысокой концентрации добавляемого электролита. Коагуляцию вызывают все электролиты, так как при введении их в коллоидную систему происходит сжатие диффузного слоя, снижение ζ-потенциала, что приводит к разрушению коллоидной системы. Минимальная концентрация электролита, вызывающая за данный промежуток времени определённый видимый эффект коагуляции, называется порогом коагуляции (γ) или критической концентрацией. Эта величина служит сравнительным критерием агрегативной устойчивости дисперсной системы. Порог коагуляции принято выражать в ммоль/л.
Коагуляцию вызывает ион противополжного знака заряду коллоидной частицы: для положительных – анион, для отрицательных – катион, вводимого в систему электролита.
Правило Шульце-Гарди
Коагулирующее действие иона тем выше, чем выше его заряд.
При увеличении заряда иона на единицу, порог концентрации уменьшается на один порядок
По современной теории коагуляции электролитами, разработанной Б.В. Дерягиным и Л.Д. Ландау, порог коагуляции определяется уравнением:
γ = С 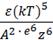
где С – константа, зависящая от числа зарядов катиона и аниона;
k – константа Больцмана;
е – заряд электрона,
Т – температура (в К),
ε – диэлектрическая проницаемость раствора,
А – константа вандерваальсова притяжения;
Z – величина заряда иона.
Если применяется смесь электролитов, то механизм коагуляции осложняется. Происходит смещение адсорбционного равновесия, которое сопровождается перераспределением ионов двойного слоя и изменением порога коагуляции. Наблюдаемые при этом явления можно свести к 3 следующим: антагонизм, синергизм, аддитивность.
1) Аддитивность- коагулирующее действие смеси равно общей сумме коагулирующих эффектов составляющих её электролитов.
2) Антагонизм- действие одного электролита ослабляется при добавлении другого.
3) Синергизм-действие одного электролита усиливается при добавлении другого.
15.Коллоидная защита, ее количественная мера. Значение коллоидной защиты в биологии и медицине.
Нередко наблюдают повышение устойчивости лиофобных золей к коагулирующему действию электролитов при добавлении некоторых веществ. Такие вещества называют защитными, а их стабилизирующее действие на дисперсные системы — коллоидной защитой. Защитными свойствами обладают ВМС.
Коллоидную защиту объясняют адсорбцией лиофильных веществ на поверхности частиц дисперсной фазы. В результате поверхность частиц становится лиофильной и покрывается сольватной оболочкой. Образовавшиеся таким путем оболочки предотвращают агрегацию дисперсных частиц и сообщают лиофобным золям устойчивость, свойственную лиофильным системам.
Коллоидная защита широко используется при получении устойчивых лиофобных золей, применяемых в качестве лекарственных препаратов.
Коллоидная защита играет существенную роль в физиологических процессах. Содержание кальция карбоната и фосфата в крови значительно превышает их растворимость в воде. Отложению этих солей препятствуют защитные вещества крови, которые не позволяют коллоидным частицам нерастворимых солей объединяться в крупные агрегаты и осаждаться. Образование желчных и мочевых камней в организме связано с уменьшением при патологических состояниях защитного действия веществ.
16.Кинетика коагуляции.
В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции.
Скорость коагуляции V – это изменение концентрации коллоидных частиц в единицу времени при постоянном объёме системы.
V = - 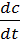 где
где
c – концентрация частиц;
t – время.
Знак «-» стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна.
Степень коагуляции α:
α = 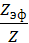 где
где
где Z – общее число столкновений частиц в единицу времени;
Zэф – число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени.
-Если α = 0, коагуляция не происходит, золь агрегативно устойчив.
-Если α = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию.
-Если 0 ‹ α ‹ 1, то идет медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию.
Свойства растворов ВМС.
1. Растворы высокомолекулярных соединений (ВМС) как истинные растворы, их особенности: гомогенность, самопроизвольность образования, равновесность, молекулярность или ионность.
Высокомолекулярные вещества (или полимеры) растворяются в различных низкомолекулярных жидкостях, образуя устойчивые равновесные системы с молекулярной дисперсностью компонентов. Таким образом, растворы полимеров являются гомогенными системами, истинными растворами. Являясь истинными растворами, растворы ВМС всѐ же отличаются от растворов низкомолекулярных веществ, что связано с огромными размерами макромолекул.
Растворение ВМС осуществляется с образованием менее упорядоченной системы из более упорядоченной и, значит, этот процесс протекает с увеличением энтропии (∆S > 0). Растворение ВМС – процесс самопроизвольный, следовательно, при растворении полимеров уменьшается свободная энергия: ∆G = ∆H - T∆S < 0.
Изменение энтальпии (знак ∆Н) при растворении может быть положительным (эндотермический процесс), отрицательным (экзотермический процесс) или равным нулю.
Так как растворы полимеров образуются самопроизвольно с уменьшением свободной энергии, они являются термодинамически устойчивыми системами, которые могут существовать без стабилизаторов неограниченное время. В этом заключается их основное отличие от лиофобных коллоидных систем. В отличие от лиофобных коллоидных систем растворы ВМС являются равновеснымим системами.
Растворы ВМС, подобно растворам низкомолекулярных соединений, могут быть и молекулярными, и ионными, причѐм в последнем случае природа зарядов связана с наличием функциональных групп.
2. Явление набухания ВМС, степень набухания как количественная характеристика процесса набухания. Ограниченное набухание и неограниченное.
При взаимодействии ВМС с растворителем происходит их набухание. Набуханием полимера называется увеличение его объѐма и массы во времени при контакте с растворителем.
При набухании объѐм и масса полимера могут увеличиться в 10 – 15 раз.
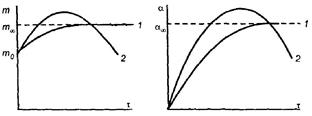
Количественной мерой набухания является степень набухания α:
где m0 и V0– масса и объѐм сухого полимера; m и V – масса и объѐм набухшего полимера. 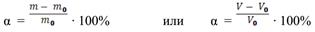
Набухание может быть ограниченным и неограниченным. В случае ограниченного набухания m и α достигают постоянных при данной температуре и концентрации предельных значений m∞ и α∞ (кривая 1) и далее не изменяются. При неограниченном набухании (кривая 2) эти параметры достигают максимальных значений, которые затем уменьшаются за счѐт растворения полимера. В этом случае набухание – первая стадия
растворения полимера.
Набухание – это не простое механическое вхождение молекул НМС в пустоты полимера. Набухание это межмолекулярное взаимодействие, обусловленное, главным образом, сольватацией макромолекул. Полимер набухает не в любом, а лишь в «хорошем» растворителе, т.е. в том растворителе с которым он взаимодействует. Так, полярные полимеры набухают в полярных растворителях, например, белки в воде, а неполярные –в неполярных (каучук в бензоле).
3. Вязкость растворов ВМС, еѐ особенность. Причины высокой вязкости ВМС. Характеристическая вязкость. Уравнение Марка-Хаувинка, расчѐт молекулярной массы полимера.,
Вязкость растворов, содержащих макромолекулы, обычно выше вязкости растворов низкомолекулярных веществ и вязкости коллоидных систем при одной и той же концентрации. Вязкость растворов ВМС не является постоянной величиной; она зависит от условий измерения, в первую очередь от скорости движения раствора в вискозиметре. Растворы ВМС являются неньютоновскими жидкостями, так как они не обладают постоянной вязкостью. У растворов ВМС наблюдается аномалия вязкости.
Вязкость растворов ВМС в значительной степени зависит от температуры и свойств растворителя. Растворители способны влиять на конформационную форму макромолекул и за счѐт этого изменять вязкость одного и того полимера в разных растворителях.
Точное измерение абсолютной вязкости растворов полимеров затруднительно. Поэтому для растворов ВМС различают относительную, удельную, приведѐнную и характеристическую вязкость.








