Физико-химия поверхностных явлений и дисперсных систем в функционировании живых систем. Поверхностные явления. Адсорбция.
1. Природа поверхностной энергии. Поверхностное натяжение. Физический смысл поверхностного натяжения. Энергетическое и силовое выражение поверхностного натяжения. Зависимость поверхностного натяжения от температуры.
К поверхностным явлениям относят те эффекты и особенности поведения веществ, которые наблюдаются на поверхностях раздела фаз. Причиной поверхностных явлений служит особое состояние молекул в слоях жидкостей и твёрдых тел, непосредственно прилегающих к поверхностям раздела фаз.
Молекула жидкости, находящаяся внутри жидкости, окружена себе подобными молекулами. Силы взаимодействия между такими молекулами при этом взаимно уравновешиваются. Поверхностный слой жидкости находится в особых условиях по сравнению со всем объѐмом вещества. Молекулы поверхностного слоя граничат не только с себе подобными молекулами, но и с молекулами газа. Втягивая поверхностные молекулы внутрь фазы, внутреннее давление стремится уменьшить поверхность до минимально возможной в данных условиях.
Для увеличения поверхности жидкости нужно преодолеть силу внутреннего давления и совершить определѐнную механическую работу против сил молекулярного сцепления, против внутреннего давления. Очевидно, что чем оно больше, тем больше энергии надо затратить. Эта энергия сосредотачивается в молекулах, находящихся на поверхности, и называется поверхностной энергией.
Избыток поверхностной энергии, приходящейся на 1 м2 межфазной поверхности, характеризуется поверхностным натяжением (ζ). Бесконечно малое изменение поверхностной энергии Гиббса (dG) с изменением величины площади поверхности при постоянных р и Т равно
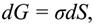
где dS –бесконечно малое изменение площади поверхности; σ – коэффициент
поверхностного натяжения. Из приведѐнного выражения следует (при
постоянстве числа молей компонентов n):
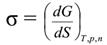
Таким образом, поверхностное натяжение можно представить как частную производную от величины энергии Гиббса по величине межфазной поверхности при р = const и Т=const и постоянных числах молей компонентов.
Согласно энергетическому выражению, поверхностное натяжение ζ есть поверхностная энергия Гиббса единицы поверхности (т.е. удельная поверхностная энергия Гиббса). В таком случае σ равно работе, затраченной на образование единицы поверхности. Энергетической единицей σ является Дж/м2.
Силовое определение поверхностного натяжения формулируется так: ζ – это сила, действующая на поверхности по касательной к ней и стремящаяся сократить свободную поверхность тела до наименьших возможных пределов при данном объѐме. В этом случае единицей измерения ζ является Н/м.
Энергетическое и силовое выражения ζ эквивалентны, и численная величина совпадает в обеих размерностях. Так, для воды при 298 К ζ = 71,96∙10^-3Дж/м2 = 71,96∙10^-3 Н/м. Одна размерность легко выводится из другой: Дж/м2= Н∙м/м2= Н/м.
Поверхностное натяжение жидкостей уменьшается с ростом температуры. Это означает, что при критической температуре границы раздела между фазами исчезают и система «газ – жидкость» из гетерогенной превращается в гомогенную.
При повышении давления увеличивается взаимодействие поверхностных молекул жидкости с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности. Поэтому с повышением давления в системе «жидкость – газ» поверхностное натяжение уменьшается
2. Поверхностная активность (g) как характеристика поведения вещества при адсорбции.
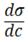
g = - при c → 0
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества и наоборот.
3. Методы определения поверхностного натяжения.
Измерение поверхностного натяжения сталагмометрическим методом. Этот метод определения поверхностного натяжения заключается в измерении объѐма или веса капли, медленно отрывающейся от кончика вертикальной трубки, внутренний радиус которой r.В основе метода лежит предположение, что отрыв капли происходит в тот момент, когда еѐ вес Р становится равным силам поверхностного натяжения, действующим вертикально по окружности трубки, т.е. в момент n отрыва капли Р = 2πrζ.
Если известны объѐм расширенной части сталагмометра V и плотность жидкости ρ, то вес капли Р можно вычислить по формуле 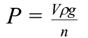
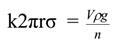
где g – ускорение силы тяжести. Очевидно, что при отрыве капли должно соблюдаться равенство
Обычно проводят относительное определение σ, сравнивая истечение из данного сталагмометра исследуемой жидкости и жидкости с известным поверхностным натяжением. В этом случае пользуются для расчѐта следующей формулой:
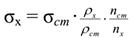
для разбавленных водных растворов, плотность которых мало отличается от единицы, формулу можно упростить:
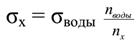
Из полученной формулы следует, что для определения поверхностного натяжения достаточно подсчитать число капель исследуемой жидкости. Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. Например, поверхностное натяжение плазмы крови значительно изменяется при различных заболеваниях (анафилактический шок, рак, и др.). С возрастом у человека поверхностное
натяжение сыворотки крови уменьшается.
Из многочисленных методов измерения поверхностного натяжения при биохимических, физиологических и клинических исследованиях чаще всего используют сталагмометрический метод и метод продавливания пузырьков воздуха.
4. Зависимость поверхностного натяжения от природы и концентрации растворенного вещества (ПАВ, ПИВ и ПНВ). Ориентация молекул ПАВ в поверхностном слое. Правило Дюкло-Траубе.
Растворѐнные вещества в зависимости от природы могут по-разному влиять на поверхностное натяжение жидкостей. Способность растворѐнных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Все вещества по способности изменять поверхностное натяжение растворителя делятся на три группы.
1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть – углеводородный радикал («хвост») и полярную (гидрофильную) часть. Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы в составе молекулы имелись полярные группы: -ОН, -NH2, -COOH, -SO3др.
Мерой способности растворѐнного вещества к понижению поверхностного натяжения раствора является величина производной поверхностного натяжения по концентрации , называемая поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10^-6 Дж ∙ м / моль.
Поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в три раза при увеличении углеводородной цепи на одну метиленовую группу (- СН2-). (Правило Дюкло-Траубе)
ПАВ, как и все вещества в зависимости от способности к электролитической диссоциации, делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ подразделяют на катионные, анионные и амфотерные.
2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щѐлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объѐма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение.
3. Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своѐм составе имеют большое число полярных функциональных групп (например, сахароза).
Всѐ многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трѐх типов:
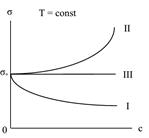
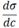
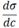
Из графика видно, что для ПАВ < 0, для ПИВ > 0, а для ПНВ = 0. На графике σ0– поверхностное натяжение воды. Отметим, что для
ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю.
Отметим, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением.
5. Адсорбция, основные термины (адсорбент, адсорбтив, адсорбат, десорбция). Химическая и физическая адсорбция.
Под адсорбцией на неподвижной границе раздела фаз понимается накопление одного вещества на поверхности другого. Твѐрдое вещество, на поверхности которого накапливается другое вещество, называется адсорбентом, а поглощаемое вещество – адсорбтивом. Уже адсорбированное вещество называется адсорбатом. Десорбция - процесс, обратный адсорбции
В зависимости от природы сил, действующих между адсорбентом и адсорбатом различают физическую и химическую адсорбции.
Физическая адсорбция обусловлена межмолекулярным взаимодействием за счёт сил Ван дер-Ваальса или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецефичность, экзотермичность.
Химическая адсорбция осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Химическая адсорбция: необратима, специфична и локализована
6. Адсорбция на подвижной границе раздела фаз (на жидкости). Уравнение Гиббса для вычисления величины адсорбции. Его анализ.
Изменение концентрации растворѐнного вещества в поверхностном
слое раствора (или вообще на границе раздела фаз) называется адсорбцией.
Дж. Гиббс на основе второго закона термодинамики в 70-х гг. XIX в.
вывел важное уравнение, связывающее величину адсорбции со способностью
растворѐнного вещества изменять поверхностное натяжение раствора:
где Г – количество адсорбированного вещества, моль/м2; с– молярная концентрация растворѐнного вещества, моль/дм3, Т – температура, при которой происходит адсорбция, R – газовая постоянная, –поверхностная активность. 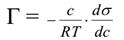
Уравнение Гиббса отражает следующую зависимость: чем сильнее уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше его поверхностная активность. Это свидетельствует о том, что знак «минус» указывает на обратную зависимость между величиной адсорбции Г и поверхностным натяжением σ.
Если < 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если же > 0, то Г < 0, т.е. адсорбция отрицательна (вещество накапливается в объѐме), это характерно для ПИВ. 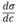
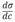
7. Адсорбция на твѐрдых поверхностях. Удельная адсорбция. Факторы определяющие количество поглощѐнного газа или пара на твѐрдом адсорбенте
При адсорбции веществ на поверхности твѐрдых адсорбентов изменяется химический состав поверхности адсорбента. Количественной характеристикой этого процесса является величина удельной адсорбции Г.
Удельная адсорбция – это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы адсорбента.В качестве адсорбентов обычно применяют мелкоизмельченные вещества или пористые тела, что обеспечивает большую площадь поверхности раздела фаз, которую определить практически невозможно. Поэтому удельная адсорбция для твердых адсорбентов преимущественно выражается в молях поглощенного вещества на единицу массы адсорбента:
Г = (моль/г), 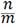
где n –количество адсорбата, моль; m – масса адсорбента, г.
Адсорбция газов и паров адсорбата на твердых адсорбентах – процесс, протекающий за счет сил Ван-дер-Ваальса и водородных связей. Количество поглощенного газа или пара на твѐрдых поверхностях зависит от следующих факторов.
1. От свободной поверхностной энергии адсорбента. Она весьма велика у адсорбентов с аморфной структурой (активированный уголь) и у кристаллических веществ (оксиды алюминия, кремния). Адсорбент тем эффективнее, чем меньше измельчен.
2. От сродства адсорбтива к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные на неполярных. Чем больше адсорбент склонен к межмолекулярным взаимодействиям, тем интенсивнее идет адсорбция.
3. При физической адсорбции из смеси газов или паров лучше адсорбируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям.
4. От концентрации адсорбата. Зависимость имеет сложный характер, так как с адсорбцией идет одновременно процесс десорбции. При равенстве скоростей этих процессов наступает равновесие.
8. Уравнение Ленгмюра, его анализ. Изотерма адсорбции, предельная адсорбция.
Основные положения теории Ленгмюра следующие:
- адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах, где имеются участки с наиболее нескомпенсированными силовыми полями;
-каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что приводит к образованию мономолекулярного слоя поглощаемого вещества;
-процесс адсорбции обратим и носит динамический характер, т.к. адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция такого же числа новых молекул.
Исходя из этих положений, Ленгмюр предложил уравнение адсорбции:
Где Г∞- значение предельной адсорбции; с – равновесная концентрация адсорбента системе; К – константа адсорбционного равновесия. 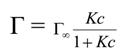
Зависимость адсорбции от концентрации ПАВ (изотерма адсорбции) имеет вид:
На кривой четко видны три участка: 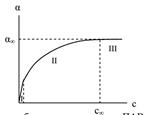
I - ый участок – это прямая линия, выходящая из начала координат.
Действительно, при малых концентрациях, когда с → 0 и (1 + Кс) ≈1, уравнение принимает вид Г = Г∞∙Кс, т.е. величина адсорбции прямо
пропорциональна концентрации или давлению адсорбата.
III – участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом
Кс ›› 1 и (1 + Кс) ≈ Кс, тогда Г = Г∞ (произошло насыщение поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой).
II – ой участок соответствует криволинейной части графика и описывается полным уравнением Ленгмюра.
9. Адсорбция на границе твердое тело – жидкость, еѐ особенности. Факторы еѐ определяющие: величина удельной поверхности и сродство адсорбента к адсорбтиву, природа растворителя, природа поглощаемого вещества, влияние концентрации растворѐнного вещества на процесс адсорбции, влияние температуры.
Существенным отличием адсорбции веществ из растворов является конкуренция между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Рассматривая этот вид адсорбции, остановимся на следующем:
1. При адсорбции из раствора важным фактором является величина удельной поверхности адсорбента и его сродство к поглощаемому веществу. Гидрофильные адсорбенты (силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) -–неполярные вещества.
2. Природа растворителя:Чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
3. Природа поглощаемого вещества:
а) выполняется правило «подобное взаимодействует с подобным», т.е. должно быть сродство между адсорбентом и адсорбтивом;
б) Выполняется правило Шилова: Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента.
в) правило Ребиндера (правило уравнивания полярностей Ребиндера): На поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причѐм с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает. Эффективней всего адсорбируются молекулы веществ, имеющих дифильное строение. В этом случае идѐт эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент молекулы обращен всегда к полярной фазе – к воде, силикагелю, а неполярный фрагмент – к неполярной (гидрофобной) фазе –активированному углю, маслу.
4. Влияние концентрации растворенного вещества на процесс адсорбции при постоянной Т описывается уравнением Ленгмюра.
5. Повышение температуры снижает эффективность адсорбции. Это объясняется ослаблением взаимодействия между адсорбентом и адсорбатом.
10.Адсорбция растворѐнного в жидкости вещества на твѐрдом адсорбенте, молекулярная адсорбция и ионная адсорбция.
Молекулярная адсорбция – адсорбция из растворов неэлектролитов. В этих случаях растворенное вещество адсорбируется на поверхности твердого тела в виде молекул.
Особенности молекулярной адсорбции: наряду с растворѐнным веществом адсорбируются молекулы растворителя. Поэтому для адсорбции растворѐнного вещества его молекулы должны вытеснять с поверхности молекулы растворителя.
Ионная адсорбция – адсорбция из растворов сильных электролитов. В этом случае растворённое вещество адсорбируется в виде ионов
11.Ионная адсорбция. Факторы, влияющие на ионную адсорбцию: химическая природа адсорбента, химическая природа ионов (лиотропные ряды Гофмейстера, влияние заряда иона на адсорбцию, правило Панетта – Фаянса).
Особенности ионной адсорбции:
1. Адсорбируются заряженные частицы (ионы), а не молекулы.
2. Адсорбция происходит только на полярных адсорбентах, поэтому её часто называют полярной адсорбцией.








