Предмет и основные понятия химической кинетики. Химическое равновесие.
1. Предмет химической кинетики. Скорость реакции, средняя скорость реакции в интервале, истинная скорость.
Химическая кинетика изучает закономерности протекания химических процессов во времени.
Для начала реакции необходимо ослабить и разорвать связи в молекулах исходных веществ. Затем частицы начинают двигаться и во время движения испытывают столкновения, но не все столкновения приводят к началу реакции, а только те, которые обладают избыточной энергией. Эта энергия называется энергией активации.
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
dc
V=± dt
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
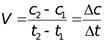 СКОРОСТЬ ВСЕГДА ПОЛОЖИТЕЛЬНА
СКОРОСТЬ ВСЕГДА ПОЛОЖИТЕЛЬНА
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при dt→0
Скорость химической реакции зависит от: природы реагирующих вещ-в, концентрации, температуры, присутствия катализаторов и т.д.
2. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные).
В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе
В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах.
Микрогетерогенные реакции – это реакции происходящие в коллоидных системах.
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
1) параллельные: протекание нескольких процессов с участием одних и тех же веществ;
2) последовательные: конечные продукты образуются через ряд промежуточных продуктов,
3) сопряженные: протекание одной реакции инициирует осуществление второй;
4) цепные: протекающие через ряд регулярно повторяющихся элементарных стадий
3. Молекулярность элементарного акта реакции. Порядок реакции.
Молекулярность реакции - число молекул, реагирующих в одном элементарном акте реакции.
По молекулярности различают мономолекулярные, бимолекулярные, тримолекулярные реакции
Порядок реакции — это число, равное сумме показателей степени концентраций реагирующих веществ в уравнении скорости.
1) Реакции нулевого порядка (n=0).
2) Реакции первого порядка ( n=1).
3) Реакции второго порядка ( n=2).
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции.
4. Зависимость скорости реакции от концентрации. Закон действующих масс. Константа скорости химической реакции.
Основной постулат химической кинетики – закон действующих масс аА + вВ = АВ
W = k [A] а ∙[B]b
Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в степени равной их молярным коэффициентам.
Эти степени называются частными порядками реакции:
а - частный порядок реакции по веществу А,
b - частный порядок реакции по веществу В.
Сумма частных порядков дает полный порядок реакции n: n=a+b.
k - константа скорости реакции.( не зависит от значения концентраций реагентов)
5. Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
Скорость химической реакции увеличивается с повышением температуры.
Правило Вант-Гоффа:
При повышении температуры на каждые 10 градусов, скорость реакции увеличивается в 2-4 раза
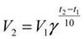
где V2 – скорость протекания реакции при температуре t2, а V1 – скорость протекания реакции при температуре t1;
ɣ - температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей при температуре t+10 и t.
6. Энергия активации. Уравнение Аррениуса. Энергетический профиль реакции.
Энергия активации- это та избыточная энергия, которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции. (Активация вызывается повышением температуры, действием квантов света и т. д.)
Энергия активации постоянна в данном температурном интервале и определяется механизмом реакции.
Ее можно определить графически по уравнению Аррениуса:
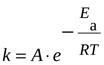 где А-предэкспоненциальный множитель
где А-предэкспоненциальный множитель
Зная энергию активации и константу скорости при одной температуре, можно определить константу скорости при другой темепратуре
или
Зная величины констант скоростей при двух температурах, можно расчитать значение энергии активации. 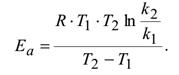
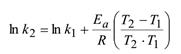
или
R-  газовая постоянная,
газовая постоянная,
T- температура в Кельвинах
7. Понятие о теории активных соударений, образование активированного комплекса.
Теория активных соударений. Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема
w=qz общ, где
q – коэффициент пропорциональности;
zобщ– общее число столкновений.
В теории соударений используются следующие допущения:
1. Частицы бесструктурны – это шары с радиусом r;
2. В момент соударения молекулы ведут себя как упругие шары. Т.е.
суммарная энергия молекул до и после соударения остается постоянной, но
может перераспределяться между молекулами.
3. Реагируют только молекулы, которые обладают энергией активации.
4. Число двойных активных столкновений определяется соотношением:
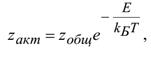
где zобщ– общее число столкновений, 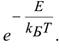
zакт– число активных столкновений,
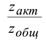 -доля активных столкновений, равная множителю Больцмана
-доля активных столкновений, равная множителю Больцмана
5. Процесс превращения исходных веществ в продукты происходит мгновенно
в момент соударения активных молекул.
6. Скорость реакции А+В=С определяется выражением
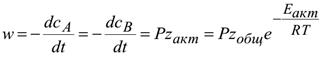
где Р – стерический фактор.
Он определяется опытным путем из соотношения опытной и теоретической
скорости. Р<1.
Недостатки теории активных соударений.
1) бесструктурность частиц – они рассматриваются как шары
2) элементарный акт рассматривается как мгновенный, в действительности это сложный процесс перераспределения связей, требующий определенного времени.
Теория активных соударений объясняет много разнообразных факторов, но не объясняет влияния на скорость реакции растворителя, давления, добавок инертных газов, не позволяет сделать теоретическую оценку стерического фактора.
При сближении активированных молекул взаимодействие между ними начинается еще до столкновения – старая связь ослабевает, но еще не разрушена, при этом одновременно образуется новая связь. Таким образом, образуется трехатомный конгломерат (активированный комплекс), который находится в равновесии с исходными веществами и затем распадается на продукты.

8. Катализ. Гомогенный и гетерогенный катализ, положительный и отрицательный. Промоторы, ингибиторы, каталитические яды. Требования к катализаторам, принцип действия.
Катализ- это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде.
Гомогенный катализ- катализатор и реагенты находятся в одной фазе
Гетерогенный катализ-катализатор и реагенты находятся в разных фазах
Положительный катализатор-под действием которого скорость реакции увеличивается
Отрицательный катализатор-под действием которого скорость реакции уменьшается (ингибиторы)
Принципы катализа:
1) катализатор принимает участие в химической реакции, образуя промежуточные продукты, но в конце реакции выделяется в химически неизменном виде. Физическое состояние катализатора, входящего в активный комплекс, может существенно изменяться, например, уменьшатся размеры зерен твердого катализатора, изменится структура поверхностных слоев;
2) катализатор не смещает положение равновесия, а лишь увеличивает скорость прямой и обратной реакции в равной степени;
3) действие катализатора является специфичным (селективным);
4) катализатор увеличивает скорость реакции за счет уменьшения Еакт, ведет реакцию по пути с меньшим энергетическим барьером.
Промоторы - это вещества, которые не обладают каталитическими свойствами, но добавление их к катализатору значительно увеличивает его активность.
Каталитические яды - это вещества, понижающие активность катализатора.
9. Особенности каталитической активности ферментов.
Ферментативными реакциями называются такие химические процессы в биологических системах, скорость которых регулируется веществами биологического происхождения. Это белковые молекулы, называемые ферментами или энзимами.
Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ:
1) высокая специфичность;
2) эффективность действия;
3) биологические катализаторы образуются и разрушаются в процессе жизнедеятельности организма.
По своей каталитической активности биологические катализаторы в тысячи раз превышают неорганические. Специфичность действия связана с особенностями структуры фермента и субстрата. Одни части каталитической системы выполняют функции, главным образом связанные с пространственной организацией системы, другие в этой организационной системе осуществляют собственно катализ. Т.е., как и при неферментативном катализе, в каталитической реакции участвует не вся белковая молекула в целом, а лишь определенные ее участки – активные центры фермента.
10. Химическое равновесие. Принцип Ле-Шателье.
Химическое равновесие — состояние химической системы, при котором скорости прямой и обратной реакций равны между собой.
В ходе самопроизвольного процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Дальнейшее изменение энергии Гиббса при неизменных условиях становится невозможным, система переходит в состояние химического равновесия
∆G = 0
Любая химическая реакция протекает самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Равновесие может существовать только для обратимых реакций.
Принцип Ле Шателье:
воздействие какого-либо фактора на равновесную систему стимулирует смещение равновесия в таком направлении, которое способствует восстановлению первоначальных характеристик системы.
11. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах.
Необратимые химические реакции при данных условиях самопроизвольно протекают только в одном направлении и при этом получившиеся продукты не взаимодействуют друг с другом с образованием исходных веществ. В связи с этим необратимые реакции заканчиваются либо полным расходованием всех исходных веществ, либо – одного из них, находящегося в недостатке. Реакция с высокой долей вероятности будет необратимой, если при ее протекании выделяется или затрачивается большое количество энергии.
Обратимые реакции протекают одновременно в двух противоположных направлениях.
В начальный момент времени (когда в системе присутствуют только исходные вещества) протекает лишь прямая реакция, идущая слева направо. Скорость ее при этом будет максимальной, но в дальнейшем скорость прямой реакции будет падать (рис. 13).
В результате протекания прямой реакции в системе появятся и начнут накапливаться конечные вещества, которые будут взаимодействовать между собой. Это приведет к возникновению обратной реакции, идущей справа налево. Скорость ее в начальный момент времени будет равна нулю, но затем начнет плавно возрастать.
Состояния химического равновесия в случае обратимой реакции можно достичь двумя путями:
-из начального состояния системы, в котором находятся только исходные вещества,
-либо из начального состояния системы, в котором находятся только продукты реакции.
Состояние устойчивого термодинамического равновесия в изолированной системе наступает при максимуме энтропии.
Состояние устойчивого термодинамического равновесия в закрытой системе наступает при минимуме внутренней энергии, энтальпии, энергии Гельмгольца и Гиббса в зависимости от вида реакции.
12. Константа химического равновесия.
Константа химического равновесия — характеристика химической реакции , по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих в-в, о максимально возможном выходе продукта реакции при тех или иных условиях. Численное значение Kp характеризует положение равновесия при данной температуре и не меняется с изменением концентрации реагирующих в-в.
aA+bB↔cC+dD
Кр=Кпр/Кобр
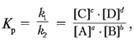
[A]a и [B]b равновесные концентрации
Отношение констант скоростей прямой и обратной реакций является величиной постоянной и называется константой равновесия








