Комплексные соединения
Комплексные соединения это молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла, нейтральных молекул или других ионов. Они способны существовать как в кристалле, так и в растворе.
1. Основные положения и понятия координационной теории Вернера.
Главная валентность - валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории валентности.
Побочная валентность – валентность, в результате проявления которой и образуется комплексное соединение.
Центральные атомы или комплексообразователи - атомы стремящиеся равномерно окружить себя ионами или молекулами, являясь центром притяжения.
Лигандами - ионы или молекулы, непосредственно связанные с комплексообразователем. Посредством главной валентности присоединяются ионы-лиганды, а посредством побочной валентности – ионы и молекулы.
Координация - притяжение лиганд к комплексообразователю
Координационное число - число лиганд комплексообразователя
Число координационных мест, занимаемых лигандом около комплексообразователя, называется его координационной ёмкостью или дентатностью
Комплексообразователь и лиганды составляют внутреннюю сферу соединения или комплекс (в формулах комплекс заключают в квадратные скобки). Ионы, не связанные непосредственно с комплексообразвателем, составляют внешнюю координационную сферу.
2. Классификация комплексных соединений. Приведите примеры.
По заряду комплексного иона различают:
· катионные [Cu(NH3)4]2
· анионные [Co(NO3)6]3-
· нейтральные [Pt(NH3)Cl2]0
По характеру лигандов различают:
· акво- [Сu(H2O)4]SO4
· аммино-[Cu(NH3)4]SO4
· ацидо- К2[Cu(Cl)4]
· гидроксо-K2[Cu(OH)4]
По структуре внутренней сферы различают внутрикомплексные(циклические) соединения. Например, в живом организме встречаются клешневидные (хелатные) пятичленные циклы.
3. Комплексообразующая способность s-р-и d- элементов. Еѐ причины.
Комплексообразующая способность катионов определяется следующими факторами:
Заряд катиона, радиус катиона и электронная конфигурация катиона.
Чем больше заряд катиона и меньше радиус, тем прочнее связь комплексообразователя с лигандами. Поэтому катионы s- элементов (К+, Nа+, Са+2, Мg+2 и др.) обладающие относительно большим радиусом и малым зарядом, имеют низкую комплексообразующую способность. Катионы d-элементов (Со+3, Рt+4, Сr+3и др.), имеющие, как правило небольшой радиус и высокий заряд, являются хорошими комплексообразователями. (образуют дативную связь)
4. Типы гибридизации комплексных соединений. Внешнеорбитальные и внутриорбитальные комплексные соединения.
Для катионов d- элементов характерны октаэдрические комплексы. При их образовании возможны два типа гибридизации: d2sр3 и sр3d2, в зависимости от того, какие d-орбитали комплексообразователя доступны для лиганд.
- Гибридизация d2sр3 осуществляется в том случае, если в образовании σ связей участвуют s и р орбитали внешнего уровня и две d-орбитали предпоследнего уровня. Этот вид гибридизации называется внутренней гибридизацией, а образующиеся комплексы внутриорбитальными.
При внутренней гибридизации лиганды прочно связаны с комплексообразователем, поэтому внутриорбитальные комплексы отличаются высокой устойчивостью.
- Если на образование σ-связей комплексообразователь поставляет только орбитали внешнего внешнего уровня, то осуществляется sр3d2 гибридизация. Её называют внешней, а образующиеся комплексы внешнеорбитальными. Такие комплексы образуют d-элементы с полностью заселёнными d подуровнями. Внешнеорбитальные комплексы обладают меньшей прочностью по сравнению с внутриорбитальными.
- Если у катиона d- элемента d подуровень заселен неспаренными электронами, то тип гибридизации определяется природой лиганда.
Лиганды, обладающие достаточной электронодонорной способностью, могут «вытеснить» электроны с двух орбиталей d подуровня и заставить их спариться на остальных двух орбиталях. При этом нарушается правило Гунда. Такой способностью обладают, например: цианид-ионы, поэтому они образуют внутриорбитальные комплексы
Если же лиганд не обладает достаточной электронодонорной способностью, то образуется внешнеорбитальный комплекс, например: [Fe(Н2О)6]2+(Число неспаренных электронов в процессе комплексообразования в этом случае не меняется)
5. Устойчивость комплексных соединений в растворе. Константа нестойкости комплексных соединений, еѐ связь с константой устойчивости.
Ионы внешней сферы соединены с комплексом ионной связью, поэтому в водных растворах они легко отщепляются: [Fe(Н2О)6]SO4 ↔ SO42- + [Fe(Н2О)6]2+.
Этот процесс называется первичной диссоциацией. Внутренняя сфера в зависимости от прочности также способна диссоциировать на комплексообразователь и лиганды:
[Fe(Н2О)6]2+ ↔ Fe2+ + 6 Н2О – это вторичная диссоциация. Она аналогична диссоциации слабых электролитов и характеризуется константой равновесия:
Крав. = 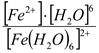
константа равновесия может служить мерой прочности комплекса: чем менее стоек комплекс, тем больше концентрация простых ионов или молекул Fe2+ и Н2О, тем больше численное значение константы. Поэтому константу равновесия, называют константой нестойкости комплекса. Величина, обратная константе нестойкости, называется константой устойчивости:
Куст.= 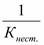 =
= 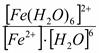 .
.
6. Значение комплексных соединений в медицине.
В виде аквакомплексов находятся в крови, лимфе и тканевых жидкостях ионы щелочных и щелочноземельных металлов, выполняющих в организме важные и многообразные физиологические функции. Ионы d – элементов в результате высокой комплексообразующей способности находятся в организме исключительно в виде комплексов с белками и входят в состав гормонов, ферментов, витаминов и других жизненно важных соединений. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов - например витамин В12 , участвующий в процессах кроветворения, является комплексом кобальта.
Токсические свойства некоторых веществ обусловлены их высокой комплексообразующей способностью. Например, токсическое действие на организм цианидов и оксида углерода объясняется их способностью образовывать прочные комплексы с катионами железа. Цианиды блокируют атомы железа, входящие в состав дыхательного фермента цитохромоксидазы, в результате прекращается клеточное дыхание. Оксид углерода (СО) связывает железо гемоглобина, вследствие этого гемоглобин утрачивает способность осуществлять транспорт кислорода.
В медицинской практике при лечении многих заболеваний в качестве лекарственных препаратов используются соединения меди, серебра, цинка, кобальта, хрома, золота, платины, ртути и др.








