0,001М – милимолярный раствор.
ОБЩИЕ СВОЙСТВА РАСТВОРОВ
1. Раствор как гомогенная система. Растворитель, растворенное вещество. Классификация растворов по степени дисперсности, по растворимости в воде, по способности к диссоциации.
Растворы - гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции.
Растворитель - тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения.
В лабораторной практике различают концентрированные растворы (содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя).
Иногда растворы определяют как дисперсные системы. При этом растворитель, в котором распределено вещество, называется дисперсной средой, а частицы растворенного вещества - дисперсной фазой. По степени дисперсности различают
1) Взвеси- это дисперсные системы, в которых размеры распределенных частиц сравнительно велики (10^-7-10^-5м ). Делятся на : суспензии (распределенное вещ-во твердое) и эмульсии (распределенное вещество жидкое). Взвеси неустойчивы, частицы диспергированного вещ-ва выпадают в осадок либо всплывают. Процесс разделения взвесей для суспензий-седиментация, для эмульсий-расслоение.
2) Коллоидные системы-частицы распределенного вещества имеют размеры порядка 10^-9-10^-7 м. Каждая частица может содержать большое число атомов или молекул. Видны в ультрамикроскоп, где свет падает сзади либо сбоку.
3) Истинные растворы-диспергированное вещ-во распределено в среде в виде молекул или ионов, частицы имеют размеры порядка 10^-10-10^-7м. Растворы однородные, устойчивые.
Классификация по растворимости в воде:
| Хорошо растворимые- если при комнатной температуре в 100 г воды растворяется больше 1 г этого вещества. Малорастворимые– если при таких условиях растворяется меньше 1 г вещества в 100 г воды. Практически нерастворимые вещества- такие вещества, растворимость которых меньше 0,01 г в 100 |
2. Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр).
1. Массовая доля ( ω) - отношение массы соответствующего компонента в растворе к общей массе этого раствора. Выражается в единицах или процентах.
ω ( х)= 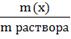
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
2. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора.
См= 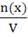
Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Сокращенно пишут М.
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество моль- эквивалентов вещества, содержащегося в 1 л раствора.
СN= 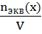
Единица измерения моль-экв/л, Сокращенно обозначается буквой N.
4.Титр- титрованная концентрация (Т). Показывает сколько грамм растворенного вещества содержится в 1 мл раствора (выражается в г\мл)
m(вещ-ва) V-объем в мл
T=_________
V n экв
N Mэкв(х) N-нормальная концентрация ____ ; Mэкв(х)- моль-экв масса вещ-ва
Т=____________ V
1000
3. Понятие о химическом эквиваленте, закон эквивалентов и его следствие.
Эквивалент вещества - такое количество его, которое взаимодействует с одним моль атомов водорода или вообще с одним эквивалентом любого другого вещества. Обозначается эквивалент Э (Х), выражается в молях.
Закон эквивалентов: Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам.
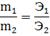
m1, m2- массы веществ,
Э1, Э2- эквиваленты веществ.
4. Эквивалентная масса вещества, еѐ связь с молярной массой для различных классов неорганических соединений.
Масса одного эквивалента вещества называется эквивалентной массой, обозначается Мэкв, выражается в г/моль-экв.
Эквивалент зависит от типа реакции.
Способы расчета Мэкв.
• 
• 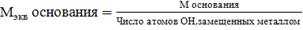
• 
5. Стандартные растворы, способы их приготовления. Понятия «первичный стандарт» и «вторичный стандарт».
Стандартные - растворы с известной концентрацией, которые служат для определения концентрации других растворов
Способы приготовления стандартных растворов:
· Метод точной навески
Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
- вещество должно быть чистым (без примесей)
- иметь постоянный состав (соответствовать определённой химической формуле)
- быть устойчивым как на воздухе, так и в растворе
- иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными.
· Метод неточной или приблизительной навески
Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
· Метод разбавления
Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
· Фиксанальный метод
Предполагает приготовление растворов из фиксаналов. Фиксанал - ампула с сухим веществом или раствором с точно известным количеством эквивалентов. концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
Первичный стандарт - стандартный раствор, приготовленный по точной навеске
Вторичный стандарт - стандартный раствор, характеристики которого установлены по первичному стандарту
6. Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. Расчет рН и рОН растворов.
Электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении.
Вода представляет собой слабый амфотерный электролит:
Н2О ↔ Н+ + ОН-
или, более точно:
2 Н2O ↔ H3O+ + OH-
Если к чистой воде прибавить кислоту, концентрация ионов водорода повысится и станет больше, чем 10-7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение
[H+] + [OH-] = 10-14
Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода:
рН = - lg[H+]
7. Степень диссоциации (α) электролита как количественная характеристика равновесия процесса ионизации. Деление электролитов на сильные и слабые по величине степени диссоциации. Факторы, влияющие на величину степени диссоциации.
Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе:

Электролиты со степенью диссоциации больше 0,3 (30%)-сильные.
От 0,03(3%) до 0,3 (30%)-средние
Менее 0,03(3%)-слабые
Степень электролитическое диссоциации зависит от природы электролита, его концентрации и температуры.
8. Константа диссоциации как константа равновесия процесса диссоциации. Показатель константы диссоциации (рК).
Константа диссоциации представляет собой константу равновесия обратимой реакции электролитического разложения молекул электролита.
Если представить уравнение реакции как
KnAm = nKm+ + mAn-
То константа диссоциации будет равна
n[Km+] m[An-]
K д= _____________
[KnAm]
Для оценки силы слабого электролита вместо величины константы диссоциации используют ее десятичный логарифм, взятый с обратным знаком (показатель константы диссоциации pK)
pK= -lgK дисс.
9. Закон разбавления Оствальда, его физический смысл.
Степень диссоциации определяется константой диссоциации (Кд) и концентрацией (с) слабого электролита в растворе.
Закон разбавления Оствальда: с разбавлением раствора, т.е. с уменьшением концентрации, степень диссоциации (а) слабого электролита увеличивается, и наоборот.
Закон разбавления Оствальда для слабого бинарного электролита:
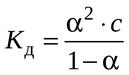
При очень низкой степень диссоциации (а<1%) принимают , что 1-а=1. Тогда:
Кд=а2 с => a=√ Kд/c
БУФЕРНЫЕ РАСТВОРЫ
1. Буферные растворы. Классификация буферных растворов. Механизм буферного действия.
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы.
Различают в основном протолитические буферные растворы двух типов:
- Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного основания
кислота
СН3СООNa → Na+ + CH3COO-
- Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+ избыток сопряженной кислоты
Основание
NH4Cl → Cl- + NH4+
Механизм действия буферных растворов
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
· При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН.
CH3COO ‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
рН = рК + ℓg 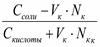
- При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
рН = рК + ℓg 
- При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
2. Уравнение Гендерсона – Гассельбаха для определения рН и рОН протолитических буферных растворов. Факторы, влияющие на рН и рОН буферных растворов.
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
рН = рК + ℓg  , pOH = pK + ℓg
, pOH = pK + ℓg  ,
,
где рК = -ℓg КД.
С – молярная или эквивалентная концентрация электролита (C = V N)
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
3. Буферная ѐмкость. Количественное определение буферной ѐмкости. Зона буферного действия.
Буферная ёмкость-
Это способность буферной системы противодействовать изменению рН среды.
Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Она равна рН = рК ± 1
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
В = 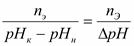
В – буферная ёмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи,
рНН – начальное значение рН ( до добавления кислоты или щелочи)
рНК – конечное значение рН (после добавления кислоты или щелочи)
ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
В = 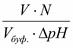
V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф.- объём буферного раствора,
Δ рН – изменение рН.
4. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая и белковая. Механизм их действия.








