Современное представление о строении атома. 1. Задание {{ 49 }} ТЗ № 49
Заполнение электронами s-подуровня происходит у атомов элементов
+ калия
+ магния
+ гелия
- алюминия
- серы
- железа
+ бария
2. Задание {{ 50 }} ТЗ № 50
Заполнение электронами p-подуровня происходит у атомов элементов
- калия
- магния
- гелия
+ алюминия
+ серы
- железа
- бария
3. Задание {{ 51 }} ТЗ № 51
Электронная формула 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 отражает строение атома
- кальция
+ алюминия
- магния
- бора
4. Задание {{ 52 }} ТЗ № 52
Одинаковое число протонов содержат ядра атомов
+ протия
+ трития
+ дейтерия
- гелия
5. Задание {{ 53 }} ТЗ № 53
Порядковый номер элемента Э55 в ядре которого 30 нейтронов
- 55
- 30
+ 25
- 85
6. Задание {{ 54 }} ТЗ № 54
Заполнение электронами р-подуровня происходит у атомов элементов
- натрия
- берилия
+ фосфора
+ углерода
+ хлора
- никеля
+ бора
7. Задание {{ 55 }} ТЗ № 55
На внешнем энергетическом уровне атома хлора имеется электронов
- 2
- 3
- 5
- 6
+ 7
- 8
- 17
8. Задание {{ 56 }} ТЗ № 56
Невозможные электронные конфигурации
- 1s2
+ 2d1
+ 3f3
- 4d3
+ 1p1
9. Задание {{ 57 }} ТЗ № 57
Число протонов в атоме элемента с электронным строением … 3 d 5 4 s 1 равно
- 6
- 8
+ 24
- 28
- 52
10. Задание {{ 58 }} ТЗ № 58
На внешнем p-подуровне атома фосфора число электронов равно
+ 3
- 5
- 15
- 30
- 31
11. Задание {{ 59 }} ТЗ № 59
На третьем энергетическом уровне в основном состоянии содержится 11 электронов в атоме элемента
- натрия
- кальция
+ ванадия
- меди
- железа
12. Задание {{ 60 }} ТЗ № 60
Одинаковое распределение электронов по энергетическим подуровням имеют символы частиц
+ S2-
+ Ar
- P+5
- Cl+7
13. Задание {{ 61 }} ТЗ № 61
Число электронов в ионе Cl +7 равно
- 7
+ 10
- 17
- 35
14. Задание {{ 62 }} ТЗ № 62
Число электронов в ионе Se 2- равно
- 2
- 12
- 34
+ 36
15. Задание {{ 63 }} ТЗ № 63
Наибольшее число вакантных орбиталей имеет атом элемента
- Al
+ Mg
- P
16. Задание {{ 64 }} ТЗ № 64
Число протонов в ионе Al +3 равно
- 10
+ 13
- 14
- 27
17. Задание {{ 26 }} ТЗ № 26
Порядковый номер химического элемента в ПСЭ определяет
- число нейтронов в атоме
- число энергетических уровней
+ число протонов в ядре атома
- массовое число атомов
18. Задание {{ 27 }} ТЗ № 27
Наиболее ярко выраженные металлические свойства имеет
- селен
- алюминий
+ кальций
- железо
19. Задание {{ 28 }} ТЗ № 28
Наиболее ярко выраженные неметаллические свойства имеет
- фосфор
- сера
- кислород
+ фтор
20. Задание {{ 29 }} ТЗ № 29
Химический элемент в ПСЭ под номером 106 по химическим свойствам сходен с элементом
- 105
+ 74
- 84
- 116
21. Задание {{ 30 }} ТЗ № 30
Амфотерными свойствами обладает
- оксид натрия
- оксид кальция
+ оксид цинка
- оксид хрома (II)
22. Задание {{ 31 }} ТЗ № 31
Амфотерными свойствами не обладает
- оксид алюминия
- оксид цинка
- гидроксид цинка
+ гидроксид кальция
23. Задание {{ 32 }} ТЗ № 32
В ПСЭ у химических элементов периодически изменяются
- ядра атомов
+ радиусы атомов
- атомные номера
- атомные массы
24. Задание {{ 33 }} ТЗ № 33
В главных подгруппах ПСЭ с увеличением атомного номера усиливается
- химическая активность
- электроотрицательность
+ металлические свойства
- неметаллические свойства
25. Задание {{ 34 }} ТЗ № 34
В периодах ПСЭ слева направо усиливаются
- металлические свойства
+ окислительные свойства
- металлический блеск
- относительная плотность
26. Задание {{ 35 }} ТЗ № 35
Степени окисления элементов главных подгрупп в высших оксидах
- возрастают сверху вниз
+ как правило, равны номеру группы
- всегда равны номеру группы
- уменьшаются сверху вниз
27. Задание {{ 36 }} ТЗ № 36
В пределах главных подгрупп ПСЭ у химических элементов одинаковы
- валентность
- химические свойства
+ строение внешнего энергетического уровня
- степень окисления в оксидах
28. Задание {{ 37 }} ТЗ № 37
Изотопы химического элемента отличаются между собой
- числом электронов
- числом протонов
+ числом нейтронов
- массовым числом
29. Задание {{ 38 }} ТЗ № 38
Электронную формулу … 3 d 6 4 s 2 имеет химический элемент
- селен
+ железо
- цинк
- кальций
30. Задание {{ 39 }} ТЗ № 39
13 протонов и 14 нейтронов содержит ядро атома химического элемента
- магния
+ алюминия
- кремния
- калия
31. Задание {{ 40 }} ТЗ № 40
Изотопами являются
- алмаз и графит
- кислород и озон
- 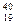 K и
K и 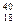 Ar
Ar
+ 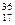 Cl и
Cl и 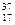 Cl
Cl
32. Задание {{ 41 }} ТЗ № 41
Зная массовое число А и порядковый номер элемента Z, число нейтронов в атоме химического элемента можно вычислить по формулам
+ A=Z+N
- N=Z-A
- N=Z+A
- N=A-Z
33. Задание {{ 42 }} ТЗ № 42
Зная номер уровня n, максимальное число электронов N на электронном уровне можно рассчитать по формуле
- N=2n
- N=2/n2
+ N=2n2
- N=n2
34. Задание {{ 43 }} ТЗ № 43
Два нейтрона содержат ядра атомов
- протия
+ трития
- дейтерия
- гелия
35. Задание {{ 44 }} ТЗ № 44
Число нейтронов в ядре атома дейтерия равно
- 0
+ 1
- 2
- 3
36. Задание {{ 45 }} ТЗ № 45
Число нейтронов в ядре атома трития равно
- 0
- 1
+ 2
- 3
37. Задание {{ 46 }} ТЗ № 46
Число нейтронов в ядре атома протия равно
+ 0
- 1
- 2
- 3
38. Задание {{ 47 }} ТЗ № 47
Число протонов в анионе SO 4 2- равно
- 8
- 32
R48
- 64
39. Задание {{ 48 }} ТЗ № 48
Число электронов в катионе Na + равно
- 9
+ 10
- 11
- 12
2 точка 2 семестр
d- элементы.
1. Задание {{ 251 }} ТЗ № 251
Не протекает реакция
 + ZnSO4 + Fe
+ ZnSO4 + Fe
 - CuSO4 + Fe
- CuSO4 + Fe
 - Cu(NO3)2 + Pb
- Cu(NO3)2 + Pb
 - Pb(NO3)2 + Zn
- Pb(NO3)2 + Zn
2. Задание {{ 252 }} ТЗ № 252
В концентрированной серной кислоте не растворяется
- Cu
- Ag
+ Au
- Hg
3. Задание {{ 253 }} ТЗ № 253
Из разбавленных кислот не вытесняют водород
- Mg
- Na
- Al
- Ca
+ Cu
+ Hg
4. Задание {{ 254 }} ТЗ № 254
В концентрированной азотной кислоте не растворяются
- Cu
- Ag
- Pb
+ Au
- Sn
+ Fe
5. Задание {{ 255 }} ТЗ № 255
Реакция не пойдет в случае
 - Cu + AgNO3
- Cu + AgNO3
 - Pb + Cu (NO3)2
- Pb + Cu (NO3)2
 - Cu + Hg (NO3)2
- Cu + Hg (NO3)2
 + Cu + Pb (NO3)2
+ Cu + Pb (NO3)2
6. Задание {{ 256 }} ТЗ № 256
Для растворения медно-серебряного сплава следует взять кислоту
- соляную
+ азотную
- серную разбавленную
- угольную
- сероводородную
7. Задание {{ 257 }} ТЗ № 257
При помещении пластинки в раствор сульфата меди появляется красный налет на
+ железной пластинке
- серебряной пластинке
- и на железной, и на серебряной
- ни на железной, ни на серебряной
8. Задание {{ 258 }} ТЗ № 258
При взаимодействии с хлором железо проявляет свойство
- окислительное
+ восстановительное
- кислотное
- основное
9. Задание {{ 259 }} ТЗ № 259
При длительном потреблении избыточных количеств молибдена может возникнуть заболевание
- лейкоз
+ эндемическая подагра
- сахарный диабет
- анемия
10. Задание {{ 260 }} ТЗ № 260
В состав гемоглобина входят ионы
- Fe3+
- Co3+
- Mg2+
+ Fe2+
11. Задание {{ 261 }} ТЗ № 261








