Понятие об эквиваленте. Объемные методы анализа.
Эквивалент простых и сложных веществ.
1. Задание {{ 96 }} ТЗ № 96
Эквивалент хлора равен 35,5.При образовании 14,83 г хлорида алюминия из 3г алюминия эквивалент алюминия равен
- 7
- 8
+ 9
- 10
2. Задание {{ 110 }} ТЗ № 110
Эквивалент кислоты, 3г которой содержит 0,05г водорода, способного замещаться на металл, равен
- 20
- 30
+ 60
- 120
3. Задание {{ 114 }} ТЗ № 114
Эквивалент соединения H 2 SO 4 равен
- 24,5
+ 49
- 98
- 196
4. Задание {{ 115 }} ТЗ № 115
Эквивалент Na 2 SO 4 равен
- 142
+ 71
- 47,3
- 35,5
5. Задание {{ 116 }} ТЗ № 116
Эквивалент Cu ( OH 2 ) равен
- 98
+ 49
- 32,6
- 16,8
6. Задание {{ 117 }} ТЗ № 117
Эквивалент H 2 CO 3 равен
- 62
+ 31
- 15,5
- 7,75
7. Задание {{ 118 }} ТЗ № 118
Эквивалент KOH равен
- 28
+ 56
- 112
- 120
8. Задание {{ 119 }} ТЗ № 119
Эквивалент Na 2 CO 3 равен
+ 53
- 106
- 26,5
- 212
9. Задание {{ 120 }} ТЗ № 120
Эквивалент железа в FeSO 4 равен
- 14
+ 28
- 30
- 34
10. Задание {{ 121 }} ТЗ № 121
Эквивалент Al 2 ( SO 4 )3 равен
+ 57
- 114
- 171
- 342
2 точка 1 семестр
Молекулярность и порядок реакций
1. Задание {{ 168 }} ТЗ № 168
К мономолекулярным реакциям относятся
+ Cl2 = 2Cl
+ CaCo3 = CaO+CO2
- H2 + Cl2 = 2HCl
- 2H2O2 = 2H2O + O2
2. Задание {{ 169 }} ТЗ № 169
К бимолекулярным реакциям относятся
- Cl2=2Cl
- CaCO3 = CaO + CO2
+ H2 + Cl2 = 2HCl
+ 2H2O2 = 2H2O + O2
3. Задание {{ 170 }} ТЗ № 170
Порядок реакции H2 + Cl2 = 2HCl равен
- 1
+ 2
- 3
- 4
4. Задание {{ 171 }} ТЗ № 171
Порядок реакции 2H2 O 2 = 2 H 2 O + O 2 равен
+ 1
- 2
- 3
- 4
5. Задание {{ 172 }} ТЗ № 172
Порядок реакции С O 2 + С = 2С O равен
+ 1
- 2
- 3
- 4
6. Задание {{ 173 }} ТЗ № 173
 Порядок реакции С12 H 22 O 11 + H 2 O C 6 H 12 O 6 + C 6 H 12 O 6 равен
Порядок реакции С12 H 22 O 11 + H 2 O C 6 H 12 O 6 + C 6 H 12 O 6 равен
+ 1
- 2
- 3
- 4
7. Задание {{ 174 }} ТЗ № 174
Молекулярность реакции CaCO3 = CaO + CO 2 равна
+ 1
- 2
- 3
- 4
8. Задание {{ 175 }} ТЗ № 175
Молекулярность реакции 2N2 O 5 = 4 NO 2 + O 2 равна
- 1
+ 2
- 3
- 4
9. Задание {{ 176 }} ТЗ № 176
Порядок реакции в многостадийных реакциях определяется
- самой быстрой стадией
+ самой медленной стадией
- любой стадией
- всеми стадиями
10. Задание {{ 177 }} ТЗ № 177
Самая медленная стадия многостадийной реакции определяет её
- молекулярность
+ порядок
- молекулярность и порядок
11. Задание {{ 178 }} ТЗ № 178
Порядок реакции может быть
+ нулевым
+ первым
+ дробным
+ вторым
+ третьим
- четвертым
12. Задание {{ 179 }} ТЗ № 179
Порядок реакции не может быть
+ отрицательным
- нулевым
- дробным
- первым
- вторым
13. Задание {{ 180 }} ТЗ № 180
В реакции 2H2 O 2 = 2 H 2 O + O 2 медленной стадией является
- O + O = O2
+ 2H2O = 2H2 + O2
- 2H2 + O2 = 2H2O
14. Задание {{ 181 }} ТЗ № 181
Лимитирующей стадией процесса является
- самая быстрая
+ самая медленная
- конечная
- первая
Зависимость скорости реакции от концентраций реагирующих веществ.
1. Задание {{ 464 }} ТЗ № 464
Отметьте правильный ответ
 Выражение закона действия масс для реакции 2NO(г) + Cl2(г) 2NOCl(г)
Выражение закона действия масс для реакции 2NO(г) + Cl2(г) 2NOCl(г)
- V=K[2NO][Cl2]
- V=K[NO]2
+ V=K[NO]2 [Cl2]
- V=K[NOCl]2
2. Задание {{ 465 }} ТЗ № 465
Отметьте правильный ответ
 Выражение закона действия масс для реакции CaCO3(к) CaO(к) + CO2(г)
Выражение закона действия масс для реакции CaCO3(к) CaO(к) + CO2(г)
- V=K[CaO][CO2]
+ V=K
- V=K[CaCO3]
- V=K[СО2]
3. Задание {{ 466 }} ТЗ № 466
Отметьте правильный ответ
Выражение V=K[O2] соответствует реакции
+ С + О2=СО2
- 2СО + О2=2СО2
- 2Н2 + О2=2Н2 О
- N2 + О2=2NО
4. Задание {{ 467 }} ТЗ № 467
Отметьте правильный ответ
Скорость реакции зависит от концентрации обоих взаимодействующих веществ в случае
- С + О2=СО2
+ 2СО + О2=2СО2
- СО2 +С =2СО
- S + О2=SО2
5. Задание {{ 468 }} ТЗ № 468
Отметьте правильный ответ
 Скорость реакции 2NO + O2 2NO2 при увеличении концентрации NO в 3 раза
Скорость реакции 2NO + O2 2NO2 при увеличении концентрации NO в 3 раза
- возрастает в 27 раз
- понижается в 9 раз
+ возрастает в 9 раз
- понижается в 27 раз
6. Задание {{ 469 }} ТЗ № 469
Отметьте правильный ответ
 Скорость реакции NO(г) + Cl2(г) 2NOCl(г) при увеличении давления в 4 раза
Скорость реакции NO(г) + Cl2(г) 2NOCl(г) при увеличении давления в 4 раза
- не изменяется
- увеличивается в 4 раза
- увеличивается в 8 раз
+ увеличивается в 16 раз
7. Задание {{ 470 }} ТЗ № 470
Отметьте правильный ответ
Скорость химической реакции А(ж) + 2В(т)=Д(ж) при уменьшении количества вещества В в 2 раза
- уменьшится в 2 раза
- увеличится в 2 раза
- уменьшится в 4 раза
+ не изменится существенно
8. Задание {{ 471 }} ТЗ № 471
Отметьте правильный ответ
Скорость реакции 2NO2=N2O4 при увеличении концентрации NO2 в 5 раз увеличится в
- 5 раз
- 10 раз
- 16 раз
- 20 раз
+ 25 раз
9. Задание {{ 472 }} ТЗ № 472
Отметьте правильный ответ
Период полураспада одного из изотопов радия составляет 26,8 мин. Константа распада (с-1) равна
- 1/26,8*60
- 0,69/26,8
+ 0,69/26,8*60
- 1/26,8
10. Задание {{ 473 }} ТЗ № 473
Отметьте правильный ответ
 Скорость реакции 2NO + O2 2NO2 при одновременном уменьшении концентрации NO и О2 в 2 раза
Скорость реакции 2NO + O2 2NO2 при одновременном уменьшении концентрации NO и О2 в 2 раза
- возрастает в 2 раза
- уменьшается в 2 раза
- возрастает в 8 раз
+ уменьшается в 8 раз
11. Задание {{ 474 }} ТЗ № 474
Отметьте правильный ответ
Скорость реакции СО(г) + 2Н2(г) = СН3ОН(г) при увеличении давления в 3 раза
- увеличивается в 3 раза
- увеличивается в 6 раз
+ увеличивается в 27 раз
- увеличивается в 8 раз
12. Задание {{ 475 }} ТЗ № 475
Отметьте правильный ответ
Период полураспада 4 дня. Константа скорости процесса (с-1) равна
- 0,69
- 4/0,69
- 4 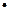 0,69
0,69
- 4 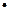 24
24 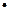 3600
3600
+ 0,69/4 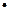 24
24 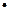 3600
3600
13. Задание {{ 476 }} ТЗ № 476
Отметьте правильный ответ
Период полураспада радия равен 4,989 дня. Константа скорости распада (с-1) равна
+ 0,69/4,989 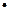 24
24 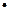 3600
3600
- 24 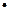 3600/4,989
3600/4,989
- 4,989/24  3600
3600
- 0,69/4,989  24
24
14. Задание {{ 477 }} ТЗ № 477
Отметьте правильный ответ
 Скорость химической реакции 2SO2(г) + O2(г) 2SO3(г) при увеличении концентрации SO2 в 3 раза
Скорость химической реакции 2SO2(г) + O2(г) 2SO3(г) при увеличении концентрации SO2 в 3 раза
- увеличится в 3 раза
- уменьшится в 3 раза
+ увеличится в 9 раз
- уменьшится в 9 раз
- не изменится
15. Задание {{ 478 }} ТЗ № 478
Отметьте правильный ответ
 Скорость реакции 2NO(г) + O2(г) 2NO2(г) при уменьшении объема реакционного сосуда в два раза
Скорость реакции 2NO(г) + O2(г) 2NO2(г) при уменьшении объема реакционного сосуда в два раза
- увеличивается в 2 раза
- уменьшается в 2 раза
+ увеличивается в 8 раз
- уменьшается в 8 раз
16. Задание {{ 479 }} ТЗ № 479
Отметьте правильный ответ
Скорость реакции за промежуток времени можно рассчитать по формуле
- V=K[A]
+ V= - 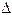 С/
С/ 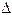 t
t
- V= 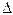 t/
t/ 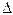 C
C
- V= - 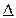 С
С 
 t
t
17. Задание {{ 480 }} ТЗ № 480
Отметьте правильный ответ
 Скорость реакции С+О2 СО2 можно рассчитать по формуле
Скорость реакции С+О2 СО2 можно рассчитать по формуле
- V=K[C][O2]
- V=K[CO2]
+ V=K[O2]
- V=K[C]
18. Задание {{ 481 }} ТЗ № 481
Отметьте правильный ответ
Скорость химической реакции выражается в
- л  моль-1
моль-1
- с  моль-1
моль-1
+ моль  л-1
л-1  с-1
с-1
+ мольл  л-1
л-1  мин-1
мин-1
19. Задание {{ 482 }} ТЗ № 482
Отметьте правильный ответ
Константа скорости реакции для реакций первого порядка рассчитывается по уравнениям
- 
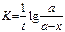
- 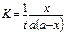
+ 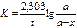
+ 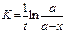
20. Задание {{ 483 }} ТЗ № 483
Отметьте правильный ответ
Константа скорости реакции для реакций второго порядка, когда концентрации реагирующих веществ равны между собой (а=в) рассчитываются по уравнениям
- 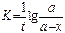
+ 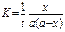
- 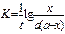
+ 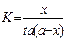
21. Задание {{ 484 }} ТЗ № 484
Отметьте правильный ответ
При увеличении давления в 4 раза скорость реакции А(г) + В(т)=АВ(т)
- уменьшится в 4 раза
- не изменится
- уменьшится в 16 раз
- возрастает в 16 раз
+ возрастает в 4 раза
22. Задание {{ 485 }} ТЗ № 485
Отметьте правильный ответ
Увеличение концентрации веществ А в 2 раза увеличит в 4 раза скорость реакции
 - 2А2(т) В(г)+С(г)
- 2А2(т) В(г)+С(г)
 + 2А2(г) В(г)
+ 2А2(г) В(г)
 - А2(г) + В2(г) 2АВ(г)
- А2(г) + В2(г) 2АВ(г)
 - 2А2(т) В(г)+С(г)
- 2А2(т) В(г)+С(г)
23. Задание {{ 486 }} ТЗ № 486
Отметьте правильный ответ
Среднее значение скорости (V) гомогенной реакции по изменению концентрации (С) или количества вещества ( 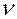 ) исходных веществ можно вычислить по уравнениям
) исходных веществ можно вычислить по уравнениям
- Vср.= + 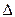 С/
С/ 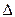 t
t
- Vср.= + 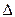
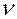 /(S
/(S 
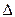 t)
t)
+ Vср.= - 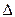
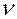 /
/ 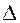 t
t
+ Vср.= - 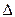 С/
С/ 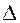 t
t
+ Vср.= - 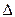
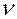 /V
/V 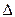 t
t
24. Задание {{ 487 }} ТЗ № 487
Отметьте правильный ответ
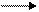 График зависимости скорости реакции А+В С от концентрации одного из исходных веществ имеет вид
График зависимости скорости реакции А+В С от концентрации одного из исходных веществ имеет вид
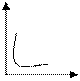 -
-
V
C
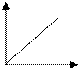 +
+
V
C
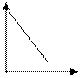 -
-
V
C
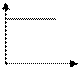 -
-
V
C
25. Задание {{ 488 }} ТЗ № 488
Отметьте правильный ответ
Для зависимости скорости прямой реакции от времени наиболее типичен график
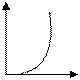 -
-
V
t
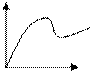 -
-
V
t
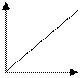 -
-
V
t
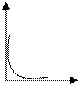 +
+
V
t








