Зависимость эквивалента вещества от реакции.
1 точка 1 семестр
Методы объемного анализа.
1. Задание {{ 402 }} ТЗ № 402
Для определения Fe2+ методом перманганатометрии используют индикатор
- FeSo4
+ KMnO4
- H2 SO4
- MnSO4
2. Задание {{ 403 }} ТЗ № 403
Для определения содержания K2CO3 в водном растворе можно использовать
- NaOH
+ HCl
- KMnO4
- KI
3. Задание {{ 404 }} ТЗ № 404
В перманганатометрии применяется индикатор
- фенолфталеин
- лакмус
+ KMnO4
- MnSO4
4. Задание {{ 405 }} ТЗ № 405
Фенолфталеин относится к индикаторам
+ кислотным
- основным
- амфотерным
5. Задание {{ 406 }} ТЗ № 406
Метиловый оранжевый относится к индикаторам
- кислотным
- основным
+ амфотерным
6. Задание {{ 407 }} ТЗ № 407
Лакмус относится к индикаторам
+ кислотным
- основным
- амфотерным
7. Задание {{ 408 }} ТЗ № 408
Лакмус в кислой среде
+ красный
- синий
- фиолетовый
- черный
8. Задание {{ 409 }} ТЗ № 409
Лакмус в щелочной среде
- красный
+ синий
- фиолетовый
- черный
9. Задание {{ 410 }} ТЗ № 410
Метиловый красный в щелочной среде
- красный
+ желтый
- оранжевый
- синий
10. Задание {{ 411 }} ТЗ № 411
Метиловый оранжевый в кислой среде
+ красный
- желтый
- оранжевый
- синий
11. Задание {{ 412 }} ТЗ № 412
В щелочной среде метиловый оранжевый приобретает цвет
- красный
+ желтый
- оранжевый
- синий
12. Задание {{ 413 }} ТЗ № 413
Окраска фенолфталеина в щелочной среде
- синяя
- бесцветная
+ красная
- голубая
Зависимость эквивалента вещества от реакции.
1. Задание {{ 65 }} ТЗ № 65
Эквивалент KMnO 4 при восстановлении его до MnSO 4 равен
- 158
- 52.7
- 79
+ 31,6
2. Задание {{ 66 }} ТЗ № 66
Эквивалент KMnO 4 при восстановлении его до MnO 2 равен
- 158
+ 52.7
- 79
- 31,6
3. Задание {{ 67 }} ТЗ № 67
Эквивалент KMnO 4 при восстановлении его до K 2 MnO 4 равен
+ 158
- 52.7
- 79
- 31,6
4. Задание {{ 68 }} ТЗ № 68
Эквивалент перманганата калия в окислительно-восстановительной реакции в кислой среде равен
- 52,7
- 79
- 158
+ 31,6
5. Задание {{ 69 }} ТЗ № 69
Эквивалент перманганата калия в окислительно-восстановительной реакции в щелочной среде равен
- 52,7
- 79
+ 158
- 31,6
6. Задание {{ 70 }} ТЗ № 70
Эквивалент перманганата калия в окислительно-восстановительной реакции в нейтральной среде равен.
+ 52,7
- 79
- 158
- 31,6
7. Задание {{ 97 }} ТЗ № 97
 Эквивалент Zn(OH)2 в реакции Zn(OH)2 + 2HCl ZnCl2 + 2H2O равен
Эквивалент Zn(OH)2 в реакции Zn(OH)2 + 2HCl ZnCl2 + 2H2O равен
- 99
+ 49,5
- 33
- 24,75
8. Задание {{ 98 }} ТЗ № 98
 Эквивалент Zn ( OH )2 в реакции Zn ( OH )2 + HCl ZnOHCl + H 2 O равен
Эквивалент Zn ( OH )2 в реакции Zn ( OH )2 + HCl ZnOHCl + H 2 O равен
+ 99
- 49,5
- 33
- 24,75
9. Задание {{ 103 }} ТЗ № 103
 Эквивалент KMnO 4 в реакции KNO 2 + KMnO 4 + H 2 SO 4 равен
Эквивалент KMnO 4 в реакции KNO 2 + KMnO 4 + H 2 SO 4 равен
- 158
- 79
- 52,7
+ 31,6
10. Задание {{ 104 }} ТЗ № 104
 Эквивалент KMnO 4 в реакции KNO 2 + KMnO 4 + H 2 O равен
Эквивалент KMnO 4 в реакции KNO 2 + KMnO 4 + H 2 O равен
- 158
- 79
+ 52.7
- 31.6
11. Задание {{ 105 }} ТЗ № 105
 Эквивалент KMnO 4 в реакции KNO 2 + KMnO 4 + KOH равен
Эквивалент KMnO 4 в реакции KNO 2 + KMnO 4 + KOH равен
+ 158
- 79
- 52.7
- 31.6
12. Задание {{ 106 }} ТЗ № 106
 Эквивалент KMnO 4 в реакции Na 2 SO 3 + KMnO 4 + H 2 SO 4 равен
Эквивалент KMnO 4 в реакции Na 2 SO 3 + KMnO 4 + H 2 SO 4 равен
- 158
- 79
- 52.7
+ 31.6
13. Задание {{ 107 }} ТЗ № 107
 Эквивалент KMnO 4 в реакции Na 2 SO 3 + KMnO 4 + H 2 O равен
Эквивалент KMnO 4 в реакции Na 2 SO 3 + KMnO 4 + H 2 O равен
- 158
- 79
+ 52.7
- 31.6
14. Задание {{ 108 }} ТЗ № 108
 Эквивалент KMnO 4 в реакции Na 2 SO 3 + KMnO 4 + KOH равен
Эквивалент KMnO 4 в реакции Na 2 SO 3 + KMnO 4 + KOH равен
+ 158
- 79
- 52.7
- 31.6
15. Задание {{ 109 }} ТЗ № 109
 Эквивалент MnO 2 в реакции MnO 2 + 4 HCl MnCl 2 + Cl 2 + 2 H 2 O равен
Эквивалент MnO 2 в реакции MnO 2 + 4 HCl MnCl 2 + Cl 2 + 2 H 2 O равен
- 29
+ 43.5
- 87
- 174
16. Задание {{ 111 }} ТЗ № 111
 Эквивалент H 3 PO 4 в реакции H 3 PO 4 + NaOH NaH 2 PO 4 +2 H 2 O равен
Эквивалент H 3 PO 4 в реакции H 3 PO 4 + NaOH NaH 2 PO 4 +2 H 2 O равен
- 24,5
- 32,6
- 49
+ 98
17. Задание {{ 112 }} ТЗ № 112
 Эквивалент H3PO4 в реакции H3PO4 +2 NaOH Na2 HPO4+2H2O равен
Эквивалент H3PO4 в реакции H3PO4 +2 NaOH Na2 HPO4+2H2O равен
- 24,5
- 32,6
+ 49
- 98
18. Задание {{ 113 }} ТЗ № 113
 Эквивалент H3PO4 в реакции H3PO4 + 3NaOH Na3PO4+3H2O равен
Эквивалент H3PO4 в реакции H3PO4 + 3NaOH Na3PO4+3H2O равен
- 24,5
+ 32,6
- 49
- 98
19. Задание {{ 122 }} ТЗ № 122
 Эквивалент окислителя в реакции FeCl 2 + H 2 Cr 2 O 7 равен
Эквивалент окислителя в реакции FeCl 2 + H 2 Cr 2 O 7 равен
- 72,7
- 109
- 218
+ 36,3
20. Задание {{ 123 }} ТЗ № 123
 Эквивалент окислителя в реакции I 2 + Na 2 S 2 O 3 равен
Эквивалент окислителя в реакции I 2 + Na 2 S 2 O 3 равен
- 79
- 254
+ 127
- 158
21. Задание {{ 124 }} ТЗ № 124
 Эквивалент окислителя в реакции H 2 O 2 + KMnO 4 + H 2 SO 4 равен
Эквивалент окислителя в реакции H 2 O 2 + KMnO 4 + H 2 SO 4 равен
+ 31,6
- 52,7
- 79
- 158
Понятие об эквиваленте. Объемные методы анализа.
Методы расчета в объемном методе анализа.
1. Задание {{ 71 }} ТЗ № 71
В методах объемного анализа титр раствора рассчитывается по формуле
- T= 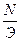
+ T= 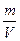
- T=NЭ
- T=mV
2. Задание {{ 72 }} ТЗ № 72
Зная титр раствора нормальную концентрацию раствора можно определить по формуле
- T= 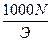
+ N= 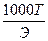
- N= 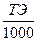
- N= 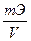
3. Задание {{ 125 }} ТЗ № 125
Для приготовления 1л 0,1н раствора KMnO 4 для титрования в кислой среде надо взять навеску соли массой (г)
+ 3,16
- 31,6
- 15,8
- 5,27
4. Задание {{ 126 }} ТЗ № 126
Для приготовления 0,5л 0,01н раствора KMnO 4 для перманганатометрии надо взять навеску соли массой (г)
- 0,316
+ 0,158
- 3,16
- 15,8
5. Задание {{ 127 }} ТЗ № 127
Для приготовления 0,5л 0,01н раствора NaOH надо взять навеску массой (г)
- 0,1
+ 0,2
- 0,3
- 0,4
6. Задание {{ 596 }} ТЗ № 596
Если для одного раствора известна нормальная концентрация N1 и объем V1, а для другого только объем V2, то можно определить нормальную концентрацию N2 последнего раствора по формулам:
- 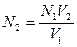
- 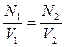
+ 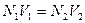
+ 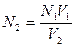
7. Задание {{ 597 }} ТЗ № 597
Титр 0,1 н HCl равен
- 0,1
- 0,0365
+ 0,00365
- 36,5
8. Задание {{ 598 }} ТЗ № 598
На титрование 20мл раствора HCl израсходовано 19,2 мл 0,1 н NaOH. Нормальная концентрация раствора HCl
- 0,1
+ 0,096
- 0,048
- 0,024
9. Задание {{ 599 }} ТЗ № 599
Нормальная концентрация раствора H2SO4 с титром 0,0196 г/мл равняется
- 2
- 1
- 0,5
+ 0,4
- 0,3
10. Задание {{ 600 }} ТЗ № 600
На титрование 12 мл раствора, содержащего 7,45 г/л KCl потребуется 0,1 н AgNO3 в объеме (мл)
- 6
+ 12
- 24
- 48
11. Задание {{ 601 }} ТЗ № 601
На титрование 25 мл раствора KCl израсходовано 34 мл 0,1 н раствора AgNO3. Масса KCl в 250 мл такого раствора (г)
- 5,066
+ 2,533
- 7,599
- 10,3








