Опыт_2 Получение гидроксидов основного характера и растворение их в кислоте
Нижегородский Государственный Технический Университет им Р.Е.Алексеева
Кафедра: Производственная безопасность, экология и химия
Отчёт
по химии
по лабораторной работе №2
Выполнил:
студент гр. С15-ЛА-1
Муравьев В.В.
Проверил:
Преподаватель
Борисова Г.Н.
г. Нижний Новгород 2016
Опыт_1 Знакомство с индикаторами.
Цель работы: исследовать влияние индикаторов на различные растворы .
Приборы и реактивы:
1) пробирки
2) раствор HCl (pH=1)
3) раствор дистиллированной воды (рН = 7)
4) раствор NaOH (pH=13)
Химические реакции:
HCL → H+ + Cl- 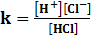
H2O → H++ OH- 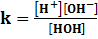
NaOH → Na+ + OH- 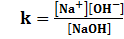
Проведение опыта:
В три пробирки налили по 2 мл следующих растворов: в первую - 0,1 М HCl (pH=1), во вторую - дистиллированной воды (рН = 7), в третью - 0,1 М раствор NaOH (pH=13). В каждую из пробирок добавили по 1 капле индикатора. Изменение цвета индикатора были записаны в таблицу. Повторили опыты с другими индикаторами.
Наблюдение: спустя небольшой промежуток времени в пробирке меняется цвет индикатора .
Таблица к Опыту_1:
| Индикатор | Среда | ||
| кислая рН=1 | нейтральная рН=7 | щелочная рН=13 | |
| Метилоранж | Красный | Оранжевый | Жёлтый |
| Лакмус | Бардовый | Фиолетовый | Синий |
| Фенолфталеин | бесцветный | Бесцветный | Малиновый |
Опыт_2 Получение гидроксидов основного характера и растворение их в кислоте
Цель работы:
Исследование получения гидроксидов основного характера и их растворение в кислоте.
Приборы и реактивы:
1) Пробирки
2) растворы солей (MgCl2, MnCl2, NiCl2 .)
3) раствор NaOH
4) раствор HCl
5) Проведение опыта
Проведение опыта:
В три пробирки наливаем по 2-3 мл 0,5М растворов солей. Добавляем в них по такому же количеству 1 М раствора NaOH. Наблюдаем выпадение осадков, отмечаем изменение их цвета. К осадкам подливаем 2 М раствора HCl до полного их растворения.
Химические реакции:
1.MgCl2+2NaOH → Mg(OH)2↓+2NaCl – белый осадок
Mg2++2Cl-+2Na++2OH-→ Mg(OH)2↓+2Cl-+2Na+
Mg++2OH-→ Mg(OH)2↓
Mg(OH)2↓+2HCl→MgCl2+2H2O – осадок растворился
2.MnCl2+2NaOH → Mn(OH)2↓+2NaCl –желтый осадок
Mn2++2Cl-+2Na++2OH- → Mn(OH)2↓+2Na++2Cl-
Mn2++2OH- → Mn(OH)2↓
Mn(OH)2↓+2HCl→MnCl2+2H2O – осадок растворился
3.NiCl2+2NaOH → Ni(OH)2↓+2NaCl – зеленый осадок
Ni2++2Cl-+2Na++2OH- → Ni(OH)2↓+2Na++2Cl-
Ni2++2OH- → Ni(OH)2↓
Ni(OH)2↓+2HCl→NiCl2+2H2O – осадок растворился
1. 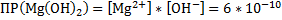
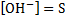 →
→ 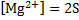
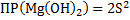
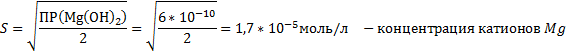
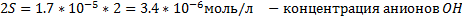
2. 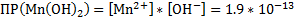
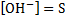 →
→ 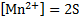
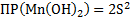
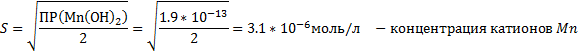
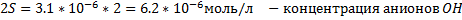
3. 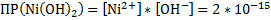
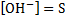 →
→ 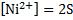
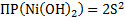
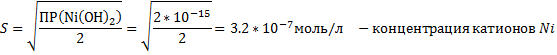
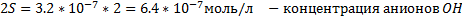
Опыт_3 Получение сульфатов.
Цель работы: исследовать получение сульфатов
Приборы и реактивы:
1) Пробирки
2) BaCl2
3) SrCl2
4) Pb(NO3)2
5) H2SO4
Проведение опыта:
В две пробирки наливаем 2-3 мл растворов солей и по каплям добавляем раствор H2SO4 до выпадения осадков.
Химические реакции:
BaCl2+ H2SO4 → BaSO4↓+2HCl – осадок белого цвета
Ba2++2Cl-+ 2H++SO42- → BaSO4↓+2H++2Cl-
Ba2++SO42- → BaSO4↓
SrCl2+ H2SO4 → SrSO4↓+2HCl – осадок белого цвета (высокая плотность)
Sr2++2Cl-+ 2H++SO42- → SrSO4↓+2H++2Cl-
Sr2++SO42- → SrSO4↓
1. 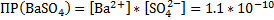
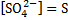 →
→ 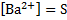
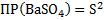
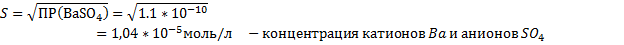
2. 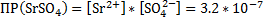
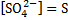 →
→ 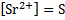
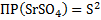
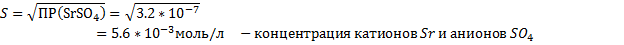
Опыт_5 Смещение равновесия при образовании менее растворимого вещества.
Цель работы: исследовать смещение равновесия при образовании менее растворимого вещества.
Приборы и реактивы:
1) пробирки
2) раствор нитрата свинца Pb(NO3)2
3) раствор сульфата натрия Na2SO4
4) раствор Na2S
Проведение опыта:
В пробирке получаем осадок сульфата свинца PbSO4. Для этого берём 2 мл 0,5М раствора нитрата свинца Pb(NO3)2 и добавляем столько же раствора сульфата натрия Na2SO4. Отмечаем цвет осадка. К образовавшемуся осадку добавляем несколько капель раствора Na2S. Отмечаем изменение цвета осадка.
Химические реакции:
Na2 SO4+ Pb(NO3)2 → PbSO4↓+2NaNO3 – осадок белого цвета
Pb2++2NO3- +2Na++SO42- → PbSO4↓+2Na++2NO3-
Pb2+ +SO42- → PbSO4↓
PbSO4+Na2S → PbS↓+ Na2SO4 – осадок черного цвета
ПР(PbSO4)= 1.6·10-8
ПР(PbS)= 2.5·10-27
Вывод:
Равновесие сместилось в сторону образования менее растворимой соли свинца т.к. произведение молярных концентраций ионов, возведенных в степень стехиометрических коэффициентов (ПК), больше величины произведения растворимости (ПР) этой соли.
Опыт_6 Выделение углекислого газа.
Цель работы: исследовать смещение равновесия при образовании менее растворимого вещества.
Приборы и реактивы:
1) пробирки
2) Na2CO3
3) CaCl2
4) HCl
5) NaCO3
6) CaCO3
Проведение опыта:
Наливаем в две пробирки по 2 мл 1М раствора Na2CO3. Проверяем наличие в растворе иона CO32-. Для этого в одну пробирку добавляем несколько капель концентрированного раствора CaCl2.
Добавляем во вторую пробирку несколько капель соляной кислоты, разбавленной водой в соотношении 1:1, и наблюдаем выделение газа. Пробирку слегка нагреваем и дождаемся окончания выделения газа, затем добавляем несколько капель CaCl2.
Химические реакции:
Na2CO3+ CaCl2 → CaCO3+2NaCl – осадок белого цвета
2Na++CO32- +Ca++Cl2- → CaCO3↓+2Na++2Cl-
Ca++CO32-→ CaCO3↓
Na2CO3+HCl →2 NaCl+H2O+ CO2 ↑– выделяется газ
2H+ +CO32- →H2O+ CO2 ↑
NaCl+ CaCl2→ NaCl+ CaCl2
Опыт_10 Реакция нейтрализации.
Цель работы: исследовать различные варианты нейтрализации кислот .
Приборы и реактивы:
1) пробирки
2) раствор NaOH
3) фенолфталеин (C20H14O4)
4) соляная кислота (HCl)
5) уксусная кислота (CH3COOH )
Проведение опыта:
Наливаем в две пробирки по 2-3 мл 0,5 М раствора NaOH и добавляем по одной капле фенолфталеина.
В одну пробирку добавляем по каплям 0,5М раствор соляной или серной кислоты, во вторую – 0,5 М раствор уксусной кислоты до обесцвечивания раствора.
Химические реакции:
NaOH + фенолфталеин → фиолетовый цвет
NaOH + HCl → H2O+NaCl– обесцвечивается
Na++OH- + H++Cl- → H2O+Na++Cl-
OH- + H+ → H2O
NaOH + фенолфталеин → фиолетовый цвет
NaOH+ CH3COOH → CH3COОNa+ H2O → обесцвечивается
OH-+H+ → H2O
Кд(CH3COOH)=1,74*10-5
Кд(H2O)=1,8*10-16








