Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
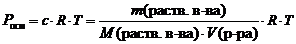 ,
,
где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;
R – универсальная газовая постоянная, 8,314 Дж/(мольК);
Т – абсолютная температура, К;
V(р-ра) – объем раствора, л.
Зависимость скорости реакции оттемпературу выражается правилом Вант-Гоффа: При увеличении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза
Разбавленные растворы неэлектролитов обладают. [1]
Разбавленные растворы неэлектролитов обладают рядом свойств ( коллигативные свойства), количественное выражение которых зависит только от числа находящихся в растворе частиц растворенного вещества и от количества растворителя. Некоторые коллигативные свойства растворов используются для определения молекулярной массы растворенного вещества. [2]
Свойства разбавленных растворов неэлектролитов, относящихся к нелетучим веществам, описываются следующими законами. [3]
Для разбавленного раствора неэлектролита, согласно ( 103) ( гл. [4]
Поведение разбавленных растворов неэлектролитов как идеальных разбавленных растворов обусловливает их так называемые общие свойства растворов, которые не зависят от природы растворенного вещества, а только от его долевой мольной концентрации. [5]
Для разбавленных растворов неэлектролитов все эти величины находятся в простой пропорциональной зависимости от числа молекул растворенного вещества. [6]
В разбавленном растворе неэлектролита число частиц совпадает с числом молекул, в то время как в разбавленном растворе электролита число частиц увеличивается в результате диссоциации и во столько же раз возрастает депрессия. [7]
В умеренно разбавленных растворах неэлектролитов коэффициент активности заметно отличается от единицы. [8]
В разбавленных растворах неэлектролитов молекулы растворенного вещества практически не взаимодействуют друг с другом из-за большого расстояния между ними. Поведение этих молекул в растворе аналогично поведению молекул идеального газа. Если, например, налить в стакан концентрированный раствор сахарозы, а сверху слой чистой воды, то через некоторое время концентрация молекул сахарозы станет одинаковой во всем объеме раствора. Такое взаимное проникновение молекул называется диффузией. В данном случае имеет место встречная, или двусторонняя, диффузия молекул сахарозы в воду и молекул воды в сахарозу. [9]
В разбавленных растворах неэлектролитов молекулы растворенного вещества практически не взаимодействуют друг с другом из-за большого расстояния между ними. Поведение этих молекул в растворе аналогично поведению молекул идеального газа. Действительно, если, например, налить в стакан концентрированный раствор сахарозы, а сверху слой чистой воды, то через некоторое время концентрация молекул сахарозы станет одинаковой во всем объеме раствора. Такое взаимное проникновение молекул называется диффузией. В данном случае имеет место встречная или двусторонняя диффузия молекул сахарозы в воду и молекул воды в сахарозу. [10]
Исследование свойств разбавленных растворов неэлектролитов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном объеме данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля. [11]
Некоторые свойства разбавленных растворов неэлектролитов могут быть описаны количественно и выражены в виде законов. [12]
Исследование свойств разбавленных растворов неэлектролитов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном количестве данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля.
2. Химические электроды. Электродные потенциалы. Ряд стандартных электродных потенциалов, его особенности. Формула Нернста.
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие фазы, контактирующие с ионным проводником (электролитом). Часто под электродом понимают лишь одну электронно-проводящую фазу. При пропускании тока от внеш. источника через систему из двух электродов, соединенных друг с другом через электролит, на электродах протекают два процесса: заряжение двойного электрического слоя и электрохим. р-ция. В отличие от фазовых контактов металл-металл, металл-полупроводник, полупроводник-полупроводник и т. п. на фанице фаз, составляющих электрохим. систему, вид носителей тока меняется, т. к. в электролите ток переносится ионами, а в электронно-проводящей фазе - электронами. Непрерывность прохождения тока через фаницу фаз в этом случае обеспечивается электродной р-цией. Электрод наз. анодом, если на его пов-сти преобладает р-ция, приводящая к генерированию электронов, т. е. происходит окисление в-в, содержащихся в электролите, либо ионизация металла анода. Электрод наз. катодом, если с его пов-сти электроны металла переходят на частицы реагирующих в-в, к-рые при этом восстанавливаются.
Электро́дныйпотенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и растворомэлектролита)








