Виды радиоактивного распада
Альфа - распад
Альфа-частицы испускаются только тяжелыми ядрами, т.е. содержащими большое число протонов и нейтронов. Прочность тяжелых ядер мала. Для того, чтобы покинуть ядро, нуклон должен преодолеть ядерные силы, а для этого он должен обладать достаточной энергией.
При объединении двух протонов и двух нейтронов в альфа-частицу ядерные силы в подобном сочетании (между нуклонами частицы) являются наиболее крепкими, а связи с другими нуклонами слабее, поэтому альфа-частица способна "выйти" из ядра. Вылетевшая альфа-частица уносит положительный заряд в 2 единицы и массу в 4 единицы.
В результате альфа-распада радиоактивный элемент превращается в другой элемент, порядковый номер которого на 2 единицы, а массовое число на 4 единицы, меньше.
То ядро, которое распадается, называют материнским, а образовавшееся дочерним.
Дочернее ядро оказывается обычно тоже радиоактивным и через некоторое время распадается.
Процесс радиоактивного распада происходит до тех пор, пока не появится стабильное ядро, чаще всего ядро свинца или висмута.
Бета-распад
Явление бета-распада состоит в том, что ядра некоторых элементов самопроизвольно испускают электроны и элементарную частицу очень малой массы - антинейтрино.
Так как электронов в ядрах нет, то появление бета-лучей из ядра атома можно объяснить способностью нейтронов ядра распадаться на протон, электрон и антинейтрино. Появившийся протон переходит во вновь образующееся ядро. Электрон, вылетающий из ядра, и является частицей бета-излучения.
Такой процесс распада нейтронов характерен для ядер с большим количеством нейтронов.
В результате бета-распада образуется новое ядро с таким же массовым числом, но с большим на единицу зарядом.
Гамма - распад - не существует
Испускание позитрона
Позитронный распад обычно происходит только в ядрах, которые имеют избыток протонов. Когда радионуклид подвергается позитронному распаду, его атомный номер уменьшается на единицу (так как на один протон в ядре стало меньше), но атомная массы остается той же самой (замена протона на нейтрон). Позитронный распад (обозначенный символом b+) сдвигает радионуклид по диагонали вниз на одну ячейку направо на диаграмме нуклидов. Это – противоположно сдвигу, который происходит при бета-распаде.
Испускание нейтрона
Пери о д полурасп а да - промежуток времени, в течение которого количество радиоактивных ядер в среднем уменьшается вдвое.
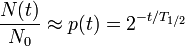
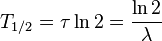
Правило смещения Содди и Фаянса
Закон описывает, какой элемент и какой изотоп этого элемента получается при том или ином типе радиоактивного распада:
· при альфа-распаде создаётся элемент с зарядом ядра, уменьшенным на два, и с атомной массой, уменьшенной на четыре по отношению к родительскому радиоизотопу, например: 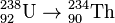 ;
;
· при бета-распаде заряд ядра атома созданного элемента возрастает на единицу при неизменной атомной массе, например: 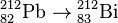 . Это справедливо для β--распада, называемого также электронной эмиссией. Это единственная форма бета-распада, которую могли наблюдать и регистрировать Содди и Фаянс в 1913 году. Позже, в 1930-х годах, была открыта другая форма бета-распада — β+-распад, который можно назвать позитронной эмиссией. Кроме того, было открыто явление захвата электронов, при котором атомная масса изотопа остаётся неизменной, как и при β--распаде, но заряд ядра уменьшается на единицу, например:
. Это справедливо для β--распада, называемого также электронной эмиссией. Это единственная форма бета-распада, которую могли наблюдать и регистрировать Содди и Фаянс в 1913 году. Позже, в 1930-х годах, была открыта другая форма бета-распада — β+-распад, который можно назвать позитронной эмиссией. Кроме того, было открыто явление захвата электронов, при котором атомная масса изотопа остаётся неизменной, как и при β--распаде, но заряд ядра уменьшается на единицу, например: 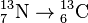 .
.
13)Желе́зо-ни́келевыйаккумуля́тор — это вторичный химический источник тока, в котором железо — анод, электролитом является водный раствор гидроксида натрия или калия (с добавками гидроксида лития), катод — гидрат окиси никеля(III).
Железо-никелевый аккумулятор представляет собой железный сосуд ( бак), внутри которого размещены положительные и отрицательные пластины, выполненные в виде коробок из плоских перфорированных лент, заполненных активной массой.
Активный материал содержится в никелированных стальных трубках или перфорированных карманах. С точки зрения стоимости и удельной энергоемкости, они близки к литий-ионным аккумуляторам, а с точки зрения саморазряда, эффективности и напряжения — к NiMH аккумуляторам. Это достаточно выносливые аккумуляторы, стойкие к грубому обращению (перезаряд, глубокий разряд, короткое замыкание и термические удары) и имеющие очень длинный срок службы. Используются для резервного электропитания там, где могут быть постоянно заряжаемыми. Срок службы в таком случае может быть более 20 лет.
Свинцовые аккумуляторы
Кислотные свинцовые аккумуляторы являются наиболее распространеннымисреди вторичных химических источников тока. Обладая сравнительно высокоймощностью в сочетании с надежностью и относительно низкой стоимостью.Эти аккумуляторы находят разнообразное практическое применение. Своейпопулярностью и широкиммаштабом производства они обязаны стартернымбатареям, предназначенным для различных средств передвижения и прежде всегоавтомобилей. В этой области их монопольное положение устойчиво исохраняется долгое время. На базе свинцовых аккумуляторов комплектуетсяподавляющее большинство стационарных и значительная часть вагонныхбатарей. Успешно конкурируют с щелочными тяговые свинцовые аккумуляторы.14.CaH2+2H2O->Ca(OH)2+H2стрелочка вверх, и над H2в правой частипоставить х
1)амега=200*(100-12)/100=176кг
nСaH2=176/42=4,2кмоль (M=42-маляр.масса)
2)По ур-ю р-ции кол-во СаН2относится как 1:1, следовательно кол-во Н=4,2кмоль
V=nH2*22,4=4,2*22,4=94,08 м3.
Ответ: 94,08м3.
Билет 19
52) ИСКУССТВЕННАЯ Радиактивность - радиоактивность, наблюдаемая у нуклидов, образующихся в результате ядерных реакций. Открыта И. и Ф. Жолио-Кюри в 1934.
Термоядерная реа́кция — разновидность ядерной реакции, при которой лёгкие атомные ядра объединяются в более тяжёлые, за счёт кинетической энергии их теплового движения.
53) Гальвани́ческийэлеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов вэлектролите, приводящем к возникновению в замкнутой цепи электрического тока
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов
В настоящее время применяют исключительно химическую деполяризацию. Ее сущность заключается в том, что в элемент вводят какой-либо сильный окислитель, который вступает в химическую реакцию с водородом, выделяющимся у положительного электрода, и этим предотвращает его выделение в газообразном состоянии.








