Зависимость скорости реакций от различных факторов
Билет1.
1)Материя-полная совокупность физ.регестрируемых частиц. Понятие материя расширялось. С Открытием магнитного поля материя состоит из 2 элементов: вещество и поле(магн. или эл).Вещество –конкретный вид материи ,которое обладает конечной массой покоя. Предметом химии конкретные хим.элементы и их соединения ,а также закономерности,которым подчиняются хим.явления.Одним из основных объектов химии являются вещества, из которых состоят все окружающие нас тела. Телом называется все то, что имеет массу и объем.
Явления, при которых из одних веществ образуются новые вещества, называются химическими. Изучением таких явлений и занимается химия. Химия - это наука о превращениях веществ. Химия изучает состав и строение веществ, условия и пути превращения одних веществ в другие, зависимость свойств веществ от их состава и строения.
• Химия – наука о веществах и законах, по которым происходят превращения одних веществ в другие.
• Вещество и поле - две формы существования материи.
• Вещество – форма материи, которая обладает собственной массой, т.е. массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др.
• Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы.
• Поле – форма существования материи, которая тесно связана с энергией.
• Посредством поля осуществляется взаимодействие между частицами вещества. Неотъемлемым свойством материи является движение.
2)Химия-наука о в-вах и их свойствах,ихстроении,превращениях в результате хим.реакции и явлениях.Экология-наука о взаимодействии организмов между собой и с окр.средой.Велика роль химии в формировании фундаментальных знаний о природе,развития методов исследования .Химия указывает пути получения новых экологически безопасных веществ и материалов.Химическое загрязнение окружающей среды обусловлено следующими факторами:
1) повышением концентрации биогенных элементов из-за канализационных сбросов и стока с полей удобрении, вызывающих бурное развитие водорослей и нарушение баланса в существующих экосистемах;
2) отравлением воды, почвы и воздуха отходами химических производств;
3) воздействием на воду и почву продуктов сжигания топлива, снижающих качество воздуха и вызывающих кислотные дожди;
4) потенциальным заражением воздуха, воды и почвы радиоактивными отходами, образующимися при производстве ядерного оружия и атомной энергии;
5( выбросами углекислого газя и химических веществ, снижающих содержание озона, что может привести к изменению климата или образованию озоновых дыр.
3) Германий(Ge) -химический элемент,полуметалл,в химический соединениях обычно проявляет валентность 2 и 4,более стабильные соедин.с 4-валентным Ge.Устойчив к действию воздуха,воду, к растворам щелочи и разбавленной соляной и серной кислот.Растворяется в царской водке и в щелочном растворе перекиси водорода.Медленно окисляется в азотной кислоте.Образует соединения со многими металлами.В присутствии сильных комплексообразователей или окислителей, при нагревании Ge реагирует с кислотами:
Ge + H2SO4 конц = Ge(SO4)2 + 2SO2 + 4H2O
Ge + 4HNO3 + 12HCl = GeCl4 + 4NO + 8H2O
С галог:Ge + 2I2 = GeI4
Билет 2.
4)Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Исключительное значение для развития химии имело установление трех основных стехиометрических законов.
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение, независимо от способа его получения, состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон сохранения массы вещества-масса всех веществ,вступивших в реакцию ,равна массе всех продуктов реакции.
Закон Авога́дро —в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём V =22.3 г,моль. Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Джон Дальтон в 1803 году сформулировал закон кратных отношений:
если два элемента образуют между собой несколько соединений, то на одно и то же весовое количество одного элемента приходятся такие весовые количества другого элемента, которые относятся между собой как небольшие целые числа.
5))Полиме́ры — неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере должно быть достаточно велико. В химии олигомер -молекула в виде цепочки из небольшого числа одинаковых составных звеньев. Синтез полимера-поликонденсация. Поликонденсация — процесс синтеза полимеров из полифункциональных соединений, обычно сопровождающийся выделением низкомолекулярных побочных продуктов (воды,спиртов и т.п.)при взаимодействии функциональных групп. Линейная и Трехмерная.
Полимеризация – реакция образования полимеров путем последовательного присоединения молекул низкомолекулярного вещества (мономера). Побочных продуктов не образуется. В качестве мономеров используются соединения с кратными связями
6)
Билет3.
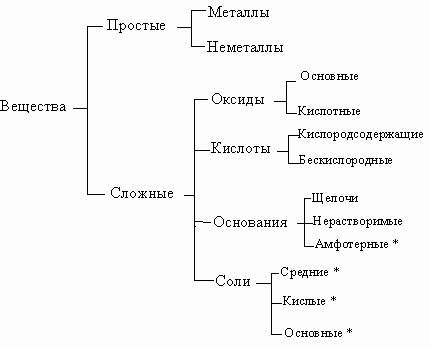
Окси́д — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менееэлектроотрицательным элементом.
Основания – хим. соединения, которые в растворе диссоциируют на катионы металла и ионы гидроксильных групп OH.
Кислоты – хим. соединения, которые в растворах диссоциируют на ионы водорода и ионы кислотного остатка.
Соли – продукты замещения атомов водорода в кислоте на металл или гидроксид анионов в основаниях на кислотный остаток.
Основой Номенклатурынеорг. соединений служат названия химических элементов. Как правило, название соединения состоит из двух слов. Одно из них означает принадлежность данного соединения к определённому роду (или классу), другое — к определённому виду.апример, в названии "серная кислота" существительное показывает, что данное вещество относится к кислотам, а прилагательное поясняет, что это кислота, образованная серой.
8)Медь- это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Широко применяется человеком.
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI ). Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета.
Электронное строение атома меди 1s22s22p63s23p63d104s1
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O (темнокрасный кристаллический порошок, применяемый для изготовления рубинового стекла) красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета)
Хлорид меди(I) CuCl - серовато-белый кристаллический порошок, используемый как инсектицид, для очистки ацетилена и денитрации искусственного шелка. Кислота HCuCl2 (с комплексным анионом) используется в газовом анализе для поглощения CO.
Соединения меди(II)
Оксид CuO - черный порошок, активный окислитель, используемый при сжигании органических соединений в элементном анализе. CuO используется также для производства солей, окраски в зеленый или голубой цвет стекла, фарфора, глиняных изделий, для очистки нефти от серы и в медицине. Гидроксид Cu(OH)2 - голубовато-зеленый порошок - в горячих растворах превращается в черный оксид меди(II). Гидроксид меди(II) растворяется в растворе тартрата щелочного металла с образованием тартрата меди CuC4H4O6 (реактив Фелинга), применяемого для обнаружения и определения восстанавливающих сахаров.
Медь получают из ее руд: куприта, содержащего оксид меди, малахита, содержащей основной карбонат меди, халькозина (медный блеск) и халькопирита (медный колчедан), содержащих сульфид меди.
Большая часть мирового производства меди используется в электротехнической промышленности для изготовления проводов. Медь принадлежит к числу микроэлементов, необходимых для нормальной жизнедеятельности растений. Ее вносят в почву с микроудобрениями. Она способствует росту растений, повышению устойчивости против засухи, холода и некоторых заболеваний.
9)
Билет 4.
10)
Все вещества реагируют и образуются в эквивалентных отношениях.
формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях
Молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль.
Расчет молярной массы эквивалента вещества осуществляется по следующим правилам:
1)Химические элементы. Мэ = М / n
Где Мэ – молярная масса эквивалента элемента, М – молярная масса элемента, n - валентность.
2)Кислоты и основания.Мэ = М / n
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – основность кислоты или кислотность (количество групп ОН) основания.
3)Соли и оксиды. Мэ = М / (N * n)
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, N – количество катионов в формуле, n – формальный заряд катиона.
4)Окислители и восстановители. Мэ = М / n
Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – количество электронов, присоединяемое одной молекулой окислителя или отдаваемое одной молекулой восстановителя.
Молярная масса одного итого же вещества может рассчитываться по – разному, в зависимости от его химических свойств.
11)
Желе́зо — элемент восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат.Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Для железа характерны степени окисления — +2 и +3.
атомная масса 55,847 . порядковый номер железа26=заряд ядра=количество протонов . 56-26=30 количество нейтронов . количество протонов=количеству электронов=26 . строение атома: Fe +26 )2 )8 )14 )2. электронная формула железа 1s2 2s2 p6 3s2 p6 4s2 3d6
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Химически чистое железо получается электролизом растворов его солей.
По данным Геологической службы США (оценка 2011 г.), мировые разведанные запасы железной руды составляют порядка 178 млрд тонн.[15] Основные месторождения железа находятся в Бразилии (1 место), Австралии, США, Канаде, Швеции, Венесуэле, Либерии, Украине, Франции, Индии. В России железо добывается на Курской магнитной аномалии (КМА), Кольском полуострове, в Карелии и в Сибири. Значительную роль в последнее время приобретают донные океанские месторождения, в которых железо совместно с марганцем и другими ценными металлами находится в конкрециях
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Ко́бальт— элемент девятой (по старой классификации — побочной подгруппы восьмой группы) четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 27. атомная масса 58,9332,число электронов=число протонов=27,число нейтронов =32. Электронная формула 1s 22s 22p 63s 23p64s 23d7 Обозначается символом Co (лат. Cobaltum). Простое вещество кобальт (CAS-номер: 7440-48-4) — серебристо-белый, слегка желтоватый металл с розоватым или синеватым отливом.
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для отделения от близкого по свойствам никеля используется хлор, хлорат кобальта (Co(ClO3)2) выпадает в осадок, а соединения никеля остаются в растворе
Самый крупный поставщик кобальта — Демократическая Республика Конго[2]. Также есть богатые месторождения в Канаде, США, Франции, Замбии, Казахстане, России.
Применение- Легирование кобальтом, катализатор химических реакций, Для изготовления постоянных магнитов, 60Со используется в качестве топлива в радиоизотопных источниках энергии.
Ни́кель — элемент десятой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28. Обозначается символом Ni (лат.Niccolum). Простое вещество никель (CAS-номер: 7440-02-0) — это пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен.Число протонов=число электронов=28,Атомная масса 58,6934. Число нейтронов = 31
Никель образует соединения со степенью окисления +2 и +3. При этом никель со степенью окисления +3 только в виде комплексных солей. Для соединений никеля +2 известно большое количество обычных и комплексных соединений. Оксид никеля Ni2O3 является сильным окислителем.
Никель характеризуется высокой коррозионной стойкостью — устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию — образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в азотной кислоте.
Основные месторождения никелевых руд находятся в Канаде, России (Мурманская область, Норильский район, Урал, Воронежская область[3]), Кубе, ЮАР, Новой Каледонии и на Украине
Основную массу никеля получают из гарниерита и магнитного колчедана.(восстановлением из руды)
12)
Массовая для меди 68%, цинка 32%,следовательно масса меди, необходимой для сплава 600*0,68=408, цинка 600*0,32=192
Билет 5.
13)Химические явления (химические реакции) – явления, при которых одни химические вещества превращаются в другие
Среди чистых веществ принято различать простые (состоящие из атомов одного химического элемента) и сложные (образованы из атомов нескольких химических элементов) вещества.
Химический элемент — это вид атомов с определённым положительным зарядом ядра. Все химические элементы указаны в Периодической системе элементов Д. И. Менделеева; каждому элементу отвечает свой порядковый (атомный) номер в Периодической системе. Значение порядкового номера элемента и значение заряда ядра атома того же элемента совпадают, то есть химический элемент — это совокупность атомов с одинаковым порядковым номером.
Простое вещество – вещество в состав которого входят атомы одного химического элемента.
Сложное вещество- вещество в состав которого входят атомы разных химических элементов.
Все химические элементы по их свойствам, то есть свойствам свободных атомов и свойствам образуемых элементами простых и сложных веществ, делят на металлические и неметаллические элементы. Условно к неметаллам относят элементы He, Ne, Ar, Kr, Xe, Rn, F, Cl, Br, I, At, O, S, Se, N, P, C и H. К полуметаллам относят B, Si, Ge, As, Sb, Te, иногда — Po. Остальные элементы считаются металлами.
А́томнаяма́сса, относительная атомная масса — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода
Молекуля́рнаяма́сса — масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе. Молекулярные массы сложных молекул можно определить, просто складывая относительные атомные массы входящих в них элементов.
Моля́рнаяма́сса вещества — масса одного моля вещества. В системе СИ единицей измерения является килограмм на моль (кг/моль). Обозначается буквой M.
Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
Моль (русское обозначение: моль; международное: mol) — единица измерения количества вещества в Международной системе единиц (СИ)
Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
14)
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr (лат.Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета. Хром иногда относят к чёрным металлам
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO•Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Самые большие месторождения хрома находятся в ЮАР (1 место в мире), Казахстане, России, Зимбабве, Мадагаскаре.
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом
Для хрома характерны степени окисления +2, +3 и +6.
Электронная формула- 1s 22s 22p 63s 23p64s 13d5
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Ма́рганец— элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn(лат.Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белогоцвета. Наряду с железом и его сплавами относится к чёрным металлам.
Электронная формула- 1s 22s 22p 63s 23p64s 23d5
Получают Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита
Характерные степени окисления марганца:0, +2, +3, +4, +6, +7 (+1, +5 мало характерны).
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода
Марганец вводят в бронзы и латуни.
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов,Нахождение в природе:
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры).
15)
Билет 6.
16)
• Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
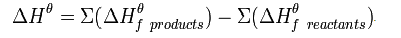
Следствия из закона Гесса: 1.Тепловые эффекты прямой и обратной реакций равны по величине и противоположны познаку.
2.Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учётом коэффициентов в уравнении реакции (то есть помноженные на них).
17)
• Магний : 1s 22s 22p 63s 2 ; Степень окисления : 0, +2 ; Взаимодействие: Mg+HCl =MgCl2+H2 ; Природные источники: ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные карбонаты: доломит, магнезит) , морская вода, рассолы (рапа соляных озёр). Получение : Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. Термический способ получения: В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3•MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции: CaCO3•MgCO3 = CaO + MgO + 2CO2, 2MgO + CaO + Si = CaSiO3 + 2Mg. Применение: Применяется для восстановления металлического титана из тетрахлорида титана. Используется для получения лёгких и сверхлёгких сплавов (самолётостроение, производство автомобилей), а также для изготовления осветительных и зажигательных ракет.
Бериллий : 1s 22s 2 ; Степень окисления : 0, +2 ; Взаимодействие: Be + 2HCl = BeCl2 + H2, Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2, Природные источники : Содержится в земной коре, в морской воде. Получение : 1. действие калия на безводный хлорид бериллия: BeCl2+2K=Be+2KCl , 2. бериллий получают, восстанавливая его фторидом магния: BeF2+Mg=Be+MgF2 , 3. либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды. Применение: Легирование сплавов, рентгенотехника, ядерная энергетика, лазерные материалы, аэрокосмическая техника, ракетное топливо, огнеупорные материалы.
Алюминий : 1s 22s 22p 63s 23p1 ; Степень окисления : 0, +3 ; Взаимодействие: Al+HCl =AlCl3+H2 , 4Al + 3O2 = 2Al2O3 ; Природные источники: содержится в земной коре. Получение: 1. Растворение оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых электродов. 2. Лабораторный : основывается на восстановлении металлическим калием (реакция протекает при нагревании без доступа воздуха): AlCl3+3K=3KCl+Al. Применение: В промышленности, в товарах народного потребления, в военно,авия и ракетном строении, производство алюминиевых порошков и пудр.
Титан : 1s 22s 22p 63s 23p64s 23d2 ; Степень окисления : 0, +2, +3, +4 ; Взаимодействие : Природные источники: Содержится в земной коре, в морской воде, в ультраосновных породах , в основных, в кислых, в глинах и сланцах. Получение: исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а не восстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом. Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2+2C+2Cl=TiCl4+2CO , Образующиеся пары TiCl4 при 850 °C восстанавливают магнием: TiCl4+2Mg=2MgCl2+Ti. Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку. Применение: для производства военного оборудования, авиация, военно-морской флот, артиллерия, транспорт, в химической, в пищевой, нефтяной и электротехнической промышленности, для изготовления хирургических инструментов
18)
при нормальных условиях (t = 0 °С, р = 101 325 Па, или 1 атм) имеем:
VM = 22,4 л/моль.
Еще одно важнейшее соотношение: мольный объем газа (22,4 л) содержит 6,02•1023 молекул (число Авогадро).
Теперь мы знаем, что такое моль. Это:
– 6,02•1023 молекул;
– 22,4 л вещества в газообразном состоянии при нормальных условиях;
Число Авогадро показывает число молекул в 1 моле любого вещества.
Это 1 грамм массы, выраженный в атомных единицах массы.
1 грамм=6,02*10^23 а. е. м.
Билет 7.
19)Термодина́мика— раздел физики, изучающий соотношения и превращения теплоты и других форм энергии.
Первый закон термодинамики: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
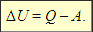
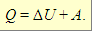
Внутренняя энергия (U) – запас энергии системы. Включает в себя все виды энергии, связанные со строением системы, и не включает кинетическую и потенциальную энергии системы как целого. Так как абсолютных знаний о строении вещества не существует, абсолютное значение внутренней энергии найти нельзя.
Энтальпия – запас энергии системы в виде теплоты
20)
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку. Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в узлах кристаллической решётки.Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью.
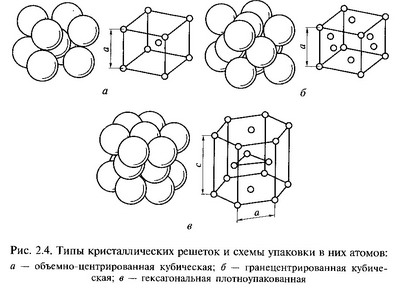
21)
Электроннаяформуласвинца: 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 ,
6 энергетических уровней, на третьем энергетическом уровне находится 8 электронов.
Билет 8.
1) Существует два классических определения второго закона термодинамики
• Кельвина и Планка
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
• Клаузиуса
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S).
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
100% энергии не может быть преобразовано в работу
Энтропия может вырабатываться, но не может быть уничтожена
Движущие силы химической реакции обусловлены ее стремлением к уменьшению запаса энергии, т.е. к уменьшению энтальпии при p = const и ее стремлением к увеличению энтропии.
В ходе химической реакции участвующие частицы перегруппировываются таким образом, чтобы уменьшалась энергия системы; это проявляется в их сближении и взаимодействии. Вместе с тем реагирующие частицы обладают отчетливой тен-денцией к беспорядочному расположению. Эти два фактора обусловливают хими-ческую обратимость реакций; преобладающее направление реакции определяется значением и знаком величин ΔH и ΔS.
критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса: ΔG < 0
Для экзотермических реакций (ΔH < 0) величина ΔG также, как правило, меньше нуля, поскольку в уравнении ΔG = ΔH - TΔS при ΔS > 0 вычитаемое будет всегда отрицательным, а при ΔS < 0 - положительным, но небольшим по значению вплоть до очень высоких температур, и, следовательно, не превышающим отрицательного значения ΔH.
Для эндотермических реакций (ΔH > 0), имеющих ΔS < 0, их протекание в за-данном направлении невозможно ни при какой температуре, т.к. всегда ΔG > 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение эн-тальпии реакции.
Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG.
23)
Пирометаллургия — совокупность металлургических процессов, протекающих при высоких температурах. Это отрасль металлургии, связанная с получением и очищением металлов и металлических сплавов при высоких температурах, в отличие от гидрометаллургии, к которой относятся низкотемпературные процессы.
Гидрометаллурги́я— выделение металлов из руд, концентратов и отходов производства с помощью водных растворов определённых веществ (химических реагентов).
Электронно-лучевая плавка — метод плавки путем использования электронного пучка. Применяется при плавке особо чистых материалов, например, сталей и титана, и материалов, стойких к высокой температуре и химическим воздействиям. При электронно-лучевой плавке загрязнение материала посторонними примесями почти отсутствует. Благодаря наличию высокого вакуума имеется возможность удаления примесей из материала. Легкость управления мощностью электронного пучка позволяет использовать разнообразные режимы плавки. Возможна температура расплава, превышающая температуру плавления. Промышленные электронные плавильные печи имеют мощность свыше 200 кВт и выдают слитки длиной до нескольких метров и весом до нескольких тонн.
Зо́ннаяпла́вка (зо́ннаяперекристаллиза́ция) — метод очистки твёрдых веществ, основанный на различной растворимости примесей в твердой и жидкой фазах. Метод является разновидностью направленной кристаллизации, от которой отличается тем, что в каждый момент времени расплавленной является некоторая небольшая часть образца. Такая расплавленная зона передвигается по образцу, что приводит к перераспределению примесей. Если примесь лучше растворяется в жидкой фазе, то она постепенно накапливается в расплавленной зоне, двигаясь вместе с ней. В результате примесь скапливается в одной части исходного образца. По сравнению с направленной кристаллизацией этот метод обладает большей эффективностью
Вакуумный переплав- При вакуумном дуговом переплаве под воздействием высоких температур, возникающих в зоне электрической дуги между переплавляемым электродом и поддоном кристаллизатора, сталь на нижнем торце электрода расплавляется и капли расплавленного металла падают в ванну, где под воздействием охлаждения кристаллизатора формируется слиток. До начала операции печь вакуумируют (остаточное давление обычно не более 1,33 Па); вакуумные насосы продолжают работать в течение всей плавки. Таким образом, капли металла падают через вакуумированное пространство, при этом обеспечивается очень полное очищение металла от газов, оксидных неметаллических включений (общее содержание кислорода снижается до очень низких пределов), от примесей некоторых цветных металлов и получается плотный слиток
Метод термического разложения летучих соединений металлов-Сущность метода заключается в том, что исходное вещество переводится в парообразное состояние и контактирует с подложкой, нагретой до температуры, при которой оно разлагается или реагирует с другим соединением с образованием на подложке слоя металла или его нелетучих соединений и газообразных продуктов, которые удаляются из зоны реакции. Осаждение может проводится как в вакууме, так и в токе газа-носителя (аргон, азот, гелий, углекислый газ)
24)
0,2М- значит См данн р-ра =0,2. См= кол-во моль сухого в-ва в раст-ре поделит на объем р-ра в литрах.решаем: n( моли в-ва) = 0,1*0,2= 0,02 моль. отсюда кол-во щелочи KOH = 0,02моль. отсода масса щелочи=0,02*40=0,8 грамм.
Билет 9.
25)
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики.
Зависимость скорости реакций от различных факторов
| Условия | Примеры |
| концентрация | При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением. Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:
 Причиной повышения скорости является увеличение числа столкновений реагирующих частиц за счёт увеличения частиц в единице объёма.
Причиной повышения скорости является увеличение числа столкновений реагирующих частиц за счёт увеличения частиц в единице объёма.
|
| температура | Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа :
 Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
|
| катализатор | Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции. Влияние, оказываемое катализаторами на химические реакции, называетсякатализом.По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать: гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь; гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз). |
| площадь соприкосновения реагирующих веществ | Для увеличения площади соприкосновения реагирующих веществ, их измельчают. Наибольшей степени измельчения достигают путем растворения веществ. Быстрее всего вещества реагируют в растворах. |
| природа реагирующих веществ | Например, металлы магний и железо реагируют с соляной кислотой одинаковой концентрации с различной скоростью. Это связано с разной химической активностью металлов. |
ЦЕПНЫЕ РЕАКЦИИ, хим. превращения и ядерные процессы, в к-рых появление промежуточной активной частицы (свободного радикала, атома, возбужденной молекулы в хим. превращениях, нейтрона - в ядерных процессах) вызывает цепь превращений исходных в-в. Примеры хим. цепных реакций- радикальная полимеризация, окисление, пиролиз и галогенирование углеводородов и др. орг. соед.; ядерные цепные процессы - цепноеделение атомных ядер. Данная статья посвящена в основном химическим цепным реакциям.
КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ, реакции, в ходе которых концентрации промежут. соединений и скорость реакции испытывают колебания. Колебания м. б. периодическими, в этом случае значения c(t) колеблющихся концентраций (t - время) можно представить рядом Фурье:
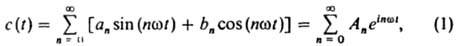
где аn, bn - коэффициенты разложения ф-ции c(t) в рад (амплитуды отдельных гармонич. компонент), An - комплексные амплитуды, w - частота колебаний (i - мнимая единица)
26) Распространение и формы нахождения металлических элементов в природе.
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее:
алюминия — 8,2%
железа — 4,1%
кальция — 4,1%
натрия — 2,3%
магния — 2,3%
калия - 2,1 %
титана — 0,56%
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
— различных солей

27)
Мельхиор - сплав с массовой долей меди 80%, никеля 20%. Определите массу никеля и меди для получения мельхиора массой 350кг.
100%=350 , 20% =х X=70никель
Медь 280.
Билет 10.
28)



Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми.
Принцип ЛеШателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции.
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
•При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
•При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Количественной характеристикой равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодоводорода:
Н2 + I22НI
Согласно закону действия масс (см. § 12), скорости прямой (v1) и обратной (v2) реакций выражаются уравнениями1:
v1=k1[H2][I2]
v2=k2[HI]2
При равновесии скорости прямой и обратной реакций равны друг другу, откуда:
k1[H2][I2]=k2[HI]2 или
k1/k2=[HI]2/[H2][I2]
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции К:k1/k2=^ К или, отсюда окончательно, [HI]2/[H2][I2]=К. В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии, — равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
29)Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характернымиметаллическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Физсв-ва: Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, обладают различной твёрдостью, Температуры плавления, плотности, пластичностью, хорошо проводят электрический ток, электропроводность теплопроводность
Химические св:На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители
Реакции с простыми веществами: Me + О2,N2,S,H2,C, c к-ми
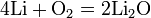
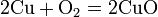
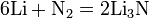
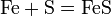
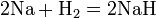
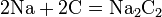
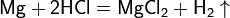
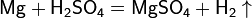
Галиды– это группа минералов, формирующих естественные соли
Галиды щелочных металлов представляют собой соли, кристаллы которых обладают высокой степенью ионности и очень просты по своей структуре.Комплексообразование с галидами щелочных металлов для рассматриваемых галидовЭГамалохарактерно, но производные типов МЭГз и МаЭГ известны.
При непосредственном образовании галидов щелочных металлов выделяются значительные количества энергии. Кристаллогидраты образует только Li - LiCl - 2H2O и, кроме фторидов, все соли гигроскопичны. Так, например, из галидов лития только LiF не изменяется при длительном хранении, а остальные соли расплываются.
31)31. Конец 19 и начало 20 веков характеризуется новыми открытиями в физике и химии, изменившими взгляд на атом, как на неизменимую частицу, свидетельствовавшими о сложном составе атомов и о возможности их взаимопревращений.
Первым основополагающим достижением в области изучения внутреннего строения вещества было создание модели атома английским физиком Резерфордом (1911г). По Резерфорду атом состоит из ядра, окруженного электронной оболочкой.
Предложенная Резерфордом схема строения атома или, как обыкновенно говорят, планетарнаямодель атома, легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
Моде́льТо́мсона (иногда называемая «пу́динговая модель а́тома») — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. После открытия им в 1897 году электрона, Томсон предположил, что отрицательно заряженные «корпускулы» (так Томсон называл электроны, хотя ещё в 1894 году Дж. Дж. Стоуни предложил называть «атомы электричества» электронами[1]) входят в состав атома и предложил модель атома, в котором в облаке положительного заряда, равного размеру атома, содержатся маленькие, отрицательно заряженные «корпускулы», суммарный электрический заряд которых равен заряду положительно заряженного облака, обеспечивая электронейтральность атомов. «Корпускулы» в этой модели распределены внутри положительно заряженного облака с одинаковой по объёмуплотностью заряда, подобно изюминкам в тесте пудинга. Отсюда произошёл термин «пудинговая модель атома».

Планетарная модель атома, или модель Резерфорда, - историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеиванием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, - подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга»Джозефа Джона Томсона, которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома 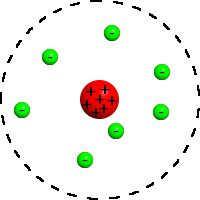
32)
Методы защиты от коррозии можно объединить в следующие группы:
1) нанесение защитных покрытий и пленок;
2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз;
3) модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом.








