51 Вирусный гепатит D : этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Гепатит D (гепатит дельта, гепатит B с дельта-агентом) — вирусный гепатит с контактным механизмом передачи возбудителя, вызываемый дефектным вирусом, репликация которого возможна только при наличии в организме HBS Ag. Заболевание характеризуется тяжёлым течением и неблагоприятным прогнозом.
Этиология. НDV — сферическая частица, это наименьший из известных вирусов животных. Он состоит из нуклеокапсида, построенного приблизительно из 70 субъединиц дельта-антигена (HDAg) и РНК HDV. Внешняя оболочка образована поверхностным антигеном HBV. Наружная оболочка HDV представлена HBS Ag. Устойчив к высоким температурам, на него не действуют кислоты и УФ-излучение. Вирус можно инактивировать щёлочами и протеазами. Многократное замораживание и оттаивание не влияют на его активность.
Эпидемиология. Основной источник возбудителя HDV-инфекции — лица с хроническими формами HBV-инфекции, заражённые HDV. Механизм передачи HDV-инфекции имеет большое сходство с передачей HBV-инфекции. Передача дельта-вируса осуществляется парентеральным путём, преимущественно с кровью. Риск заражения дельта-инфекцией особенно велик для постоянных реципиентов донорской крови или её препаратов (то есть больных гемофилией); для лиц, подвергающихся частым парентеральным вмешательствам, а также для наркоманов, вводящих наркотики внутривенно; для лиц, имеющих контакт с кровью. Заражение часто происходит в хирургических отделениях, центрах гемодиализа. Возможна трансплацентарная передача HDV от беременной плоду, в основном у HBE-позитивных матерей, инфицированных HDV. Перинатальный путь передачи также довольно редок, но развитие ко-HBV-HDV-инфекции у новорождённых возможно. Выявлено распространение HDV-инфекции в семьях, особенно среди детей, в большинстве случаев при отсутствии регистрируемых парентеральных вмешательств, что предполагает наличие естественного пути передачи дельта-инфекции. Высокая частота распространения HDV-инфекции среди лиц, ведущих беспорядочную половую жизнь (особенно среди мужчин-гомосексуалистов), даёт основание полагать, что возможен и половой путь заражения. К дельта-инфекции восприимчивы больные острой или хронической формой ВГB, особенно носители HBS -антигена. Перенесённая HDV-инфекция оставляет стойкий иммунитет. Для репликации HDV необходимы структурные компоненты HBV (HBS Ag), поэтому дельта-инфекция никогда не бывает самостоятельной и развивается только на фоне HBV-инфекции
Патогенез. Попав в организм носителя HBV, дельта-вирус находит благоприятные условия для своей репликации, так как сразу окружает себя оболочкой из HBS -антигена и затем проникает в гепатоциты благодаря наличию на их поверхности полимеризованного альбумина, имеющего сродство к HBS Ag, образующему внешнюю оболочку HDV. Внепечёночная репродукция HDV не установлена. Дельта-вирус оказывает как прямое цитопатическое действие, так и иммуноопосредованное по аналогии с HBV. Одно из доказательств цитопатического действия — значительное преобладание некротических изменений над воспалительными, выявляемое при морфологическом исследовании ткани печени больных ВГD. В то же время получены данные об отсутствии цитопатического действия HDV при выраженных нарушениях иммунитета, что позволяет предполагать наличие иммунологически опосредованного механизма повреждения гепатоцитов. При инфицировании дельта-вирусом возможны два варианта дельта-инфекции: коинфекция и суперинфекция. Первая возникает в том случае, если HDV попадает в организм здорового человека одновременно с HBV. Суперинфекция развивается у ранее инфицированных вирусом B (у больных ВГB или носителей HBS Ag) при дополнительном заражении их дельта-вирусом. Гепатит, который возникает в результате коинфекции, принято называть острым гепатитом смешанной этиологии HBV/HDV или ОГB с дельта-агентом, подчеркивая этим участие обоих вирусов в патогенезе болезни. Продукция HDV происходит одновременно с HBV, но, вероятно, активная репликация дельта-вируса следует после наработки структурных компонентов HBV (HBS Ag), и продолжительность её лимитируется продолжительностью HBS -антигенемии. Гепатит смешанной этиологии заканчивается после элиминации из организма обоих вирусов. При суперинфекции развивается острый вирусный гепатит дельта, который принято называть острая дельта(супер)-инфекция вирусоносителя ВГB. В этом случае участие HBV в развитии повреждения печени минимально, а все возникающие патологические изменения и клинические проявления обусловлены именно действием дельта-вируса. В отличие от коинфекции, имеющей обычно острое самолимитирующее течение, суперинфекцию характеризует тяжёлое прогрессирующее течение вплоть до возникновения массивного некроза печени или быстро прогрессирующего развития цирроза. Связано это с тем, что при хронической HBV-инфекции (у носителей HBS Ag, больных ВГB) в печени постоянно образуется в больших количествах HBS Ag, и HDV находит очень благоприятные условия для репликации и осуществления своего повреждающего действия. Каких-либо специфических патоморфологических признаков, присущих гепатиту дельта, большинство исследователей не обнаруживает. При коинфекции имеютсизменения, сходные с таковыми при «чистом» ОГB, но некротический процесс в гепатоцитах обычно более выражен. Для хронического ВГD характерны значительные воспалительные и некротические изменения в дольках с выраженным перипортальным гепатитом, высокая активность процесса в печени (преобладает хронический активный гепатит умеренной и выраженной активности), быстрое нарушение архитектоники печени и возможность появления морфологических признаков цирроза печени на ранних сроках заболевания (от 2 до 5 лет).
Клиника. Острый гепатит B с дельта-агентом (коинфекция) с печёночной комой и без неё Клинические проявления гепатита, развивающегося в результате коинфекции, чрезвычайно сходны с таковыми при ОГB. Инкубационный период составляет от 6 до 10 нед, характерно циклическое течение. Преджелтушный период начинается более остро, чем при ВГB, с ухудшения самочувствия, недомогания, слабости, утомляемости, головной боли. Одновременно отмечают диспепсические явления: снижение аппетита вплоть до анорексии, тошноту, рвоту. Чаще, чем при ВГB, возникают мигрирующие боли в крупных суставах. Почти у половины больных появляются боли в правом подреберье, что не характерно для ВГB. Другое отличие от ВГB — лихорадка, причём у 30% больных температура тела поднимается выше 38 °С. Продолжительность преджелтушного периода короче, чем при ВГB, и составляет в среднем около 5 дней. Желтушный период. С появлением желтухи симптомы интоксикации нарастают. На фоне желтухи сохраняются артралгии (у 30%) и субфебрилитет. Усиливаются слабость, утомляемость; чаще выявляют кожный зуд; сохраняются боли в правом подреберье, не связанные с приёмом пищи. Нередко отмечают уртикарные высыпания на коже. Наиболее продолжительные симптомы желтушного периода: слабость, снижение аппетита, боли в правом подреберье. У всех больных увеличивается печень на 1–3 см, край её эластичный, гладкий, чувствительный при пальпации. Чаще, чем при ВГB, увеличивается селезёнка. В сыворотке крови повышено содержание билирубина за счёт связанной фракции, активность трансфераз намного выше, чем при ОГB. Значительно повышается показатель тимоловой пробы, что несвойственно для ВГB; сулемовая проба остаётся нормальной. Гипербилирубинемия длится в среднем до 1,5 мес, гиперферментемия — до 2–3 мес. Заболевание нередко имеет двухволновое течение с клинико-ферментативным обострением, что можно объяснить присутствием в организме двух вирусов с различными биологическими свойствами. Предполагают, что первая волна — проявление HBV-инфекции, а вторая обусловлена дельта-инфекцией, так как к этому времени в организме уже достаточно молекул HBS -антигена, необходимого для репродукции HDV. Однако некоторые исследователи объясняют наличие второго пика АЛТ активизацией репликации HBV после периода подавления его репликации дельта-вирусом. У 60% больных на 18–32-й день от начала желтухи на фоне начинающегося улучшения нарастают слабость, головокружение, боли в области печени; вновь увеличивается печень, повышается показатель тимоловой пробы и активность трансфераз. Часто активность АСТ выше активности АЛТ, коэффициент де Ритиса более 1. Возможно снижение сулемового теста и протромбинового индекса. У некоторых больных наблюдают только ферментативное обострение без каких-либо клинических проявлений. Заболевание чаще протекает в среднетяжёлой и тяжёлой форме; в 5–25% случаев развивается фульминантная (молниеносная) форма, заканчивающаяся летально. У взрослых 60–80% фульминантных форм HBS Ag-позитивного гепатита обусловлены HDV-инфекцией. При благополучном течении гепатита смешанной этиологии длительность болезни составляет 1,5–3 мес. Болезнь заканчивается выздоровлением (примерно в 75% случаев) либо смертью — при фульминантной форме болезни. Развитие хронического гепатита наблюдают редко (1–5%). Исчезновение HBS Ag свидетельствует и о выздоровлении от дельта-инфекции. Острая дельта(супер)-инфекция вирусоносителя гепатита B. Данный вариант заболевания может протекать как манифестно, так и клинически латентно, однако у 60–70% больных всё-таки регистрируют или эпизод желтухи, или классическую картину желтушного варианта острого гепатита. Инкубационный период длится 3–4 нед. Преджелтушный период характеризует острое, иногда бурное начало. Продолжительность его не превышает 3–4 дней. В отличие от острого ВГB более чем у половины больных температура тела выше 38 °С, появляются артралгии и боли в правом подреберье, у отдельных больных отмечают уртикарную сыпь на коже. Через 2–3 дня моча становится тёмной, кал обесцвечивается, увеличиваются печень и селезёнка, появляется желтушность склер и кожи. В желтушном периоде самочувствие больных ухудшается, нарастают симптомы интоксикации, температура тела остаётся повышенной ещё 3–4 дня, не прекращаются боли в суставах, а боли в правом подреберье регистрируют чаще, чем до появления желтухи, и они носят постоянный характер. При осмотре больных обращает на себя внимание значительное увеличение и плотность как печени, так и селезёнки. Более чем у 40% больных появляется отёчно-асцитический синдром. В сыворотке крови — гипербилирубинемия (сохраняется обычно более 2 мес), гиперферментемия (нередко с извращением коэффициента де Ритиса). Активность АЛТ и АСТ остаётся высокой дольше, чем при ВГB и гепатите смешанной этиологии, причём практически ни у одного пациента уровень активности ферментов не достигает нормы. В отличие от других вирусных гепатитов при остром гепатите дельта у носителей HBS Ag существенно нарушается белково-синтетическая функция печени, что проявляется снижением показателя сулемовой пробы уже в первые 10 дней желтушного периода и повышением тимоловой пробы. Снижается количество альбуминов, повышается содержание γ-глобулиновой фракции. Развитие отёчноасцитического синдрома при этом варианте HDV-инфекции связано как с понижением синтеза альбуминов, так и с качественным их изменением. У преобладающего большинства больных заболевание протекает волнообразно с повторными клинико-ферментативными обострениями, сопровождающимися нарастанием желтухи, симптомов интоксикации, развитием отёчно-асцитического синдрома, кратковременными (1–2-дневными) волнами лихорадки с познабливанием, появлением эфемерной сыпи на коже. Выраженность клинических симптомов у отдельных больных уменьшается при каждой новой волне, а у других заболевание принимает прогредиентный характер: развиваются подострая дистрофия печени, печёночная энцефалопатия, и наступает летальный исход. Выздоровление наступает крайне редко, исходы почти всегда неблагоприятны: либо летальный исход (при фульминантной форме или при тяжёлой форме с развитием подострой дистрофии печени), либо формирование хронического ВГD (примерно у 80%) с высокой активностью процесса и быстрым переходом в цирроз печени. Ещё один возможный вариант суперинфекции — заражение дельта-вирусом больных ХГB. Клинически это проявляется обострением до того благоприятно протекающего гепатита, появлением интоксикации, желтухи, гиперферментемии, а также прогрессией в цирроз печени.
Диагностика. Вирусный гепатит смешанной этиологии можно предположить при соответствующем эпидемиологическом анамнезе (переливание крови, внутривенное введение наркотиков и др., многократные парентеральные вмешательства и т.д.), более остром, чем при ВГB, начале заболевания, лихорадке, непродолжительном преджелтушном периоде с болями в правом подреберье и суставах, двухволновом и более тяжёлом течении гепатита, выраженной гиперферментемии, повышении (нерезком) показателей тимоловой пробы. 
При развитии тяжёлого течения гепатита дельта нередко из крови исчезает HBS Ag и ДНК HBV, но определяется РНК HDV. Этот феномен большинство исследователей трактуют как следствие подавления репликативной активности HBV дельта вирусом. Предположение об остром ВГD должно возникнуть при очень коротком преджелтушном периоде, сочетании выраженной гепатоспленомегалии с болями в правом подреберье, отёчно-асцитическим синдромом, лихорадкой, гипербилирубинемией, гиперферментемией, низких значениях сулемовой пробы, повышении показателя тимоловой пробы и уровня γ-глобулиновой фракции в сыворотке крови. Острый гепатит дельта следует предположить также при появлении желтухи у «здоровых» носителей HBS Ag или при обострении ХГB.
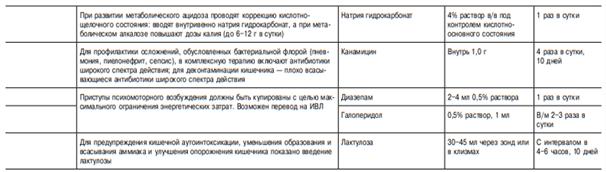
Лечение. 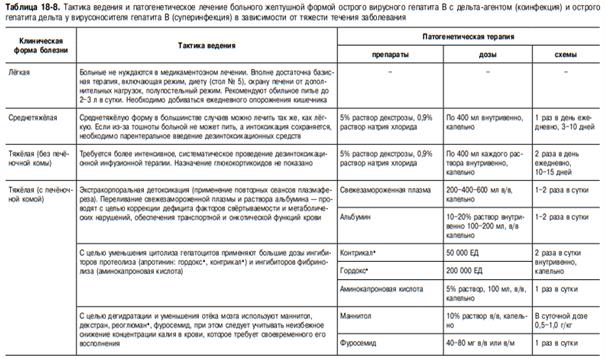
Профилактика. При HDV-инфекции профилактические мероприятия те же, что и при HBV-инфекции. Вакцинация здоровых людей против ВГB обеспечивает защиту и от дельта-вирусной инфекции. Особенно тщательно от возможного присоединения дельта-вирусной инфекции следует оберегать носителей HBS -антигена и больных ХГB. Проводят разъяснительную работу, родственники больного и сам больной ВГB должны знать о путях заражения дельта-инфекцией и необходимости соблюдения мер безопасности.
Хронический вирусный гепатит B с дельта-агентом ХГB с дельта-агентом протекает в большинстве случаев тяжелее, чем неосложнённый вирусом дельта. Имеются данные, указывающие на то, что факторы вируса (генотип), возможно, во многом определяют течение болезни. В целом, в отличие от ХГB и ВГС, при которых как минимум 70–50% больных проживают свою жизнь без формирования цирроза печени, у 100% больных хроническим ВГD в течение 15–30 лет от момента инфицирования цирроз печени неизбежно развивается при отсутствии лечения. Далее 10-летняя выживаемость составляет 58% при бессимптомном циррозе печени и 40% при клинически выраженном циррозе. В среднем у 15% больных наблюдают медленно прогрессирующее течение (30 лет и более до формирования цирроза), у 5–10% больных, напротив, заболевание быстро (от нескольких месяцев до двух лет) прогрессирует в цирроз печени. Клинические проявления хронического гепатита дельта варьируют в широком диапазоне — от бессимптомного течения до клинически выраженного, активно протекающего гепатита с обилием жалоб, утратой трудоспособности и частыми обострениями, приводящими к госпитализации. Нередко через 1–2 года после суперинфицирования больной начинает ощущать слабость, снижение работоспособности. Возможны половые расстройства у мужчин и расстройства менструального цикла у женщин. Появляется чувство тяжести в правом подреберье, снижается толерантность к алкоголю, пищевым нагрузкам, больной отмечает похудание. Прогрессирование вышеуказанных жалоб заставляет больного обратиться к врачу и при осмотре и лабораторном исследовании выявляют гепатоспленомегалию, уплотнение печени, тромбоцитопению и гиперферментемию (5–10 норм)
Лечение Единственным препаратом, позволяющим снизить уровень цитолиза и замедлить прогрессирование заболевания при циррозе печени, является интерферон альфа. Высокие дозы интерферона (9–10 млн ЕД) 3 раза в неделю или применение пегилированного интерферона альфа-2 позволяют добиться стойкого биохимического ответа на лечение. Наиболее продуктивно лечение в течение первого года от суперинфицирования. Несмотря на нормализацию активности трансфераз на фоне лечения, как правило, после отмены терапии у большинства больных, по данным биохимических исследований, регистрируют обострение. Устойчивый ответ на лечение наблюдают только у 10–15% больных. Случаи сероконверсии HBS Ag/анти-HBS , что трактуют как излечение, крайне редки. Нуклеозидные аналоги (рибавирин, ламивудин) неэффективны.
52. Марсельская лихорадка этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Марсельская лихорадка (Marseilles febris, ixodorickettsiosis, марсельский риккетсиоз, папулёзная лихорадка, болезнь Кардуччи–Ольмера, лихорадка клещевая, средиземноморская и др.) — острый зоонозный риккетсиоз с трансмиссивным механизмом передачи возбудителя, характеризующийся доброкачественным течением, наличием первичного аффекта и распространённой макулопапулёзной сыпью.
Этиология. Возбудитель — палочковидная грамотрицательная бактерия Rickettsia conorii. Облигатный внутриклеточный паразит; размножается в культуре тканей (в желточном мешке куриного эмбриона) и при заражении лабораторных животных (в клетках мезотелия). Патогенен для морских свинок, обезьян, кроликов, сусликов, белых мышей и белых крыс. По антигенным свойствам близок к другим возбудителям группы клещевых пятнистых лихорадок. Может паразитировать в цитоплазме и ядрах клеток хозяина. У больных возбудитель выявляют в крови в первые дни лихорадочного периода, в первичном аффекте и в розеолах кожи. В окружающей среде неустойчив.
Эпидемиология. Основной переносчик — собачий клещ Rhipicephalus sanguineus, в организме которого они сохраняются до 1,5 года; характерна трансовариальная передача возбудителя. Переносчиками могут быть и другие клещи (Rhipicephalus simus, Rh. everbsi, Rh. appendiculatus). Резервуар возбудителя — многие виды домашних и диких животных (например, собаки, шакалы, ежи, грызуны). Сезонность марсельской лихорадки (май–октябрь) также обусловлена особенностью биологии собачьего клеща (в этот период значительно увеличивается их количество и повышается активность). Человеку возбудитель передаётся при присасывании клеща, однако возможно заражение при раздавливании и втирании в кожу инфицированных клещей. Собачий клещ относительно редко нападает на человека, поэтому заболеваемость носит спорадический характер. Заболевание диагностируют в основном среди владельцев собак. Случаи марсельской лихорадки регистрируют в странах Средиземноморья, на побережье Чёрного моря, в Индии. В Астраханской области распространена астраханская риккетсиозная лихорадка (АРЛ — вариант марсельской лихорадки), рассматриваемая по ряду эпидемиологических, экологических и клинических критериев как самостоятельная нозологическая форма. Случаев передачи возбудителя от человека к человеку не выявлено. Постинфекционный иммунитет устойчивый.
Патогенез. Начало заболевания обусловлено развитием риккетсиемии и токсинемии. Возбудитель проникает через кожу или слизистые оболочки носа и конъюнктивы. На месте внедрения формируется первичный аффект («чёрное пятно»), выявляемый вскоре после укуса клещом (за 5–7 сут до возникновения симптомов заболевания). Через лимфатическую систему риккетсии сначала попадают в регионарные лимфатические узлы (вызывают лимфоаденит), а затем в кровь (поражают эндотелий капилляров и венул). При этом возникают изменения, схожие с выявляемыми при эпидемическом сыпном тифе, однако количество гранулём (узелков) меньше и некротические изменения выражены слабее
Клиника. Инкубационный период относительно короткий (3–7 сут). Особенность марсельской лихорадки — наличие первичного аффекта, выявляемого у большинства пациентов до начала заболевания. Первичный аффект сначала представляет собой очаг воспаления кожи с покрытым тёмной корочкой участком некроза диаметром 2–3 мм в центре. Размеры первичного аффекта постепенно увеличиваются до 5–10 мм к началу лихорадочного периода. Корочка отпадает лишь на 5–7-е сут после установления нормальной температуры. Открывшаяся небольшая язвочка постепенно эпителизируется (в течение 8–12 сут), после чего остаётся пигментированное пятно. Локализация первичного аффекта разнообразна (обычно на участках кожи, закрытых одеждой); может быть 2–3 очага. На субъективные ощущения в области первичного аффекта больные не жалуются. Примерно у трети из них возникает регионарный лимфаденит с небольшим увеличением и болезненностью лимфатических узлов. Начало заболевания острое, с быстрым повышением температуры до 38–40 °С. Лихорадка постоянного типа (реже ремиттирующая) сохраняется в течение 3–10 сут и сопровождается ознобом, сильной головной болью, общей слабостью, выраженной миалгией, а также артралгией и бессонницей. Возможна рвота. При осмотре выявляют гиперемию и некоторую одутловатость лица, инъекцию сосудов склер и слизистых оболочек зева. Для разгара заболевания характерно появление экзантемы (на 2–4-е сутки его течения), выявляемой у всех больных. Сыпь возникает сначала на груди и животе, затем распространяется на шею, лицо, конечности; почти у всех больных её обнаруживают на ладонях и подошвах. Высыпания обильные (особенно на конечностях), состоят из пятен и папул, часть элементов подвергается геморрагическом превращению. У многих больных на месте папул возникают везикулы. На ногах сыпь наиболее обильна; её элементы ярче и крупнее, чем на других участках кожи. Высыпания исчезают через 8–10 сут, оставляя после себя пигментацию кожи, сохраняющуюся иногда до 2–3 мес. Выявляют брадикардию, небольшое снижение АД. Существенной патологии органов дыхания не развивается. Живот мягкий или (у некоторых больных) умеренно вздут, при пальпации безболезненный. У 50% больных в лихорадочном периоде выявляют задержку стула и очень редко жидкий стул. У некоторых пациентов выражено увеличение печени и, реже, селезёнки. Снижается суточный диурез и возникает протеинурия (особенно в первую неделю). В период реконвалесценции улучшается общее состояние и угасают все симптомы.
Диагностика. При диагностике данного заболевания учитывают эпидемиологические предпосылки (пребывание в эндемичной местности, сезон, контакт с собаками, укусы клещами и др.). В клинической картине наибольшее значение имеет триада симптомов: · первичный аффект («чёрное пятно»); · регионарный лимфаденит; · раннее появление обильной полиморфной сыпи по всему телу, включая ладони и подошвы. Учитывают умеренную выраженность общей интоксикации и отсутствие тифозного статуса. ПЦР-исследование может применяться с первых дней заболевания, проводится с кровью, биоптатами, взятыми из первичного аффекта либо участка кожи с сыпью. Серологические методы используются для ретроспективной диагностики, наиболее информативным является ИФА – значительный рост титра антител возникает с 5-10 дня болезни и становится диагностически значимым к 45 суткам.
Лечение. Пациенты с подозрением на данную инфекцию неконтагиозны, но должны госпитализироваться по эпидемиологическим и клиническим показаниям. Вводится постельный режим до устойчивого снижения температуры тела в течение 5-6 дней. Диета включает легкоусвояемые питательные блюда комнатной температуры, исключает алкоголь, приправы, жареную пищу. При отсутствии пищевой аллергии рекомендуется вводить в рацион продукты, богатые витамином С (киви, цитрусовые). Этиотропными препаратами, применяемыми в терапии марсельской лихорадки, считаются антибиотики (тетрациклин, доксициклин, азитромицин, кларитромицин). Также используются дезинтоксикационные средства (ацесоль, сукцинатсодержащие, глюкозо-солевые растворы), ангиопротекторы (рутозид), жаропонижающие (целекоксиб). Необходимо исключить аспирин-содержащие медикаменты. Для уменьшения выраженности геморрагического синдрома назначаются препараты кальция, аминокапроновая, транексамовая кислота.
Профилактика. Специфической профилактики не разработано. В эпидемических очагах проводят обработку возможных мест обитания клещей инсектицидами (например, собак, собачьих будок), отлов бродячих собак.
53. Болезнь Брила патогенез, клиническая картина, диагностика, лечение, профилактика.
Болезнь Блилла (рецидив сыпного тифа) - острая циклическая инфекционная болезнь, которая представляет собой эндогенный рецидив сыпного тифа, проявляющийся через многие годы у лиц, переболевших эпидемическим сыпным тифом. Для этого заболевания характерны спорадичность, отсутствие педикулёза, типичная клиническая симптоматика, более лёгкое течение, чем при эпидемическом сыпном тифе.
Патогенез. При болезни Брилла патогенез и патологическая анатомия практически совпадают с таковыми при эпидемическом сыпном тифе. Однако поражение сосудов с развитием гранулематоза (узелки Попова) менее выражено, что обусловлено специфическим иммунитетом. С этим же связана и меньшая продолжительность риккетсиемии (8–10 сут).
Клиническая картина. Инкубационный период исчисляется десятилетиями. С момента воздействия фактора, провоцирующего рецидив, обычно проходит 5–7 дней. Клиническая картина сходна с эпидемическим сыпным тифом. Болезнь проходит те же периоды, но отличается менее выраженной интоксикацией. Протекает преимущественно в среднетяжёлой (70% больных) или лёгкой форме. Сыпь на коже появляется в те же сроки и сохраняется 5–7 дней, имеет такую же локализацию, но преобладают розеолёзные, крупные (0,5–1,0 см) розеолёзно-папулёзные элементы; петехии отсутствуют либо их немного. У ряда больных (до 10%) высыпаний нет. Серьёзные психические нарушения наблюдаются редко, но возможны эйфория, возбуждение или заторможенность, умеренный делириозный синдром, нарушения сна, иногда деперсонализация. Размеры печени и селезёнки обычно нормализуются к 3–4-му дню после снижения температуры. Изменения сердечно-сосудистой системы исчезают к 5–7-му дню, а функции ЦНС восстанавливаются к 15–17-му дню после нормализации температуры.
Специфическая диагностика. При лабораторной диагностике болезни Брилла используют преимущественно серологические методы. При этом IgG выявляют в более ранние сроки, а IgM могут отсутствовать. Серологическая диагностика возможна с 5-7 дня заболевания. Используются реакция агглютинации с риккетсиями Провацека (диагностический титр 1:160), РНГА (диагностический титр 1:1000), РСК (диагностический титр 1:160). Серологические исследования проводят с парными сыворотками.
Лечение. Госпитализировать больных с подозрением на болезнь Брилла обязательно. Наиболее эффективны антибиотики тетрациклиновой группы, которые назначают по 0,3—0,4 г 4 раза в сутки. Можно использовать левомицетин (по 0,5 г 4 раза в сутки). Антибиотики дают до 2-го дня нормальной температуры. Длительность курса лечения обычно 4—5 дней. Прогноз в настоящее время благоприятный. Выписывают больного из стационара после полного клинического выздоровления, но не раннее 12-го дня нормальной температуры. Профилактика и мероприятия в очаге.
54. Скарлатина. этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Скарлатина — острая антропонозная инфекция с аэрозольным механизмом передачи возбудителя, которой свойственны острое начало, лихорадка, интоксикация, тонзиллит и мелкоточечная сыпь.
Этиология. b-гемолитический стрептококк группы А, который кроме скарлатины способен вызывать рожу, ангину, ревматизм и др.
Эпидемиология. Источники инфекции — больной скарлатиной или реконвалесцент, больные рожей, хроническим тонзиллитом, назофарингитом, а также здоровые носители стрептококка. Больной скарлатиной опасен для окружающих в последние 2 дня инкубационного периода, весь период болезни и до 21 дня реконвалесценции. Механизм передачи — воздушно-капельный, иногда передается бытовым путем. Восприимчивость высокая (индекс контагиозности 40%)
Патогенез. Возбудитель проникает в организм человека через слизистую оболочку зева и носоглотки; в редких случаях возможно заражение через слизистую оболочку половых органов или повреждённую кожу (экстрабуккальная скарлатина). В месте адгезии бактерий формируется воспалительно-некротический очаг. Развитие инфекционно-токсического синдрома обусловлено поступлением в кровоток эритрогенного токсина (токсина Дика), а также действием пептидогликана клеточной стенки стрептококков. Вследствие токсинемии происходит генерализованное расширение мелких сосудов во всех органах, в том числе в кожных покровах и слизистых оболочках, и возникает характерная сыпь. В результате выработки, накопления антитоксических антител при развитии инфекционного процесса и связывания ими токсинов ослабевают симптомы интоксикации и постепенно исчезает сыпь. Одновременно возникают умеренные признаки периваскулярной инфильтрации и отёка дермы. Эпидермис пропитывается экссудатом, и клетки эпидермиса ороговевают, что приводит к шелушению кожи после угасания скарлатинозной сыпи. Крупнопластинчатый характер шелушения в толстых слоях эпидермиса на ладонях и подошвах можно объяснить сохранением прочной связи между ороговевшими клетками в этих местах. Компоненты клеточной стенки стрептококка (групповой А-полисахарид, пептидогликан, белок М) и внеклеточные продукты (стрептолизины, гиалуронидаза, ДНКаза и др.) обусловливают развитие реакций ГЗТ, аутоиммунных реакций, формирование и фиксацию иммунных комплексов, нарушения системы гемостаза. Во многих случаях их можно считать причиной развития миокардита, гломерулонефрита, артериитов, эндокардита и других осложнений иммунопатологического характера. Из лимфатических образований слизистой оболочки ротоглотки возбудители по лимфатическим сосудам попадают в регионарные лимфатические узлы, где происходит их накопление, сопровождающееся воспалительными реакциями с очагами некроза и лейкоцитарной инфильтрации. Последующая бактериемия может вызвать попадание микроорганизмов в различные органы и системы и формирование гнойно-некротических процессов в них (гнойный лимфаденит, отит, поражения костной ткани височной области, твёрдой мозговой оболочки, височных синусов и др.).
Клиника. Инкубационный период в среднем 2-7 дней. Заболевание начинается остро. Опорными клиническими симптомами являются: · Лихорадка, интоксикационный синдром · Ангина, увеличение регионарных лимфоузлов (яркая гиперемия слизистой ротоглотки, ангина может быть катаральной, фолликулярной, некротической, ложно-фибринозной) · “Малиновый язык” (язык вначале густо обложен серо-желтым налетом, со 2-3 дня начинает очищаться с краев и кончика, становится ярко-красным с выраженными сосочками) · Основным диагностическим симптомом является сыпь. Появляется на 1-й, иногда 2-й день заболевания. Мелкоточечная на гиперемированном фоне, сливается. Бледный носогубный треугольник (симптом Филатова). Более насыщена на боковых поверхностях туловища, внизу живота, на сгибательных поверхностях конечностей, особенно в естественных складках кожи: в подмышечных, паховых локтевых, подколенных. Дермографизм белый. Держится 3-7 дней, затем начинается крупнопластинчатое шелушение. · В крови лейкоцитоз нейтрофильного характера со сдвигом влево
Диагностика. Клинические данные: острое начало заболевания, лихорадка, интоксикация; острый катаральный, катарально-гнойный или некротический тонзиллит; обильная точечная сыпь в естественных складках кожи. • Лабораторные данные: нейтрофильный лейкоцитоз со сдвигом влево, повышение СОЭ; обильный рост β-гемолитических стрептококков при посеве материала из очага инфекции на кровяной агар; нарастание титров антител к стрептококковым антигенам: М-протеину, А-полисахариду, стрептолизину О и др. Чистую культуру возбудителя практически не выделяют в связи с характерной клинической картиной заболевания и широким распространением бактерий у здоровых лиц и больных с другими формами стрептококковой инфекции. Для экспресс-диагностики применяют РКА, определяющую антиген стрептококков.
Лечение. Препаратом выбора является пенициллин, который назначается в суточной дозе 30-50 тыс./кг массы тела, 6 раз в сутки в течение 5-7 дней. При непереносимости пенициллинов назначают эритромицин, тетрациклин или левомицетин в возрастных дозах. Назначают полоскания горла раствором фурацилина 1:5000, настоями ромашки, календулы, эвкалипта. Показаны витамины и антигистаминные средства в обычных терапевтических дозах. Симптоматические средства применяют по показаниям
Профилактика. Отсутствие контакта с больными скарлатиной, рациональное и сбалансированное питание, проветривание и влажная уборка помещения, в котором проживают дети и взрослые, соблюдение личной гигиены, мытье рук, закаливание и занятия спортом, своевременное лечение всех хронических заболеваний: отитов, синуситов, тонзиллитов и других. Профилактика в детском саду, где выявлен больной скарлатиной:в группе детского сада, где выявлен больной скарлатиной, вводится карантин на неделю, игрушки, посуда, мебель подвергается дезинфекции, помещения обрабатываю кварцевой лампой, проводится наблюдение в течение недели за детьми, контактировавшие с больным скарлатиной (ежедневный осмотр зева, термометрия).Профилактика дома, где выявлен больной: изоляция больного, ежедневная уборка и проветривание всех помещений, дезинфекция посуды, игрушек и других предметов с которыми контактировал больной, стирка белья больного отдельно от одежды членов семьи, уход за больным исключительно в маске, плотно прилегающей к лицу.








