Кратко геморрагические лихорадки.
Геморрагическая лихорадка с почечным синдромом. Инкубационный период 10-15 дней. Болезнь начинается остро с озноба. Температура тела повышается до 39-40°С. Характерны резкая головная боль, боль в пояснице, светобоязнь, расстройства зрения (снижение остроты, “туман” перед глазами). Носогубный треугольник бледный, а лицо, шея, верхняя половина туловища гиперемированы. Слизистая оболочка ротоглотки ярко-красная с точечными кровоизлияниями. На 3-5 день болезни на шее, боковых поверхностях грудной клетки, в подмышечных впадинах, над ключицами появляется петехиальная сыпь, необильная, элементы мелкие, неправильной формы. Затем появляются носовые, кишечные, легочные кровотечения. Почти у всех больных наблюдаются симптомы поражения пищеварительного тракта: сухость языка, тошнота, рвота, вздутие и боль в животе. у 25% больных увеличиваются печень и селезенка. Ведущим является почечный синдром. Он проявляется болью в пояснице, положительным симптомом Пастернацкого, развитием олигурии или анурии. Протеинурия может достигать 40 г/л, в моче — патологический осадок. В крови повышается концентрация азотистых шлаков и креатинина. Общий анализ крови. Умеренная гипохромная анемия, лейкоцитоз с нейтрофилезом, тромбоцитопения, ускоренная СОЭ.
Желтая лихорадка. Инкубационный период 3-6 дней. Выделяют 2-е стадии болезни. Первая — стадия гиперемии — характеризуется острым началом с выраженным ознобом, повышением температуры тела, многократной рвотой. Отмечается резкая гиперемия и одутловатость лица и шеи, гиперемия конъюнктив. Слизистая оболочка ротоглотки ярко-красная. Светобоязнь. С 3-го дня заболевания кожа и склеры становятся желтыми, на коже появляются мелкоточечные кровоизлияния, увеличиваются печень и селезенка. Затем наступает ремиссия, которая длится 1-2 дня (температура снижается до нормы, улучшается общее самочувствие). С 5-го дня болезни состояние больного резко ухудшается (стадия венозного стаза). Снова повышается температура до 40°С. Нарастает желтуха. Лицо становится бледно-желтым с синюшным оттенком. Усиливаются тошнота и рвота. Рвотные массы темно-коричневого или черного цвета. Мелена. На коже появляются новые петехии и экхимозы. Поражаются почки (олигоанурия, патологический осадок в моче). Тахикардия сменяется брадикардией. Общий анализ крови. Лейкопения, нейтропения.
Лихорадка Ласса. Начинается с незначительного повышения температуры, недомогания, мышечных болей, конъюнктивита. Постепенно температура повышается до 39-40°С и развивается фарингит (чаще язвенно-некротический). Наблюдаются менингеальный синдром, нарушения сознания, тошнота, рвота, понос, боль в животе и грудной клетке, кашель, генерализованная лимфоаденопатия. Отмечается относительная брадикардия. Увеличивается печень. При тяжелом и среднетяжелом течении отмечаются умеренные кровотечения различной локализации и петехиальная сыпь на коже и слизистых оболочках, реже розеолы и папулы. Общий анализ крови. Лейкопения со сдвигом формулы влево, тромбоцитопения.
Лихорадки Эбола и Марбурга. Начинаются остро. Ранними признаками является конъюнктивит и экзантемы. В первые дни болезни появляются сильные головные боли, тошнота, рвота, частый водянистый стул. Типична макуло-папуллезная сыпь, которая распространяется на верхние конечности, шею и лицо. С 5-7 дня заболевания отмечается геморрагический синдром. Общий анализ крови. Сначала лейкопения, затем — лейкоцитоз со сдвигом влево, тромбоцитопения.
Специфическая диагностика геморрагических лихорадок. Диагноз подтверждается вирусологическими (в специально оборудованных лабораториях) и серологическими методами исследования. Для серодиагностики используют РСК (реакция связывания комплемента), РН (реакция нейтрализации), РИА (радиоиммунный анализ) с парными сыворотками.
Лечение. Только при лихорадке Ласса применяют этиотропную терапию – рибавирин. При остальных лихорадках возможно использование иммунных сывороток. В основном же проводится патогенетическая и симптоматическая терапия. С целью профилактики желтой лихорадки используют живую вакцину “Дакар” или 17-Д.
29. Желтая лихорадка: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Жёлтая лихорадка — острое природно-очаговое трансмиссивное вирусное заболевание, антропозооноз, характеризующееся поражением печени, геморрагическим синдромом, тяжёлым циклическим течением. Жёлтую лихорадку относят к карантинным заболеваниям (особо опасные), подлежащим международной регистрации.
Этиология. Возбудитель — РНК-содержащий вирус Viceronhilus tropicus рода Flavivirus семейства Flaviviridae, относящийся к группе арбовирусов. Капсид имеет сферическую форму; В окружающей среде малоустойчив: быстро инактивируется при низких значениях рН, воздействии высокой температуры и обычных дезинфицирующих средств. Длительно сохраняется при низких температурах (в жидком азоте до 12 лет). Установлено антигенное родство с вирусами денге и японского энцефалита. Вирус жёлтой лихорадки агглютинирует эритроциты гусей, вызывает цитопатический эффект в клетках линий Hela, KB, Детройт-6. Вирус культивируют на куриных эмбрионах и в культурах клеток теплокровных животных. Возможно также использование клеток некоторых членистоногих, в частности комаров Aedes aegypti. Показано, что при длительных пассажах в культуре клеток и куриных эмбрионах патогенность вируса для обезьян существенно снижается, что используют для приготовления вакцин.
Эпидемиология. В настоящее время различают два эпидемиологических типа жёлтой лихорадки: G эндемическая жёлтая лихорадка (джунглевая, или зоонозная); G эпидемическая жёлтая лихорадка (городская, или антропонозная). На американском континенте к переносчикам возбудителя этого заболевания относят комаров родов Haemagogus и Aedes, а в Африке — ряд видов рода Aedes, среди которых основную роль играют A. africanus и A. simpsoni. Основной источник возбудителя — обезьяны, однако могут быть также грызуны и ежи. A. africanus во время сухого сезона сохраняет активность в кронах деревьев и тем самым постоянно обеспечивает циркуляцию вируса. Обычно заражаются люди, по роду своей деятельности часто посещающие леса. Инфицированный человек, в свою очередь, представляет источник вируса для комара A. aegypti, обитающего рядом с жилищем человека. Для размножения комары используют декоративные водоёмы, бочки с водой и другие временные вместилища воды; часто нападают на человека. В организме комара возбудитель сохраняется в течение всей жизни насекомого, однако трансовариальной передачи возбудителя не происходит. При температуре окружающей среды 25 °С комар становится способным передать возбудителя человеку через 10–12 сут после заражения, а при 37 °С — 4 сут. Попавший в комара вирус сначала размножается в тканях средней кишки, затем через гемолимфу попадает практически во все органы насекомого, в том числе слюнные железы; при этом количество вируса возрастает в тысячи раз по сравнению с исходным уровнем. Патологические изменения у комаров происходят на клеточном уровне, однако не влияют на физиологические показатели и продолжительность жизни насекомого. На развитие возбудителя в комаре влияет объём поглощённой им крови и количество полученного при этом вируса (заражение комара происходит только при попадании в него определённого минимального количества вирионов). Если циркуляция вируса происходит по цепочке «человек–комар–человек», то жёлтая лихорадка становится типичным антропонозом. Вирусемия у больного развивается в конце инкубационного периода и в первые 3 сут течения заболевания. Вирус, передаваемый комарами, поражает людей любого возраста и пола. В эндемических очагах взрослые болеют реже детей. Заболевание периодически регистрируют в ряде стран тропической Африки, в Южной Америке и Мексике. Однако вспышки этого заболевания могут возникать практически на любых территориях, где есть переносчики вирус. Вирус распространяется из эндемичных очагов при помощи инфицированных людей и переносчиков. При наличии условий для распространения возбудителя (вирусоносители, большое количество переносчиков и восприимчивых людей) жёлтая лихорадка может принять вид эпидемии. Больной в отсутствие переносчика эпидемиологически не опасен. Комар A. aegypti обитает в субтропических районах России, но случаев жёлтой лихорадки в нашей стране выявлено не было. Врождённым иммунитетом к жёлтой лихорадке человек не обладает. У переболевших развивается пожизненный иммунитет. Восприимчивость людей к вирусу очень высокая, при этом в эндемичных районах часто происходит латентная иммунизация местного населения малыми дозами вируса.
Патогенез. Заражение происходит при укусе инфицированным комаром. При заражении вирус по лимфатическим сосудам проникает в регионарные лимфатические узлы, в которых происходит его репликация во время инкубационного периода. По прошествии нескольких дней он поступает в кровь и распространяется по всему организму. Длительность периода вирусемии 3–6 сут. В это время вирус попадает главным образом в эндотелий сосудов, печень, почки, селезёнку, костный и головной мозг. При развитии заболевания выявляют выраженный тропизм возбудителя к кровеносной системе этих органов. В результате возникает повышенная проницаемость сосудов, особенно капилляров, прекапилляров и венул. Развиваются дистрофия и некроз гепатоцитов, поражение клубочковой и канальцевой систем почек. Развитие тромбогеморрагического синдрома обусловлено как поражением сосудов и микроциркуляторным расстройствами, так и нарушением синтеза в печени плазменных факторов гемостаза. Кожные покровы умерших людей обычно окрашены в жёлтый цвет, часто багровые из-за венозной гиперемии. На коже и слизистых оболочках выявляют геморрагическую сыпь. Характерны дегенеративные изменения печени, почек, сердца. Печень и почки значительно увеличены, с мелкоточечными кровоизлияниями, жировой дистрофией, очагами некроза (в тяжёлых случаях субтотального). Выявляют характерные изменения в печени, при этом обнаруживают тельца Каунсилмена. Кроме изменений цитоплазмы, в ядрах клеток печени обнаруживают ацидофильные включения (тельца Торреса). Они возникают вследствие размножения вируса в клетках и изменений в их ядрах. Несмотря на существенные изменения в печени, после выздоровления наблюдают восстановление её функций без развития цирроза. В ряде случаев причина смерти — поражение почек, характеризующееся набуханием и жировой дистрофией почечных канальцев вплоть до некроза. В канальцах скапливаются коллоидные массы, кровяные цилиндры. Изменения в клубочках почек часто незначительны. Селезёнка переполнена кровью, ретикулярные клетки фолликул гиперплазированы. Дегенеративные изменения происходят в мышце сердца; в перикарде выявляют кровоизлияния. Характерны множественные кровоизлияния в желудке, кишке, лёгких, плевре, а также периваскулярные инфильтраты в головном мозге.
Клиника. Инкубационный период обычно составляет 3–6 сут (редко до 10 сут). В типичных случаях заболевание имеет двухволновое течение с тремя периодами: G начальный лихорадочный (период гиперемии); G период ремиссии со снижением температуры тела; G период венозного стаза (реактивный). Заболевание начинается, как правило, остро без продромальных явлений. Высокая лихорадка развивается уже в течение первых суток. Подъём температуры сопровождается ознобом, болями в мышцах спины и конечностей и сильной головной болью. Возникают тошнота, рвота. Обычно температура тела снижается до нормальных значений к исходу 3-х суток, но при тяжёлом течении лихорадка может длиться 8–10 сут. Затем температура вновь повышается, обычно не достигая первоначальных высоких значений. В начале заболевания возникает гиперемия лица, шеи и верхней части туловища, выраженная инъекция сосудов склер, отёчность век, припухлость губ, одутловатость лица («амарильная маска»). Характерны светобоязнь и слёзотечение. Слизистая оболочка рта и язык ярко красного цвета. Больные страдают бессонницей. Появляются тошнота, рвота с примесью жёлчи. Пульс достигает 100–130 ударов в минуту, хорошего наполнения; в дальнейшем развивается брадикардия. АД в норме, тоны сердца слегка приглушены. Выявляют увеличение печени и селезёнки, возможна болезненность их при пальпации. В общем анализе крови выявляют нейтропению и лимфопению, СОЭ не увеличена. Характерна протеинурия. С началом желтушного окрашивания склер, конъюнктив и мягкого нёба снижается АД и появляется цианоз. Состояние больных значительно ухудшается. Возможны носовые кровотечения, кровоточивость дёсен, в рвотных массах выявляют кровь. При тяжёлом течении заболевания в этот период больной может умереть. При более лёгком течении наступает стадия ремиссии, при этом температура тела снижается до нормальных значений, общее состояние улучшается, прекращаются тошнота и рвота, лицо бледнеет, исчезает одутловатость. Однако уже через несколько часов вновь происходит резкое ухудшение состояния больных, температура тела быстро повышается. Эти признаки свидетельствуют о переходе заболевания в наиболее тяжёлый период — венозного стаза, наблюдаемый примерно у 15% больных и характеризуемый развитием желтухи, геморрагического диатеза и ОПН. Выявляют кровоточивость дёсен, а также носовые, маточные и кишечные кровотечения. На фоне полиморфной сыпи на коже возникают геморрагии. Нередко появляется рвота цвета кофейной гущи. АД падает; тоны сердца приглушены; пульс слабого наполнения до 40 в минуту. Состояние больного часто отягощается поражением почек; выявляют снижение диуреза. Олигурия может смениться анурией; возможно развитие азотемии. Количество белка в моче возрастает до 10 г/л и больше, появляются зернистые и гиалиновые цилиндры. В крови нарастает уровень мочевины и креатинина. Печень несколько увеличена, болезненная. Возрастает количество связанного и свободного билирубина, выявляют повышение активности альдолазы и аминотрансфераз. Содержание лейкоцитов снижается до 1,5–2,5×109 в литре крови; возникают нейтропения и лимфопения. Замедляется свёртывание крови, возрастает СОЭ. Указанные изменения наиболее выражены на 6–7-е сутки заболевания — критический период для больного. При благоприятном течении заболевания с 8–9-х суток общее состояние больных постепенно улучшается. Происходит нормализация клинических и лабораторных показателей. Астения сохраняется в течение недели. Возможны также субклинические формы течения заболевания. Диагноз устанавливают ретроспективно с использованием серологических методов исследования.
Осложнения. К специфическим осложнениям относят ИТШ, органическое поражение мозга, миокардит, гангрену мягких тканей и конечностей. В случаях присоединения вторичной инфекции возможно развитие пневмонии, паротита, сепсиса.
Диагностика. Клиническая диагностика. Диагностику у большинства больных основывают на характерных клинических проявлениях (типичная седловидная температурная кривая, выраженные симптомы геморрагического диатеза, поражение почек, желтуха, увеличение печени и селезёнки, брадикардия и др.). При этом учитывают наличие эндемического очага; видовой состав и численность, активность нападения на человека и другие характеристики переносчиков; а также данные лабораторного исследования (лейкопению, нейтропению, лимфоцитопению, значительную альбуминурию, гематурию, билирубинемию, азотемию, значительное повышение активности аминотрансфераз). Специфическая и неспецифическая лабораторная диагностика. Специфическую диагностику основывают на постановке реакции связывания комплемента, РПГА, неспецифической РИФ, ИФА и РТГА в парных сыворотках. Результат считают положительным при четырёхкратном повышении титра антител. Рекомендуемые вирусологические тесты: РН вируса и выделение вируса. Возбудитель выделяют из крови больного в течение первых 3 сут течения заболевания путём заражения белых мышей и обезьян, поэтому при летальных исходах забор секционного материала необходимо проводить как можно быстрее. Обычно берут пробу печени, из которой готовят суспензию и после обработки антибиотиками немедленно вводят мышам в мозг или обезьянам парентерально. Если у мышей не выявили клинических проявлений заболевания, проводят один слепой пассаж. С появлением признаков заболевания у мышей проводят несколько (3–5) дополнительных пассажей, после чего из мозгового вещества инфицированных животных готовят антиген, с помощью которого проводят идентификацию выделенного вируса в серологических реакциях (РТГА, РСК) или РН со специфической антисывороткой. При летальном исходе исследуют ткани печени, где выявляют очаги субмассивного или массивного некроза печёночных долек и ацидофильные тельца Каунсилмена.
Лечение. Специфического лечения не разработано. Применение сыворотки крови переболевших людей и естественно иммунизированных обезьян оказалось неэффективным. Все лечебные мероприятия сводят к использованию патогенетических ЛС. При лёгкой и среднетяжёлой формах заболевания назначают строгий постельный режим, тщательный уход, щадящую диету, обильное питьё; по показаниям — различные химиопрепараты. Больным с тяжёлой формой заболевания проводят интенсивное лечение. Назначают кардиотропные ЛС, переливание крови и кровезаменяющих жидкостей. При поражении почек показан гемодиализ. Рекомендации по применению гепарина и кортикостероидов основывают только на теоретических данных; контролируемых исследований не проводили.
Профилактика. Специфическая. Иммунизация населения: две живые вакцины (вакцина на основе штамма 17Д, полученного при длительном пассировании вируса в культуре клеток. Меньшее распространение получила вакцина, созданная на основе адаптированного серийными пассажами на мышах штамма Дакар). У этого штамма выражена остаточная вирулентность, поэтому при проведении прививки сначала вводят иммунную сыворотку человека. Вакцина на основе штамма 17Д весьма эффективна. Ревакцинацию следует проводить 1 раз в 10 лет. Необходимо обязательно учитывать все случаи заболевания. Лицам, направляющимся в зону, эндемичную для данного заболевания, и выбывающим из нее необходимо сделать прививку. Для предупреждения распространения комаров самолёты и корабли, посещающие эндемичные для жёлтой лихорадки местности или места распространения A. aegypti, подвергают обязательной дезинсекции. Большое значение имеет выявление первых случаев заболевания. По рекомендации ВОЗ его следует предполагать при выявлении случаев острой лихорадки с развитием желтухи в течение 2 нед после начала заболевания, сопровождающейся кровотечениями или смертью в течение 3 нед. Неспецифическая. Как показал опыт практической работы в эндемичных очагах, в большинстве случаев достаточно существенно снизить численность популяции переносчиков — существует так называемая их критическая плотность, при которой цикл передачи возбудителей полностью прерывается. Полную ликвидацию переносчиков в определённых районах не проводят не только из-за экономической нецелесообразности и административных проблем, но и по причине опасности возникновения необратимых изменений существующих биоценотических связей. Для достижения быстрого эффекта уничтожения взрослых особей насекомых используют химические инсектициды. Наибольшее распространение получили фосфорорганические соединения, в частности малатион. Не менее успешным может быть уничтожение комаров с помощью различных препаратов группы пиретроидов. Их эффективность по сравнению с фосфорорганическими инсектицидами выше примерно на два порядка. В последние годы получили распространение препараты, приготовленные на основе культур Вас. thuringiensis, применяемые для уничтожения комаров на личиночной стадии развития. Существуют специальные методы зашиты человека от укусов комарами — сетки, закрывающие обнажённые участки тела (особенно голову и шею) или кровать. Сетки, одежду и отдельные участки тела следует обрабатывать репеллентами. Для предупреждения распространения возбудителя необходимо принимать меры по предотвращению контакта больного человека с переносчиками.
30. Лихорадка Ласса: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Геморрагическая лихорадка Ласса — острое антропозоонозное природно-очаговое вирусное заболевание, характеризующееся развитием геморрагического синдрома, язвенно-некротического фарингита, пневмонии, миокардита, поражением почек и высоким уровнем летальности. Синоним — Ласса лихорадка.
Этиология. Возбудитель — Lassa virus рода Arenavirus семейства Arenaviridae; относят к комплексу аренавирусов Старого Света LChM/Lassa. Имеет антигенное родство с другими аренавирусами (возбудителями лимфоцитарного хориоменингита и ГЛ Южной Америки). Вирус имеет капсид сферической формы, покрыт липидной оболочкой, включающей гликопротеины (G1 и G2). Нуклеокапсид состоит из белка (N) и РНК, два фрагмента которой (L и S) кодируют синтез компонентов вириона в инфицированной клетке; гемагглютининов нет. Патогенен для некоторых видов обезьян, белых мышей, морских свинок. В культуре клеток Vero репликация вируса сопровождается цитопатическим эффектом. Устойчив к воздействию факторов окружающей среды. Инфекционность вируса в сыворотке крови и слизистых секретах без специальной обработки не снижается в течение длительного времени. Вирус можно инактивировать жировыми растворителями (эфир, хлороформ и др.).
Эпидемиология. Источник и резервуар возбудителя — крыса Mastomys natalensis, обитающая в большинстве стран Африки вблизи жилья человека. Вирус также выделен и от других африканских грызунов (M. erythroleucus, M. huberti). Животные выделяют вирус в окружающую среду с экскретами и слюной. Механизмы передачи возбудителя: аэрозольный, фекально-оральный, контактный. Пути передачи: воздушно-капельный, пищевой, водный, контактный. Факторы передачи: пищевые продукты, вода, а также предметы, загрязнённые мочой грызунов. Заражение людей в природных очагах может происходить при вдыхании аэрозоля, содержащего экскреты грызунов; употреблении воды из инфицированных источников; недостаточно термически обработанного мяса заражённых животных. Больной человек представляет большую опасность для окружающих. Основной фактор передачи — кровь, однако вирус содержится и в экскретах больного. Заражение при этом происходит воздушно-капельным, контактным и половым путями. Выделение вируса больными может продолжаться до месяца и более. Заражение происходит через микротравмы при попадании на кожу крови или выделений больного. Зарегистрированы случаи заболеваний медицинского персонала при использовании инструментов, контаминированных возбудителем, проведении хирургических операций и вскрытии трупов. Восприимчивость высокая. К возбудителю чувствительны все группы населения независимо от возраста и пола. Постинфекционный иммунитет напряжённый и длительный, повторные случаи заболевания не описаны. В эндемичных районах антитела выявляют у 10–15% населения, что свидетельствует о возможности бессимптомного или лёгкого течения заболевания. Особенность эпидемического процесса в том, что передача возбудителя от человека человеку аэрогенным путём ведёт к появлению вторичных внутрисемейных вспышек, а также к возникновению нозокомиальных вспышек, сопровождающихся высокой летальностью. Кроме того, возможен завоз лихорадки Ласса в неэндемичные страны и возникновения там очага заболевания при контактной передаче возбудителя. Лихорадка Ласса распространена в странах Западной и Центральной Африки, южнее Сахары (Нигерия, Сьерра-Леоне, Гвинея, Либерия, Мозамбик, Сенегал, Мали и др.). Сезонность не выражена, заболеваемость постоянная
Патогенез. Входные ворота для возбудителя — слизистые оболочки органов дыхания и пищеварения, повреждённая кожа. В месте внедрения вируса после его первичной репликации в лимфоидных элементах развивается вирусемия с гематогенной диссеминацией возбудителя, поражением многих органов и систем. Вирус обладает тропностью к различным системам органов человека и вызывает некротические изменения в клетках печени, миокарда, почек, эндотелия мелких сосудов, что и определяет течение заболевания. В тяжёлых случаях вследствие цитопатического эффекта вируса и клеточных иммунных реакций повреждение эндотелиальных клеток в сочетании с нарушением функций тромбоцитов приводит к повышенной «ломкости» и проницаемости сосудистой стенки. Возникают глубокие расстройства гемостаза с развитием синдрома диссеминированного внутрисосудистого свёртывания и коагулопатии потребления.
Клиника. Инкубационный период длится 3–20 сут, чаще 7–14 сут. Начало заболевания подострое или постепенное. Выявляют общее недомогание, умеренные мышечные и головные боли, невысокую лихорадку, конъюнктивит. В этот период у большинства больных (80%) возникает характерное поражение зева в виде язвенно-некротического фарингита, а также увеличение шейных лимфатических узлов. К концу первой недели течения заболевания температура тела достигает 39–40 °С; нарастают симптомы интоксикации; присоединяются тошнота, рвота, боли в грудной клетке и животе; развивается диарея, приводящая к дегидратации. Со второй недели возможно появление пятнисто-папулёзной сыпи; выявляют геморрагические проявления (подкожные кровоизлияния, носовые, лёгочные, маточные и другие кровотечения). Возникает брадикардия, артериальная гипотензия; возможно снижение слуха, появление судорог и очаговых неврологических клинических проявлений. При неблагоприятном течении заболевания возникает отёчность лица и шеи, выявляют свободную жидкость в плевральной и брюшной полостях, нарастает геморрагический синдром. В тяжёлых случаях смерть наступает на 7–14-е сутки. У выживших больных через 2–4 нед температура тела литически снижается. Выздоровление медленное. В течение нескольких недель сохраняется общая слабость, в ряде случаев происходит выпадение волос и развивается глухота; возможны рецидивы заболевания.
Осложнения. Пневмония, миокардит, ОПН, шок, острый психоз.
Диагностика. Клиническая диагностика Ранняя клиническая диагностика лихорадки Ласса затруднена из-за отсутствия специфических симптомов заболевания. Из клинических проявлений наибольшее диагностическое значение имеют: подострое начало; сочетание лихорадки, язвенного фарингита, геморрагического синдрома и почечной недостаточности. Большое значение имеют эпидемиологические данные (пребывание в эпидемическом очаге) в совокупности с результатами вирусологических и серологических исследований. Специфическая и неспецифическая лабораторная диагностика Подтверждение диагноза лихорадки Ласса проводят вирусологическими и серологическими методами в специальных лабораториях с IV уровнем биологической безопасности. Абсолютный диагностический признак заболевания — выделение вируса из крови, смыва с зева, слюны, мочи и экссудатов (плевральных, перикардиальных, перитонеальных) больного; а также от умерших — из проб внутренних органов. Эффективные методы диагностики: ИФА и РНИФ. Диагноз подтверждают серологически (при возрастании титров антител к вирусу Ласса в 4 раза и больше). Постановка реакции связывания комплемента имеет ретроспективное значение. Неспецифическая лабораторная диагностика включает проведение общего анализа крови (выявляют лейкопению со сменой на лейкоцитоз, сдвиг нейтрофильной формулы влево, тромбоцитопению, повышенную СОЭ); биохимического анализа крови (характерна гипопротеинемия; повышение активности аминотрансфераз, азотемия); определение коагулограммы (характерна гипокоагуляция) и кислотно-основного состояния крови (выражены признаки декомпенсированного ацидоза); общего анализа мочи (выявляют протеинурию, гематурию, цилиндрурию).
Лечение. Больной нуждается в строгом постельном режиме и круглосуточном медицинском наблюдении. Предпочтительна диета из полужидкой легкоусвояемой пищи без ограничения количества белков и поваренной соли, что соответствует столу № 4 по Певзнеру. Медикаментозное лечение Противовирусное лечение проводят внутривенным введением рибавирина в течение 10 сут (начальная доза препарата — 2 г, затем вводят по 1 г каждые 6 ч в течение 4 сут и по 0,5 г каждые 8 ч в последующие 6 сут). В ранние сроки течения заболевания в ряде эндемичных регионов применяют плазму реконвалесцентов. Патогенетическое лечение направлено на борьбу с шоком, геморрагическим синдромом, сердечной и ДН, а также на проведение дезинтоксикационных мероприятий и инфузионной регидратации солевыми растворами. Антибиотики применяют при бактериальных осложнениях.
Профилактика. Специфическая профилактика не разработана. Неспецифическая профилактика состоит в защите помещений от проникновения грызунов и дератизационных мероприятиях в природных очагах. Медицинский персонал должен быть обучен уходу за контагиозными больными и обязан работать в защитной одежде, респираторах или марлевых масках, перчатках, очках. Рекомендована строгая изоляция больных (желательно в специальные пластиковые или стеклянно-металлические кабины с автономным жизнеобеспечением) на срок не менее 30 сут от начала заболевания. Наблюдение за лицами, контактировавшими с больными, продолжают в течение 17 сут. Проводят заключительную дезинфекцию. Для экстренной профилактики лихорадки Ласса применяют рибавирин (внутрь по 0,2 г 4 раза в сутки в течение 10 сут). Проводят карантинные мероприятия в отношении лихорадящих больных, прибывших из стран Центральной и Западной Африки.
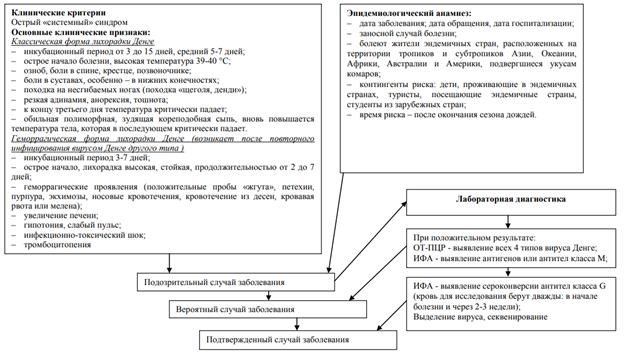
31. Лихорадка Денге: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Лихорадка денге — острая зооантропонозная арбовирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, распространённая в странах тропического и субтропического пояса. Различают две клинические формы болезни: классическую и геморрагическую (шоковый синдром денге). Классическая лихорадка денге (синонимы — денге, костоломная лихорадка) характеризуется двухволновой лихорадкой, артралгией, миалгией, экзантемой, полиаденитом, лейкопенией и доброкачественным течением болезни. Геморрагическая лихорадка денге (ГЛД, ferbis hemorragica dengue, синоним — шоковый синдром денге) характеризуется развитием тромбогеморрагического синдрома, шока и высокой летальностью.
Этиология. Возбудитель денге относится к арбовирусам, роду Flavivirus, семейству Feaviviridae. Геном представлен однонитевой РНК. Имеет дополнительную суперкапсидную оболочку, с которой связаны антигенные и гемагглютинирующие свойства. Устойчивость в окружающей среде средняя, хорошо сохраняется при низких температурах (–70 °С) и в высушенном состоянии; чувствителен к формалину и эфиру, инактивируется при обработке протеолитическими ферментами и при нагревании до 60 °С. Известны четыре антигенных серотипа вируса денге: DEN I, DEN II, DEN III, DEN IV. Вирус денге передаётся человеку через укусы комаров и поэтому входит в экологическую группу арбовирусов. Выраженной зависимости клинической картины от серотипа вируса не установлено. Вирус обладает слабой цитопатической активностью. Его репликация происходит в цитоплазме поражённых клеток. У обезьян он вызывает бессимптомную инфекцию с формированием прочного иммунитета. Вирус патогенен для новорождённых белых мышей при заражении в мозг или внутрибрюшинно. Вирус размножается в культурах тканей почек обезьян, хомячков, яичек обезьян, а также на линиях клеток HeLa, КВ и кожи человека.
Эпидемиология. Источник возбудителя инфекции — больной человек и обезьяны, у которых заболевание может протекать латентно. В эндемичных регионах существуют природные очаги болезни, в которых циркуляция вируса происходит между обезьянами, лемурами, белками, летучими мышами и, возможно, другими млекопитающими. Переносчики — комары рода Aedes (A. aegypti, A. albopictus, A. cutellaris, A. polinesiensis), возможно, определённая роль принадлежит комарам родов Anopheles и Culex. Комары рода Aedes после кровососания становятся заразными через 8–12 дней в зависимости от температурных условий. Их способность к заражению сохраняется в течение жизни, т.е. 1–3 мес, однако при температуре воздуха ниже 22 °С размножения вируса в организме комара не происходит, поэтому ареал денге меньше ареала комаров-переносчиков. Заражение человека в эндемичных регионах привело к формированию стойких антропургических очагов инфекции независимо от природных условий. В этих очагах источник возбудителя — больной человек, который становится заразным почти за сутки до начала болезни и остаётся заразным в течение первых 3–5 дней болезни. Основной переносчик возбудителя в человеческой популяции — комар A. aeguti, обитающий в жилище человека. Самка комара кусает человека днём. Комар наиболее активен при температуре 25–28 °С, при этой же температуре его численность достигает максимума, а сроки заразительности после кровососания минимальны. Человек высоковосприимчив к лихорадке денге, заражение происходит даже при однократном укусе комаром. У человека каждый из четырёх типов вируса способен вызывать классическую форму лихорадки денге и ГЛД. Иммунитет после перенесённой болезни кратковременный, длится несколько лет, типоспецифический, поэтому после перенесённой болезни человек остаётся восприимчивым к другим серотипам вируса. Крупные эпидемии всегда связаны с заносом типа вируса, не свойственного данному региону или в регионы (страны), где отсутствует эндемическая заболеваемость. Эпидемиология классической лихорадки денге и ГЛД существенно различается. Классическую денге наблюдают среди местных жителей, преимущественно детей и приезжих любого возраста, а ГЛД заболевают главным образом дети. Пики заболеваемости приходятся на две возрастные группы: до 1 года, имеющие пассивный иммунитет против вируса другого типа, и дети 3-летнего возраста, переболевшие классической денге. В первой группе формируется иммунный ответ по типу первичного, во второй — по типу вторичного. Тяжёлая форма ГЛД — шоковый синдром денге чаще всего развивается при заражении вторым типом вируса при инфицировании детей, перенёсших в прошлом денге, вызванную вирусами I, III или IV типа. Так, во время эпидемии на Кубе в 1981 г. было установлено, что у более 98% больных тяжёлое течение болезни и шоковый синдром денге были связаны с заражением вирусом II типа при наличии антител к вирусу I типа.
Патогенез. При «классической» лихорадке денге (DF) первичная репликация DENV происходит в регионарных лимфатических узлах и клетках эндотелия сосудов. В конце инкубационного периода развивается вирусемия, клинически проявляющаяся симптомами интоксикации и поражением различных органов и систем. Повторная волна лихорадки связана с органными поражениями (при DHF/DSS лихорадка однофазная). При выздоровлении в крови накапливаются комплементсвязывающие и вируснейтрализующие антитела, сохраняющихся несколько лет. Патогенез DHF/DSS недостаточно изучен. В литературе широко обсуждается вирусная и иммунологическая гипотеза патогенеза денге, протекающей с геморрагическим синдромом, тромбоцитопенией, плазмопотерей и органными поражениями. По мнению приверженцев вирусной гипотезы, генетические и структурные различия DENV, способствующие вирусной изменчивости, ответственны за развитие тяжелой денге. Исследования de Borba L. et al. (2012) доказали, что мутации в белках Е и NS3 усиливают репликацию и вирулентность DENV. Однако критический период лихорадки денге наблюдается не на пике виремии, а, как правило, в период снижения вирусной нагрузки. Поэтому многие исследователи считают, что ведущая роль в патогенезе лихорадки денге принадлежит иммунологическим факторам: адаптивному иммунному ответу, медиаторам воспаления и аутоиммунитету. Антителозависимая активация является хорошо известным звеном патогенеза лихорадки денге. В большинстве случаев DHF развивается при заражении другим серотипом вируса при сохраняющихся в крови антителах к предыдущему серотипу вируса (первые 1-4 года после болезни), т.к. имеющие в крови больного гетерологичные антитела не могут нейтрализовать другой вирус. При заражении другим серотипом DENV предшествующие IgG-антитела взаимодействуют с FcγR, рецепторами мембраны моноцитов и макрофагов, обеспечивая активное его проникновение в клетку. Согласно новой гипотезе внутренней антителозависимой активации FcγR-опосредованное проникновение DENV в клетку подавляет врожденный иммунитет, повышает синтез ИЛ-10 и инициирует переключение иммунного ответа с Th1 на Th2, способствует увеличению вирусной нагрузки и синтезу субнейтрализующих антител. Массивная репликация вируса и высвобождение вирусных антигенов на фоне вторичного иммунного ответа способствуют образованию иммунных комплексов, усилению альтернативного пути активации комплимента с увеличением содержания С3а и С5а, активации кининовой системы, повышению продукции лимфокинов (sTNFR, TNFα, IL-8, IFN-γ и др.). Вследствие этого развивается апоптоз эндотелиоцитов с последующим увеличением проницаемости сосудистой стенки, потерей плазмы и геморрагиями. Прогрессированию геморрагического синдрома способствует тромбоцитопения, развивающаяся вследствие нарушения продукции тромбоцитов в костном мозге и образования дефектных тромбоцитов. Немаловажную роль в патогенезе денге играет выработка аутоантител к тромбоцитам, эндотелиальным клеткам, факторам свертывания крови и молекулярная мимикрия между клетками больного и белками NS1, prM, E DENV, приводящая к перекрестной реактивности антител anti-NS1, anti-prM и anti-E с последующей дисфункцией тромбоцитов, апоптозом эпителиальных клеток, нарушением свертывания и макрофагальной активацией.
Клиника. Инфицирование вирусом денге может быть бессимптомным, а также протекать как недифференцируемая лихорадка, лихорадка денге или ГЛД. В клинически выраженных случаях инкубационный период длится от 3 до 15 дней, чаще 5–8 дней. Различают классическую, атипичную ГЛД (без шокового синдрома денге и сопровождающегося им). Классическая лихорадка денге начинается с кратковременного продромального периода. Во время него отмечают недомогание, конъюнктивит и ринит. Однако чаще продромальный период отсутствует. Болезнь начинается с озноба, быстрого повышения температуры до 38–41 °С, сохраняющейся в течение 3–4 дней (начальный период болезни). Больные жалуются на сильную головную боль, боли в глазных яблоках, особенно при движении, мышцах, крупных суставах, позвоночнике, нижних конечностях. Это приводит к затруднению при любом движении, обездвиживает больного (название болезни происходит от английского «dandy» — медицинские носилки). При тяжёлом течении болезни наряду с сильной головной болью возможны рвота, бред, потеря сознания. Нарушается сон, ухудшается аппетит, во рту появляется горечь, резко выражена слабость и общее недомогание. Уже с первого дня болезни изменяется внешний вид больного: лицо ярко гиперемировано, выражена инъекция сосудов склер, гиперемия конъюнктивы. Часто на мягком нёбе появляется энантема. Язык обложен. Глаза прикрыты из-за светобоязни. Отмечают увеличение печени, однако желтухи не наблюдают. Характерно увеличение периферических лимфатических узлов. К концу 3-х суток или на 4-е сутки температура критически снижается до нормальной. Период апирексии длится обычно 1–3 дня, затем температура повышается вновь до высоких цифр. У некоторых больных периода апирексии в разгар болезни не наблюдают. Характерный симптом — экзантема. Сыпь появляется обычно на 5–6-й день болезни, иногда раньше, сначала на грудной клетке, внутренней поверхности плеч, затем распространяется на туловище и конечности. Характерна пятнисто-папулёзная сыпь, которая часто сопровождается зудом, оставляет после себя шелушение. Общая продолжительность лихорадки — 5–9 дней. В гемограмме в начальном периоде — умеренный лейкоцитоз и нейтрофилёз, позже — лейкопения, лимфоцитоз. Возможна протеинурия. При атипичной лихорадке денге наблюдают лихорадку, анорексию, головную боль, миалгию, эфемерную сыпь, полиаденопатия отсутствует. Длительность болезни не превышает 3 сут. Клиника геморрагической лихорадки денге Типичные случаи ГЛД характеризуются четырьмя главными клиническими признаками: высокой температурой, геморрагиями, гепатомегалией и недостаточностью кровообращения. Болезнь начинается с внезапного повышения температуры тела до 39–40 °С, сильного озноба, головной боли, кашля, явлений фарингита. В отличие от классической денге миалгию и артралгию наблюдают редко. В тяжёлых случаях быстро развивается прострация. Характерна выраженная гиперемия и одутловатость лица, блеск глаз, гиперемия всех видимых оболочек. Нередко отмечают скарлатиноподобное покраснение всего тела, на фоне которого появляется точечная сыпь, в основном на разгибательных поверхностях локтевых и коленных суставов. В последующие 3–5 дней болезни появляется кореподобная пятнисто-папулёзная или скарлатиноподобная сыпь на туловище, а затем — на конечностях и лице. Отмечают боли в эпигастральной области или по всему животу, сопровождающиеся многократной рвотой. Печень болезненна, увеличена. Через 2–7 дней температура тела часто снижается до нормального или пониженного уровня, проявления болезни могут регрессировать, наступает выздоровление. При тяжёлом течении состояние пациента ухудшается. Самый частый геморрагический признак — положительный тест со жгутом (у большинства больных возникают кровоподтеки в местах инъекций). На коже появляются петехии, подкожные кровоизлияния, кровотечения. Значительно снижается количество тромбоцитов, показатель гематокрита повышается на 20% и более. Характерно развитие гиповолемического шока. ВОЗ предлагает следующую классификацию ГЛД 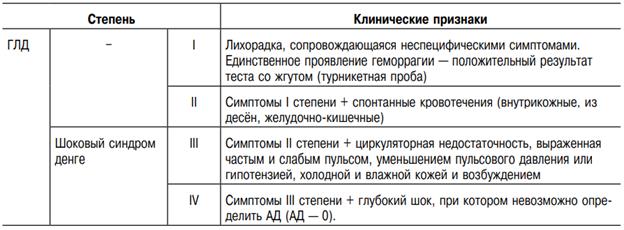
В тяжёлых случаях после нескольких дней высокой температуры состояние больного внезапно ухудшается. Во время падения температуры (между 3 и 7-м днём болезни) появляются признаки нарушения кровообращения: кожа становится холодной, одутловатой, покрывается пятнами, часто отмечают цианоз кожи вокруг рта и учащение пульса. Пульс частый, больные беспокойны, жалуются на боль в животе. Некоторые больные заторможены, однако затем у них развивается возбуждение, после чего наступает критическая стадия шока. Состояние прогрессивно ухудшается. В области лба и дистальных отделов конечностей появляется петехиальная сыпь, АД резко снижается, уменьшается его амплитуда, пульс нитевидный, усиливаются тахикардия и одышка. Кожа холодная, влажная, нарастает цианоз. На 5–6-й день возникает кровавая рвота, мелена, судороги. Продолжительность шока невелика. Больной может умереть в течение 12–24 ч или быстро выздоравливает после соответствующих противошоковых мероприятий. Выздоровление при ГЛД с шоком или без шока наступает быстро и протекает без осложнений. Благоприятный прогностический признак — восстановление аппетита. При исследовании крови выявляют тромбоцитопению, высокий показатель гематокрита, удлинение протромбинового (у одной трети пациентов) и тромбопластинового времени (у половины больных), гемофибриногенемию, появление в крови продуктов деградации фибрина, метаболический ацидоз. Почти всегда отмечают гемоконцентрацию (свидетельствует о потере плазмы), даже у больных без шока. Число лейкоцитов варьирует от лейкопении до небольшого лейкоцитоза. Часто выявляют лимфоцитоз с атипичными лимфоцитами. У некоторых больных лихорадкой денге и ГЛД наблюдают признаки поражения ЦНС, такие, как судороги, спазмы и длительное (более 8 ч) нарушение сознания.
Осложнения. К числу осложнений относят шок, пневмонию, энцефалит, менингит, психоз, полиневрит.
Диагностика.
Лечение. Этиотропных средств нет. Высокая температура и рвота вызывают жажду и обезвоживание организма, поэтому больные должны пить как можно больше жидкости. При ГЛД без шока проводят регидратационную терапию, преимущественно пероральную. За больными необходимо тщательно наблюдать для выявления ранних признаков шока. Больных немедленно следует госпитализировать при наличии любого из приведенных ниже признаков и симптомов шока: G возбуждение или заторможенность; G холодные конечности и цианоз вокруг рта; G учащённый слабый пульс; G снижение пульсового давления или гипотензия; G резкое увеличение гематокрита. Повышение гематокрита, развитие ацидоза — показания к парентеральному введению щёлочных и полиионных растворов. При шоке показано введение плазмы или плазмозаменителей. В большинстве случаев необходимо вводить не более 20–30 мл плазмы на 1 кг массы тела. Введение жидкости следует продолжать с постоянной скоростью (10–20 мл/кг в ч) до явного улучшения дыхания, пульса и температуры. В качестве заменителя плазмы эффективен декстран 40. Показана оксигенотерапия. Эффективность глюкокортикоидов, гепарина сомнительна. Заместительную терапию прекращают при снижении гематокрита до 40%. Переливание крови не показано. Антибиотики назначают в случае присоединения бактериальных осложнений. При благоприятных условиях наступает полное выздоровление
Профилактика. Уничтожение комаров и обезвреживание мест локализации их потомства. Используют индивидуальные средства защиты от комаров. Засетчивание оконных и дверных проёмов. В случаях экстренной профилактики применяют специфический иммуноглобулин или иммуноглобулин из плазмы доноров, проживающих в эндемичных районах. Вакцины разрабатываются.
32. Болезнь Марбург: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Геморрагическая лихорадка Марбург — острое антропозоонозное высоколетальное вирусное заболевание, проявляющееся интоксикацией, выраженными явлениями универсального капилляротоксикоза. Синонимы: лихорадка геморрагическая церкопитековая, болезнь зелёных мартышек, болезнь Марбург-вирусная, геморрагическая лихорадка Мариди.
Этиология. Возбудитель — Marburgvirus рода Marburgvirus семейства Filoviridae. Вирусные частицы полиморфные (нитевидной, спиралевидной или округлой формы). Содержат негативную однонитевую РНК, липопротеин. В состав вириона входит 7 белков. Белковый состав вируса Марбург близок к родственному ему филовирусу Эбола, но имеет некоторые отличия. Считают, что штаммоспецифические антигены сосредоточены в области белка Gp, а группоспецифический антиген — в области белка Np. Гемагглютининов и гемолизинов не выявлено. Вирус выделяют и пассируют in vitro в перевиваемых культурах клеток почки зелёной мартышки (Verо) и in vivo на морских свинках. Репликация происходит в цитоплазме поражённых клеток. Вирус обладает средней устойчивостью к факторам внешней среды.
Эпидемиология. Резервуар вируса Марбург в настоящее время достоверно не установлен. Источник возбудителя — обезьяны, в частности африканские мартышки Cercopithecus aethiops. Механизмы передачи возбудителя: аэрозольный, контактный, артифициальный. Пути передачи: воздушно-капельный, контактный, инъекционный. Вирус содержится в крови, носоглоточной слизи, моче и сперме (до 3 мес). Заражение людей происходит при прямом контакте с кровью и органами обезьян, также через повреждённую кожу (при уколах, порезах), при попадании вируса на конъюнктивы. Больной человек контагиозен для окружающих. Описан случай передачи возбудителя половым путём. Восприимчивость людей к вирусу Марбург высокая. Постинфекционный иммунитет длительный. Сведения о повторных заболеваниях отсутствуют. Ареал распространения вируса — центральная и западная территории Экваториальной Африки, а также юг континента (Центрально-Африканская республика, Габон, Судан, Заир, Либерия, Кения, Родезия, Гвинея, Южно-Африканская Республика). Сезонность и периодичность вспышек не выявлены.
Патогенез. Входные ворота — повреждённая кожа, слизистые оболочки ротовой полости и глаз. Первичная репликация вируса происходит в клетках моноцитарно-макрофагальной линии. Затем развивается вирусемия, сопровождаемая подавлением функций иммунной системы и генерализованными нарушениями микроциркуляции, что приводит к возникновению синдрома диссеминированного внутрисосудистого свёртывания и полиорганных поражений. В лёгких, миокарде, почках, печени, селезёнке, надпочечниках и других органах обнаруживают очаги некрозов и кровоизлияний.
Клиника. Инкубационный период 3–16 сут. Начало заболевания острое: высокая лихорадка в течение 2 нед, выраженная интоксикация, головная боль, миалгии, боли в пояснично-крестцовой области. При осмотре выявляют конъюнктивит, энантему, везикулёзно-эрозивные изменения слизистой оболочки ротовой полости, брадикардию. Тонус мышц повышен, пальпация их болезненна. С 3–4-х суток течения заболевания возникают рвота и водянистая диарея, приводящие к быстрому обезвоживанию организма. На 5–6-е сутки возможно появление макулопапулёзной сыпи с последующим шелушением кожи. С 6–7-х суток выявляют геморрагические проявления в виде кожных геморрагий, носовых, желудочно-кишечных и других кровотечений, а также признаки гепатита, миокардит, поражение почек. Для поражения ЦНС характерны адинамия, заторможенность и менингизм. В конце первой недели выявляют признаки ИТШ, дегидратации. Ухудшение состояния больных наступает на 8–10-е сутки и на 15–17-е сутки течения заболевания (иногда заканчивающееся летально). В период реконвалесценции, продолжающейся 3–4 нед, возможно появление длительной диареи, выраженной астенизации, психических расстройств и облысения.
Осложнения. Гепатит, миокардит, орхит с атрофией яичка, шок, поперечный миелит, увеит; реже — пневмония и психозы. ИТШ, ДВС.
Диагностика. Клиническая: специфические признаки отсутствуют. Специфическая лабораторная диагностика: осуществляют с использованием тех же вирусологических и серологических методов (выделение культуры вируса, ПЦР, РНИФ, ИФА, РН, РСК и др.), что и при лихорадке Эбола. У умерших вирус обнаруживают при электронной микроскопии или с помощью РНИФ. Все исследования проводят в лаборатории с максимальным уровнем защиты. Неспецифическая лабораторная диагностика: Включает общий анализ крови (выявляют анемию, анизоцитоз, пойкилоцитоз, базофильную зернистость эритроцитов, лейкопению, сдвиг нейтрофильной формулы влево, атипичные лимфоциты, тромбоцитопению); биохимический анализ крови (повышена активность трансфераз, амилазы, азотемия); определение коагулограммы (выражена гипокоагуляция) и кислотно-основного состояния крови (обнаруживают признаки декомпенсированного метаболического ацидоза); общий анализ мочи (характерна протеинурия). Инструментальные методы: Рентгенография органов грудной клетки, ЭКГ, УЗИ.
Лечение. Больной нуждается в строгом постельном режиме и круглосуточном медицинском наблюдении. Диета соответствует столу № 4 по Певзнеру без ограничения количества белков и поваренной соли (NaCl). Этиотропное лечение: рибавирин. Патогенетическое лечение: Имеет основное значение. Направлено на борьбу с обезвоживанием, ИТШ, геморрагическим синдромом. Есть данные об эффективности сыворотки реконвалесцентов, плазмафереза и больших доз интерферона
Профилактика. Состоит в выявлении больных и изоляции их в боксах, перевозке больных в транспортных изоляторах, использовании индивидуальных средств личной защиты от заражения при работе с больными, выполнении рекомендаций ВОЗ по завозу обезьян и работе с ними. Для экстренной профилактики развития лихорадки Марбург применяют специфический иммуноглобулин.
33. Лихорадка Эбола: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Геморрагическая лихорадка Эбола — острое вирусное антропонозное особо опасное инфекционное заболевание, характеризующееся тяжёлым течением, выраженным геморрагическим синдромом и высоким уровнем летальности. Синоним — лихорадка Эбола.
Этиология. Возбудитель — Ebolavirus рода Marburgvirus семейства Filoviridae — один из самых крупных вирусов. Вирион имеет различную форму — нитевидную, ветвящуюся, паукообразную. Геном представлен односпиральной негативной РНК, окружённой липопротеиновой мембраной. В состав вируса входит 7 белков. Вирусы Эбола и Марбург сходны по своей морфологии, но отличаются по антигенной структуре. По антигенным свойствам гликопротеинов (Gp) выделяют четыре серотипа вируса Эбола, три из них вызывают различные по тяжести заболевания у людей в Африке (Ebola-Zaire — EBO-Z, Ebola-Sudan — EBO-S и Ebola-Ivory Coast — EBO-CI). Манифестные случаи заболевания Ebola-Reston virus (EBO-R), высокопатогенного для обезьян, у человека не выявлены. Вирус отличается высокой изменчивостью. Пассируют в культуре клеток морских свинок и Verо со слабо выраженным цитопатическим эффектом. Ebolavirus обладает средним уровнем устойчивости к повреждающим факторам внешней среды (рН среды, влажность, инсоляция и т.д.).
Эпидемиология. Резервуар вируса — грызуны, обитающие возле жилья человека. Описаны случаи заражения при вскрытии трупов диких шимпанзе и при употреблении в пищу мозга обезьян. Больной человек представляет большую опасность для окружающих. Механизмы передачи возбудителя: аспирационный, контактный, артифициальный. Пути передачи: воздушно-капельный, контактный, инъекционный. Вирус обнаруживают в крови, слюне, носоглоточной слизи, моче, сперме. Заражение людей происходит при уходе за больными; в бытовых условиях через руки и предметы обихода, загрязнённые кровью и мочой больного; через медицинские инструменты и, возможно, половым путём. Риск внутрисемейного заражения составляет 3–17%, при нозокомиальной форме — более 50%. Описана передача вируса от человека к человеку в 5 генерациях, причём в первых генерациях летальность достигает 100%. Восприимчивость людей к вирусу Эбола высокая; не зависит от возраста и пола. Постинфекционный иммунитет относительно устойчивый. Повторные случаи заболевания редки (выявлено не более 5% реконвалесцентов). В эндемичных районах у 7–10% населения выявляют антитела к вирусу Эбола, что свидетельствует о возможности развития субклинических или стёртых форм заболевания. Ареал распространения вируса — Центральная и Западная Африка. Вспышки возникают в основном весной и летом.
Патогенез. Вопросы патогенеза БВВЭ остаются до конца не изученными. Входными воротами для инфекции могут служить слизистые оболочки, участки с поврежденной кожей, а также к заражению могут приводить парентеральные вмешательства. Вирус поражает несколько типов клеток, в том числе моноциты, макрофаги, дендритные клетки, эндотелиальные клетки, фибробласты, гепатоциты, клетки коры надпочечников и эпителиальные клетки. Длительность инкубационного периода может зависеть от пути передачи (6 дней при парентеральном инфицировании и 10 дней при контакте). Наибольшие изменения происходят в печени, селезёнке, лимфоидных образованиях, почках, железах внутренней секреции, головном мозге. При попадании в организм человека вирус мигрирует в региональные лимфатические узлы, а затем в печень, селезенку и надпочечников. Развивается гепатоцеллюлярной некроз, что приводит к нарушению синтеза и регуляции факторов свертывания крови и развитию последующей коагулопатии. Последствия некроза тканей надпочечников приводит к гипотонии и нарушению синтеза стероидных гормонов. Вирус Эбола является эффективным индуктором про- и противо-воспалительных цитокинов, однако развитие местной воспалительной реакции и активация иммунокомпетентных клеток не способствуют полной элиминации вируса. Существуют данные, свидетельствующие о способности вируса к подавлению системы интерферона. Избыточная и неконтролируемая воспалительная реакция приобретает системный характер («цитокиновый шторм»), что в конечном итоге приводит к массивному поражению эндотелия сосудов, развитию ДВС-синдрома и полиорганной недостаточности.
Клиника. Начало заболевания внезапное с быстрым подъёмом температуры тела до 39–40 °С, интенсивной головной болью, слабостью. Характерны выраженная сухость и першение в горле (ощущение «верёвки» в горле), боли в грудной клетке, сухой кашель. На 2–3-и сутки появляются боли в животе, рвота, диарея с кровью (мелена), приводящие к обезвоживанию. С первых дней течения заболевания характерны амимичность лица и запавшие глаза. На 3–4-е сутки появляются кишечные, желудочные, маточные кровотечения, кровоточивость слизистых оболочек, геморрагии в местах инъекций и повреждений кожи, кровоизлияния в конъюнктивы. Геморрагический синдром быстро прогрессирует. На 5–7-е сутки у части больных (50%) появляется кореподобная сыпь, после которой происходит шелушение кожи. Выявляют заторможенность, сонливость, спутанность сознания, в некоторых случаях — психомоторное возбуждение. Смерть наступает на 8–9-е сутки от массивной кровопотери и шока. При благоприятном исходе лихорадочный период длится 10–12 сут; Выздоровление медленное в течение 2–3 мес. В период реконвалесценции наблюдают выраженную астенизацию, анорексию, кахексию, выпадение волос, трофические нарушения, психические расстройства.
Осложнения. ИТШ, геморрагический и гиповолемический шок.
Диагностика. Клиническая: специфические признаки отсутствуют. Специфическая лабораторная диагностика: Вирусологические и серологические методы. Выделение вируса из крови больных, носоглоточной слизи и мочи проводят путём заражения клеточных культур; при электронно-микроскопическом исследовании биоптатов кожи или внутренних органов. Применяют ПЦР, ИФА, РНИФ, РН, РСК и др. Все исследования проводят в специальных лабораториях с IV уровнем биологической безопасности. Неспецифическая лабораторная диагностика: Включает проведение общего анализа крови (характерны: анемия; лейкопения, сменяющаяся лейкоцитозом с нейтрофильным сдвигом; наличие атипичных лимфоцитов; тромбоцитопения; пониженная СОЭ); биохимического анализа крови (выявляют повышение активности трансфераз, амилазы, азотемия); определение коагулограммы (характерна гипокоагуляция) и кислотно-основного состояния крови (выявляют признаки метаболического ацидоза); проведение общего анализа мочи (выражена протеинурия).Инструментальные методы: Рентгенография органов грудной клетки, ЭКГ, УЗИ
Лечение. Больной нуждается в строгом постельном режиме и круглосуточном медицинском наблюдении. Диета соответствует столу № 4 по Певзнеру. Этиотропное: рибавирин. В эпидемическом очаге рекомендовано использование плазмы реконвалесцентов. Основные лечебные мероприятия состоят в применении патогенетических и симптоматических ЛС. Борьбу с интоксикацией, обезвоживанием, кровотечением, шоком проводят общепринятыми методами.
Профилактика. Специфическая профилактика: вакцина от Эболы (?). Неспецифическая профилактика заключается в изоляции больных в специальных отделениях или палатах-изоляторах, желательно в специальных пластиковых или стеклянно-металлических изоляционных кабинах с автономным жизнеобеспечением. Для перевозки больных используют специальные транспортные изоляторы. Медицинский персонал должен работать в индивидуальных средствах защиты (респираторы или марлевые маски, перчатки, очки, защитный костюм). Необходимо строгое соблюдение стерилизации шприцев, игл, инструментария в медицинских учреждениях. Для экстренной профилактики лихорадки Эбола применяют специфический иммуноглобулин, полученный из сыворотки иммунизированных лошадей (метод разработан в Вирусологическом центре Научно-исследовательского института микробиологии). В очагах всех больных изолируют, устанавливают медицинское наблюдение и контроль за контактировавшими. Важнейшее профилактическое мероприятие, препятствующее заносу ГЛ из эндемичных районов, — осуществление Международной системы эпидемиологического надзора.
34. Лихорадка Западного Нила: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
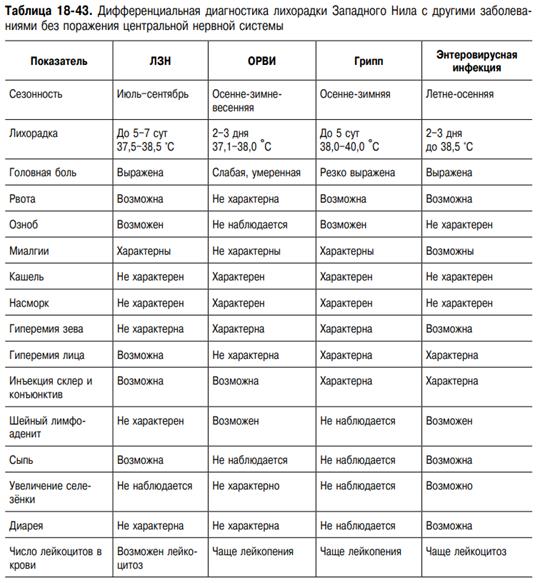
ЛЗН (энцефалит Западного Нила) — острая вирусная антропо(?)зоонозная природно-очаговая болезнь с трансмиссивным механизмом передачи возбудителя. Характеризуется острым началом, выраженным лихорадочно-интоксикационным синдромом и поражением ЦНС. В тяжелых случаях - с поражением ЦНС (серозным воспалением мозговых оболочек, реже - менингоэнцефалитом и острым вялым параличом, которые часто наблюдаются в комбинации).
Этиология. Возбудитель инфекции - вирус Западного Нила (ВЗН) относится к семейству Flaviviridae, роду Flavivirus и входит в антигенный комплекс японского энцефалита. В соответствии с классификацией патогенных для человека микроорганизмов ВЗН относится ко II группе патогенности. Возбудитель - флавивирус группы В, содержит однонитевую РНК, имеет сферическую форму. На основании различия нуклеотидных и аминокислотных последовательностей в настоящее время различают не менее пяти генотипов ВЗН. Хорошо сохраняется в замороженном и высушенном состоянии. Погибает при температуре выше 56°С в течение 30 мин. Вирус ЛЗН обладает значительной способностью к изменчивости, что обусловлено несовершенством механизма копирования генетической информации. Наибольшая изменчивость характерна для генов, кодирующих белки оболочки, ответственные за антигенные свойства вируса и его взаимодействие с мембранами тканевых клеток. Штаммы вируса ЛЗН, выделенные в различных странах и в различные годы, не имеют генетического сходства и обладают различной вирулентностью. Группа «старых» штаммов ЛЗН, выделявшихся, в основном, до 1990 г., не связана с тяжёлыми поражениями ЦНС. Группа «новых» штаммов связана с массовыми и тяжёлыми заболеваниями человека.
Эпидемиология. Резервуар вируса в природе — птицы водно-околоводного комплекса, переносчик — комары, в первую очередь орнитофильные комары рода Culex. Между ними происходит циркуляция вируса в природе, они определяют возможный ареал распространения ЛЗН — от экваториальной зоны до регионов с умеренным климатом. В настоящее время вирус ЛЗН выделен более чем от 40 видов комаров, входящих не только в род Culex, но и в роды Aedes, Anopheles и др. Значение конкретных видов комаров в эпидемическом процессе, протекающем на определённой территории, не выяснено. Работами российских ученых установлена заражённость аргасовых и иксодовых клещей в природных очагах ЛЗН. Дополнительную роль в сохранении и распространении вируса могут играть синантропные птицы. Вместе с «городскими» орнитофильными и антропофильными комарами домашние и городские птицы могут формировать так называемый городской, или антропургический очаг ЛЗН. Описаны заболевания млекопитающих, в частности эпизоотии лошадей (от десятков до сотен случаев). В связи с высоким уровнем заболеваемости ЛЗН в США в 2002–2005 гг. отмечали случаи заражения ЛЗН реципиентов крови и органов. В странах с умеренным климатом болезнь имеет выраженную сезонность, обусловленную активностью комаров-переносчиков. В северном полушарии заболеваемость отмечается с конца июля, достигает максимума в конце августа — начале сентября и прекращается с наступлением холодов к октябрю — ноябрю. Восприимчивость человека к ЛЗН, по-видимому, высокая, преобладает субклиническое течение инфекции. Перенесённая болезнь оставляет после себя выраженный иммунитет. Об этом свидетельствует тот факт, что в гиперэндемичных регионах (Египет) болеют дети младших возрастных групп, а антитела обнаруживают более чем у 50% населения, в то время как в странах из гипоэндемичных областей уровень популяционного иммунитета ниже 10% и болеют преимущественно взрослые, в частности, в южных регионах России.
Патогенез. При укусе со слюной зараженного переносчика ВЗН попадает в организм человека. Первой стадией патогенеза инфекции является репликация ВЗН в эпидермисе, в дендритных клетках Лангерганса. Эти клетки мигрируют в ближайшие лимфатические узлы, инфицируя их, в результате чего ВЗН попадает лимфогенно и гематогенно в кровь, селезенку, почки. Предполагают, что вирус распространяется гематогенно, вызывая поражение эндотелия сосудов и микроциркуляторные расстройства, в части случаев — развитие тромбогеморрагического синдрома. Установлено, что вирусемия кратковременная и неинтенсивная. Ведущее в патогенезе болезни — поражение оболочек и вещества мозга, приводящее к развитию менингеального и общемозгового синдромов, очаговой симптоматики. Смерть наступает, как правило, на 7–28-й день болезни вследствие нарушения жизненно важных функций из-за отёка-набухания вещества мозга с дислокацией стволовых структур, некрозом нейроцитов, кровоизлияниями в ствол мозга. На аутопсии обнаруживают отёк и полнокровие оболочек мозга, мелкоочаговые периваскулярные кровоизлияния, крупные геморрагии (до 3–4 см в диаметре), расширение желудочков мозга, полнокровие сосудистого сплетения, множественные очаги размягчения в полушариях мозга, мелкоточечные кровоизлияния в дно IV желудочка, у 30% умерших — дислокацию ствола мозга. При микроскопическом исследовании определяют васкулиты и периваскулиты оболочек мозга, очаговый энцефалит с образованием мононуклеарных инфильтратов. В сосудах головного мозга — картина полнокровия и стаза, фибриноидное набухание и некроз сосудистой стенки. В ганглиозных клетках — выраженные дистрофические изменения вплоть до некроза, выраженный периваскулярный и перицеллюлярный отёк. Существенные изменения обнаруживают со стороны сердца: дряблость мышцы, стромальный отёк, дистрофия миоцитов, участки фрагментации мышечных волокон и миолиза. В почках — дистрофические изменения. У части больных определяют признаки генерализованного тромбогеморрагического синдрома.
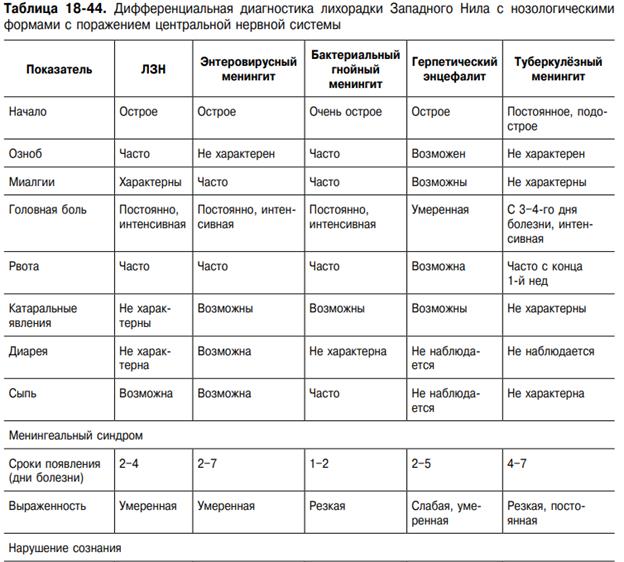
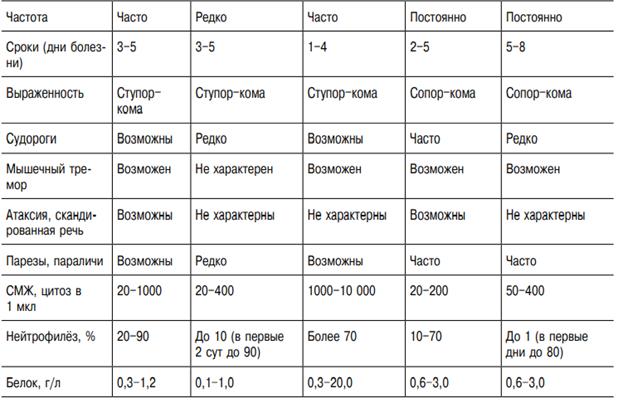
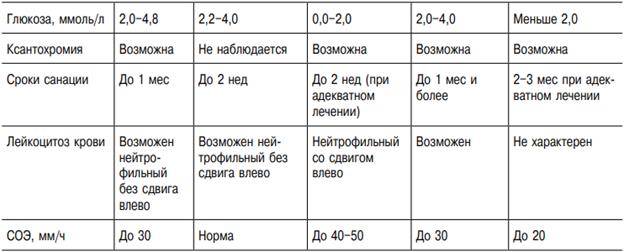
Клиника. Инкубационный период продолжается от 2 дней до 3 нед, чаще 3–8 дней. Болезнь начинается остро с повышения температуры тела до 38–40 °С, а иногда и выше в течение нескольких часов. Повышение температуры сопровождается выраженным ознобом, интенсивной головной болью, болью в глазных яблоках, иногда рвотой, болями в мышцах, пояснице, суставах, резкой общей слабостью. Интоксикационный синдром выражен даже в случаях, протекающих с кратковременной лихорадкой, причём после нормализации температуры длительно сохраняется астения. Наиболее характерные симптомы ЛЗН, вызванной «старыми» штаммами вируса, помимо перечисленных, — склерит, конъюнктивит, фарингит, полиаденопатия, сыпь, гепатолиенальный синдром. Нередки диспепсические расстройства (энтерит без болевого синдрома). Поражение ЦНС в виде менингита и энцефалита встречается редко. В целом течение болезни доброкачественное. Картина болезни, вызванной «новыми» штаммами вируса, существенно отличается от вышеописанной. Ю.Я. Венгеровым и А.Е. Платоновым (2000) на основании наблюдений и серологических исследований предложена клиническая классификация ЛЗН (табл. 18-42). Субклиническую инфекцию диагностируют при скрининговых исследованиях населения по наличию антител класса IgM или нарастанию титра антител класса IgG в четыре и более раз. Гриппоподобная форма не имеет клинической специфики. Она наименее изучена, так как часто, в связи с кратковременностью расстройства здоровья, больные не обращаются к врачу или же их заболевание расценивают на уровне поликлиники как грипп, ОРВИ. При гриппоподобной форме с нейротоксикозом на 3–5-й день болезни происходит резкое ухудшение состояния, что выражается усилением головной боли, появлением тошноты, рвоты, мышечного тремора, атаксии, головокружения и других симптомов поражения ЦНС. Лихорадка в этих случаях высокая, длительностью 5–10 сут. Классическую симптоматику — склерит, конъюнктивит, диарею, сыпь — наблюдают в единичных случаях. Доминируют симптомы поражения ЦНС: интенсивная головная боль диффузного характера, тошнота, у половины больных — рвота. Частые симптомы — головокружение, адинамия, заторможенность, корешковые боли, гиперестезия кожи. Более чем у половины больных определяют менингеальный синдром, в части случаев — повышение АД. При исследовании СМЖ, помимо повышения ЛД, другой патологии нет. У пациентов с менингеальной формой болезни менингеальные симптомы нарастают в течение 2–3 дней; наиболее резко выражена ригидность мышц затылка. По сравнению с гриппоподобной формой с нейротоксикозом также выражена общемозговая симптоматика, отмечают преходящие очаговые симптомы. Наиболее характерны: ступор, мышечный тремор, анизорефлексия, нистагм, пирамидные знаки. При проведении спинномозговой пункции прозрачная или опалесцирующая СМЖ вытекает под повышенным давлением. Цитоз варьирует в широких пределах — от 15 до 1000 клеток в 1 мкл (в большинстве случаев 200–300 клеток в 1 мкл) и носит чаще смешанный характер. При исследовании в первые 3–5 дней болезни у части больных цитоз нейтрофильный (до 90% нейтрофилов). Смешанный цитоз сохраняется нередко до 2–3 нед, что, по-видимому, связано с наличием некроза значительной части нейроцитов. Этим объясняется и более медленная санация ликвора, нередко затягивающаяся до 3–4-й нед болезни. Количество белка в пределах 0,45–1,0 г/л, содержание глюкозы — у верхних границ нормы или повышено, осадочные пробы слабоположительные. Течение болезни доброкачественное, продолжительность лихорадки 12 сут, менингеальные симптомы регрессируют в течение 3–10 сут. После нормализации температуры сохраняется слабость, повышенная утомляемость. Менингоэнцефалическая форма болезни протекает наиболее тяжело. Начало болезни бурное, гипертермия и интоксикация с первых дней болезни. Менингеальные симптомы выражены слабо или умеренно. С 3–4-го дня нарастают общемозговые симптомы: спутанность сознания, возбуждение, бред, сопор, в части случаев переходящий в кому. Часто отмечают судороги, парезы черепных нервов, нистагм, реже — парезы конечностей, в наиболее тяжёлых случаях доминируют дыхательные расстройства, центральные нарушения гемодинамики. Летальность до 50%. У выздоровевших нередко сохраняются парезы, мышечный тремор, длительная астения. Плеоцитоз СМЖ от 10 до 300 клеток в 1 мкл, содержание белка достигает 0,6–2,0 г/л. Картина крови при ЛЗН характеризуется особенностями, свойственными для тяжёлых вирусных инфекциий: преобладает тенденция к лейкоцитозу, нейтрофилёз, отмечается лимфопения, увеличение СОЭ. Несмотря на отсутствие клинической симптоматики, в моче — протеинурия, цилиндрурия, лейкоцитурия. Летальность среди госпитализированных больных составляет около 4–5%, что позволяет отнести ЛЗН к тяжёлым (опасным) вирусным нейроинфекциям.
Осложнения. Основными угрожающими состояниями, развивающимися при лихорадке, считаются отек и набухание головного мозга, церебральные кровоизлияния, острая сердечно-сосудистая недостаточность, гипостатическая пневмония и другие вторичные бактериальные гнойные осложнения. Активная репликация вируса в стволе головного мозга может приводить к острой дыхательной недостаточности, остановке сердечной деятельности, неконтролируемой гиперпирексии. После перенесенного заболевания могут наблюдаться атаксические явления.
Диагностика. 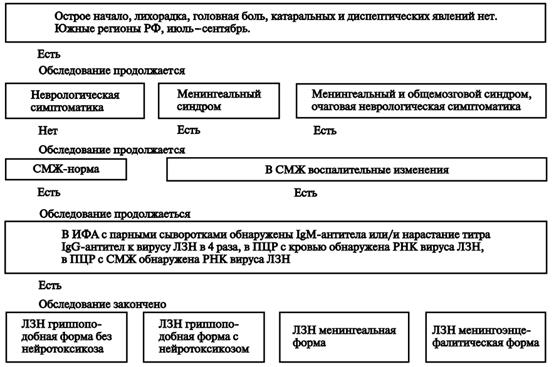
Лечение. В остром периоде болезни режим постельный. Специальной диеты не требуется. При расстройствах сознания, бульбарных нарушениях показано зондовое или зондово-парентеральное питание. Эффективность противовирусных препаратов для лечения ЛЗН не доказана, поэтому рекомендуют синдромальную терапию. Для борьбы с церебральной гипертензией применяют фуросемид взрослым 20–60 мг в сутки, поддерживают нормальный объём циркулирующей крови. При нарастании симптомов отёка–набухания мозга назначают маннитол в дозе 0,5 г/кг массы тела в 10% растворе, вводить быстро в течение 10 мин, с последующим введением 20–40 мг фуросемида внутривенно. В тяжёлых случаях (кома, нарушения дыхания, генерализованные судороги) назначают дополнительно дексаметазон (дексазон) в дозе 0,25–0,5 мг/кг в сутки в течение 2–4 сут. Дезинтоксикацию и компенсацию потерь жидкости осуществляют путём внутривенных инфузий полиионных растворов (раствор «трисоль»), поляризующей смеси и коллоидных растворов (10% раствор альбумина, криоплазма, реополиглюкин, реоглюман) в соотношении 2:1. Оптимальный суточный объём вводимой жидкости, включая пероральное и зондовое введение, — 3–4 л для взрослых и 100 мл/кг массы тела для детей. Для борьбы с гипоксией используют ингаляции кислорода через назальные катетеры. Больных переводят на ИВЛ по следующим показаниям — чрезмерная одышка (ЧД в два раза и более выше нормы), стойкая гипоксемия (РаО2 менее 70 мм рт.ст.), гипокапния (РаСО2 менее 25 мм рт.ст.) или гиперкапния (РаСО2 более 45 мм рт.ст.), кома, генерализованные судороги. Проводят коррекцию электролитных нарушений и осмолярности крови. По индивидуальным показаниям назначают противосудорожные, седативные препараты, антиоксиданты, средства, улучшающие мозговой кровоток (пентоксифиллин), при наличии вторичных бактериальных осложнений — антибиотики. Больным необходимо сбалансированное энтерально-парентеральное питание, включающее комплекс витаминов и микроэлементов, полноценный уход (профилактика гипостатической пневмонии, пролежней, контроль стула и диуреза). Выписку больных осуществляют после стойкой нормализации температуры, регресса неврологических нарушений и санации СМЖ. Минимальная продолжительность стационарного лечения для больных с нейротоксикозом — 10 сут, менингитом — 20 сут, менингоэнцефалитом — 30 сут. После выписки из стационара больные с неврологическими нарушениями нуждаются в диспансерном наблюдении неврологом до полного восстановления трудоспособности и регресса неврологической симптоматики.
Профилактика. Мероприятия по общей профилактике ЛЗН направлены на снижение численности комаров, что достигается проведением противокомариных обработок мест выплода комаров в городской черте и на прилегающих территориях, а также на территориях вблизи загородных баз отдыха, профилакториев, детских лагерей. Подлежат дезинсекционной обработке подвалы жилых и общественных зданий в городской и сельской местности. Обработку можно проводить и вне эпидемического сезона для уничтожения комаров, зимующих в стадии имаго. Рекомендуется снижение плотности популяций синантропных птиц (вороны, галки, воробьи, голуби, чайки и др.). Мероприятия по общественной профилактике ЛЗН проводят по эпидемиологическим показаниям на основе регулярного эпидемиологического надзора и обследования территории. Меры неспецифической индивидуальной профилактики сводятся к применению в эпидемический период (июнь–октябрь) репеллентов и одежды, защищающей от укусов комаров, минимизации времени, проводимого на открытом воздухе во время максимальной активности комаров (вечером и утром), засечиванию окон, выбору для отдыха мест с наименьшей численностью комаров. В эндемичных регионах важное значение имеет санитарно-просветительская работа среди местного населения и приезжих.
35. Лихорадка Рифт-Валли: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Лихорадка Рифт-Валли (ЛРВ) – зоонозная арбовирусная природно-очаговая инфекционная болезнь людей, овец и крупного рогатого скота с трансмиссивным механизмом передачи возбудителя, характеризуется лихорадкой, общей интоксикацией, поражением центральной нервной системы, органов зрения, геморрагическими проявлениями и желтухой. Болезнь у домашних животных обычно проявляется в виде эпизоотий.
Этиология. Возбудитель болезни - вирус Рифт-Валли принадлежит к роду Phlebovirus семейства Bunyaviridae. Распространен в Южной и Восточной Африке. Вирус обнаружен у комаров Culex pipiens, Eretmapodites chrysogaster, Aedes cabbalus, Aedes circurnluteolus, Culex theiler L. Вирус был впервые выявлен в 1931 году во время расследования эпидемии среди овец на одной ферме в Рифтовой долине (Rift Valley), Кения. Летальность в этих случаях достигает 3,3 %.
Эпидемиология. Инкубационный период: 6 суток (от 4 до 6 суток).Источник инфекции - крупный и мелкий рогатый скот, верблюды, лошади, антилопы, обезьяны в период вирусемии больной человек может быть источником возбудителя для комара. Механизм передачи возбудителя: трансмиссивный, переносчики - комары родов Culex, Aedes и др; контактный – при разделке туши больного животного; возможно – аспирационный (при вдыхании аэрозолей, образовавшихся во время забоя инфицированных животных и при работе в лаборатории). Условия заражения: нахождение в предшествующие заболеванию 6 дней на территории природного очага в период эпизоотии при укусах инфицированных комаров, возможна также передача вируса гематофагами (питающимися кровью мухами); прямые или косвенные контакты с кровью или органами инфицированных животных (при манипуляциях с тканями животных во время их забоя или разделки, оказании помощи животным при родах, проведении ветеринарных процедур или утилизации трупов и эмбрионов). Повышенному риску инфицирования подвергаются люди, занимающиеся определенными видами деятельности, такие как пастухи, фермеры, работники скотобоен и ветеринары; путем вдыхания аэрозолей, образовавшихся во время забоя инфицированных животных. Аэрозольный путь передачи приводит также к инфицированию работников лабораторий.
Патогенез. Патогенез связан с гематогенной диссеминацией возбудителя в центральную нервную систему (головной мозг, орган зрения) и внутренние органы (поражение печени). Характерны васкулиты и нарушение функций свертывающей системы крови.
Клиника. Начало внезапное. Больной испытывает недомогание, чувство познабливания или настоящий озноб, головную боль, ретроорбитальные боли, боли в мышцах всего туловища и конечностей, боль в поясничной области. Температура тела быстро повышается до 38,3 - 40°С. Позже наблюдаются ухудшение аппетита, потеря вкуса, боли в эпигастрии, фотофобия. При физикальном обследовании отмечают покраснение лица и инъекцию сосудов конъюнктивы. Температурная кривая имеет двухфазный характер: первичное повышение длится 2 - 3 дня, за ним следуют ремиссия и повторное повышение температуры. При легких формах выздоровление наступает быстро. Однако возможны и тяжелые формы с развитием энцефалита, ретинопатии и геморрагических проявлений. Энцефалит возникает как острая инфекция, затем симптомы его затухают, но у выживших остаются тяжелые последствия. Легкая форма лихорадки Рифт-Валли у людей: Инкубационный период (промежуток времени между инфицированием и появлением симптомов) лихорадки Рифт-Валли длится от двух до шести дней; Инфицированные люди либо не имеют каких-либо поддающихся обнаружению симптомов, либо у них развивается легкая форма болезни, для которой характерен лихорадочный синдром с внезапным наступлением гриппозной лихорадки, мышечных болей, болей в суставах и головной боли; У некоторых пациентов развивается ригидность (неподвижность) шеи, светочувствительность, потеря аппетита и рвота; у таких пациентов болезнь на ее ранних стадиях может быть ошибочно принята за менингит; Обычно симптомы лихорадки Рифт-Валли длятся от четырех до семи дней, по прошествии которых можно обнаружить иммунную реакцию организма, проявляющуюся в появлении антител и постепенном исчезновении вируса из крови. Тяжелая форма лихорадки Рифт-Валли у людей: В то время как большинство случаев заболевания людей протекает относительно легко, у незначительной доли пациентов развивается гораздо более тяжелая форма болезни. Обычно она сопровождается появлением одного или нескольких из трех явных синдромов: болезни глаз (у 0,5-2% пациентов), менингоэнцефалита (менее чем у 1%) или геморрагической лихорадки (менее чем у 1%).
- Глазная форма. При этой форме болезни обычные симптомы, характерные для легкой формы болезни, сопровождаются поражением сетчатки глаз. Как правило, поражения глаз происходят через одну-три недели после появления первых симптомов. Пациенты обычно жалуются на расплывчатое или ослабленное зрение. Через 10-12 недель болезнь может пройти сама по себе без каких-либо длительных последствий. Однако при поражениях желтого пятна (macula) у 50% пациентов наблюдается постоянная потеря зрения. Смерть среди пациентов с одной лишь окулярной формой болезни происходит редко.
- Менингоэнцефалитная форма. Наступление менингоэнцефалитной формы болезни обычно происходит через одну-четыре недели после появления первых симптомов ЛРВ. Клинические симптомы включают сильную головную боль, потерю памяти, галлюцинации, спутанность сознания, дезориентацию, головокружение, судороги, летаргию и кому. Позднее (более чем через 60 дней) могут наступить неврологические осложнения. Коэффициент смертности среди пациентов с одной лишь этой формой болезни низкий, но остаточный неврологический дефицит, который может быть тяжелым, встречается часто.
- Геморрагическая форма. Симптомы этой формы болезни появляются через два-четыре дня после наступления болезни. Сначала появляются признаки тяжелого поражения печени, такие как желтуха, затем - признаки кровоизлияний, такие как рвота кровью, кровь в фекалиях, красная сыпь или кровоподтеки (вызываемые кровоизлияниями в кожу), кровотечения из носа и десен, меноррагии и кровотечения из мест венепункций. Летальность среди пациентов, у которых развивается геморрагическая форма болезни, достигает примерно 50%. Смерть обычно наступает через три-шесть дней после появления симптомов. Вирус в крови пациентов с ЛРВ в форме геморрагической желтухи можно обнаружить в течение 10 дней.
Осложнения. При тяжелых формах, как правило, связаны с геморрагическими проявлениями - генерализованные кровоизлияния или с поражением печени (желтуха). При обширном некрозе печени через 7-10 дней после начала болезни может наступить смерть. Через 2-7 дней после начала лихорадки возможна потеря зрения, включая световое восприятие. Развиваются отек желтого пятна, кровоизлияние, васкулит, ретинит и окклюзии сосудов. У 50% больных острота зрения не восстанавливается. В периферической крови в начале заболевания количество лейкоцитов не изменяется, но затем развивается лейкопения со снижением общего числа нейтрофильных гранулоцитов и увеличением палочкоядерных форм.
Диагностика. Серологические тесты, такие как стандартный твердофазный иммуноферментный анализ, могут подтвердить наличие особых антител IgM к вирусу. Сам вирус может быть обнаружен в крови на ранней стадии болезни или в тканях, взятых после смерти, с помощью различных методик, включая репродукцию вируса (в клеточных культурах или инокулированных животных), тесты для выявления антигенов и ПЦР с обратной транскрипцией.
Лечение. Пациенты с лихорадкой Рифт-Валли должны лечиться в стационаре. Постельный режим показан в период повышения температуры тела до ее нормализации в течение 4-5 суток и в случае развития осложнений. Диетические рекомендации заключаются в щадящем режиме питания с исключением трудноперевариваемой пищи, алкоголя. Водная нагрузка при отсутствии противопоказаний должна быть увеличена. Рибавирин? По показаниям осуществляются инфузии тромбомассы, свежезамороженной плазмы и раствора альбумина. Симптоматические средства назначаются с учетом возникающих проявлений, имеющихся осложнений.
Профилактика. Борьба с ЛРВ у животных: Вспышки ЛРВ среди животных можно предотвратить с помощью устойчивых программ вакцинации животных. Для ветеринарного использования разработаны вакцины как на основе модифицированных живых ослабленных вирусов, так и на основе инактивированных вирусов. Для выработки длительного иммунитета необходима всего лишь одна доза живой вакцины, однако у беременных животных применяемая в настоящее время вакцина может провоцировать самопроизвольный аборт. Вакцина из инактивированного вируса не приводит к таким побочным эффектам, но для обеспечения защиты необходимо введение многократных доз, что может быть проблематичным в эндемичных районах; Для предотвращения эпизоотий иммунизацию животных надо проводить до начала вспышки болезни. В случае если вспышка болезни уже возникла, вакцинацию проводить НЕЛЬЗЯ, так как существует высокий риск усиления вспышки. Во время кампаний массовой вакцинации животных ветеринарные работники могут непреднамеренно способствовать передаче вируса при использовании многодозовых ампул и повторном использовании игл и шприцев. Если некоторые животные в стаде уже инфицированы и виремичны (несмотря на отсутствие явных признаков болезни), вирус будет передан другим животным в стаде и вспышка усилится; Ограничение или запрещение передвижения скота может быть эффективным в замедлении распространения вируса из инфицированных в неинфицированные районы; В связи с тем, что вспышки ЛРВ у животных предшествуют возникновению случаев заболевания людей, для обеспечения раннего оповещения ветеринарных служб и органов общественного здравоохранения важное значение имеет создание системы активного ветнадзора для выявления новых случаев заболевания. Санитарное просвещение и снижение риска: Самым значительным фактором риска инфицирования вирусом ЛРВ во время вспышки болезни являются тесные контакты с животными, особенно с жидкостями организма, как непосредственно, так и через аэрозоли. При отсутствии специального лечения и эффективной вакцины для людей повышение осведомленности о факторах риска инфицирования ЛРВ наряду с принятием индивидуальных защитных мер для предотвращения укусов комаров являются единственными способами снижения заболеваемости и смертности среди людей. Медико-санитарные информационные сообщения, направленные на снижение риска, необходимо фокусировать на следующих аспектах: Снижение риска передачи инфекции от животного человеку в результате небезопасной практики животноводства или забоя животных. Необходимо надевать перчатки и другую соответствующую защитную одежду и соблюдать осторожность при обращении с больными животными или их тканями, а также при забое животных; Снижение риска передачи инфекции от животного человеку из-за небезопасного потребления свежей крови, сырого молока или тканей животных. В районах, охваченных эпизоотиями, все продукты животного происхождения (кровь, мясо и молоко) перед употреблением в пищу необходимо подвергать тщательной тепловой обработке; Важность защиты от укусов комаров на уровне отдельных лиц и общин, которые должны использовать пропитанные инсектицидом противомоскитные сетки и, при наличии, индивидуальные репелленты, носить светлую одежду (рубашки с длинным рукавом и брюки), а также избегать деятельности на свежем воздухе в разгар сезона активности комаров, являющихся переносчиками инфекции. Инфекционный контроль в медицинских учреждениях:
Несмотря на то, что случаев передачи инфекции от человека человеку не выявлено, все же теоретически существует риск передачи вируса от инфицированных пациентов медико-санитарным работникам в результате контакта с инфицированными кровью или тканями. Медико-санитарные работники, осуществляющие уход за пациентами с подозреваемой или подтвержденной ЛРВ, должны соблюдать стандартные меры предосторожности при манипуляциях с образцами, взятыми у этих пациентов; Стандартные меры предосторожности определяют рабочие методики, которые необходимо применять для обеспечения базового уровня инфекционного контроля. Стандартные меры предосторожности рекомендуется принимать при уходе и лечении всех пациентов, независимо от того, является ли их инфекционный статус предполагаемым или подтвержденным. Они касаются манипуляций с кровью (включая высушенную кровь) и всеми другими жидкостями организма, выделениями и экскрементами (кроме пота), независимо от того, содержится ли в них видимая кровь или нет, а также контакта с поврежденными (интактными) кожными покровами и слизистыми оболочками; Как указывалось выше, работники лабораторий также подвергаются риску. Манипуляции с образцами, взятыми для постановки диагноза у людей и животных с подозрением на ЛРВ, должен проводить обученный персонал в надлежащим образом оборудованных лабораториях. Борьба с переносчиками инфекции: Другие способы контроля над распространением ЛРВ включают борьбу с переносчиками инфекции и защиту от их укусов; Проведение противоличиночной обработки в местах размножения комаров является самой эффективной формой борьбы с переносчиками инфекции при условии, что такие места можно четко определить, а их размеры и протяженность ограничены. Однако в периоды наводнений, когда число и размеры мест размножения, как правило, значительно возрастают, противоличиночная обработка нецелесообразна.
36. Крымская лихорадка: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
КГЛ (геморрагическая лихорадка Крым–Конго–Хазер, среднеазиатская геморрагическая лихорадка, острый инфекционный капилляротоксикоз, Крымско-Конголезская лихорадка) — острая вирусная антропозоонозная природно-очаговая инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, характеризующаяся лихорадкой, общей интоксикацией, выраженным геморрагическим синдромом и тяжёлым течением. КГЛ относят к опасным инфекционным болезням.
Этиология. Возбудитель — арбовирус семейства Bunyaviridae, рода Nairovirus; сферической или эллипсоидной формы; покрыт липидосодержащей оболочкой с шипами. Геном вируса содержит 3 фрагмента (L-, M-, S-) одноцепочечной кольцевой «минус»-цепи РНК, кодирующих транскриптазу, нуклеокапсидный белок (N) и оболочечные гликопротеины (G1 и G2). Гемагглютинирующую способность возбудителя КГЛ обеспечивает один из поверхностных гликопротеинов. Возбудитель КГЛ способен размножаться в клетках мозга и брюшной полости новорождённых белых мышей, в новорождённых белых крысах и в культуре перевиваемых клеток почек поросят. После пассажа через живой организм вирус усиливает вирулентность. Возбудителя КГЛ можно инактивировать дезинфицирующими растворами, жирорастворителями (эфиром, параформальдегидом, спиртом). При 45 °С вирус погибает в течение 2 ч, при кипячении — мгновенно. Хорошо сохраняется в замороженном состоянии.
Эпидемиология. Основной природный резервуар возбудителя КГЛ — клещи рода Hyalomma (H. рl. plumbeum, H. scupens, H. marginatus), Rhipicephalus (Rh. rossicus), Dermacentor (D. marginatus и D. reticulatus) и Boophilus (B. annulatus); а также дикие (зайцы, африканские ежи) и домашние (овцы, козы, коровы) животные. Заражение человека происходит трансмиссивным (через укус клещом), контактным (при попадании на повреждённую кожу и слизистые оболочки крови и кровянистых выделений больного КГЛ и при раздавливании клещей) и аэрогенным (в лабораторных условиях) путями. Восприимчивость к КГЛ высокая независимо от возраста, но чаще болеют мужчины в возрасте 20–50 лет (охотники, пастухи, ветеринары, животноводы, полеводы), а также доярки, медицинские работники и лица, привлекаемые к уходу за больными; лаборанты, работающие с кровью; члены их семей. Постинфекционный иммунитет стойкий. Природные очаги расположены в полупустынных, степных, лесостепных и пойменных ландшафтах с тёплым климатом. Эта территория непригодна для земледелия и используется в основном для выпаса скота, являющегося хозяином взрослых стадий клещей рода Hyalomma. Сезонность — весенне-летняя (апрель–сентябрь) с пиком в июне–июле.
Патогенез. Изучен недостаточно. После проникновения в организм человека вирус размножается в эндотелии сосудов, эпителиальных клетках печени, почек и в ретикулоэндотелиальной системе, вызывая васкулит с преимущественным поражением сосудов микроциркуляторного русла. Затем развивается вирусемия, что соответствует начальному периоду заболевания. По данным ПЦР, вирусемия длится 5–9 сут. Её интенсивность коррелирует с тяжестью течения заболевания. В результате непосредственного вазотропного действия вируса, поражения надпочечников и гипоталамуса происходит повышение проницаемости сосудов и нарастание нарушений в системе гемостаза, что клинически выражается симптомами геморрагического диатеза.
Клиника. КГЛ без геморрагического синдрома может протекать в лёгкой и среднетяжёлой формах; с геморрагическим синдромом — в лёгкой, среднетяжёлой и тяжёлой формах. Течение заболевания циклическое и включает следующие периоды: G начальный период (предгеморрагический); G период разгара (геморрагических проявлений); G период реконвалесценции и отдалённых последствий (резидуальный). Начальный период длится 3–4 сут; характеризуется острым началом заболевания без продромальных явлений, внезапным подъёмом температуры, сильной головной болью, ломотой и болями во всём теле (особенно в пояснице), резкой слабостью, отсутствием аппетита, тошнотой, а также рвотой, не связанной с приёмом пищи; при тяжелом течении — головокружением и нарушением сознания. Выявляют также гипотензию и брадикардию. В период разгара (2–4-е сутки течения заболевания) выявляют кратковременное снижение температуры тела (в течение 24–36 ч), а затем она вновь повышается и на 6–7-е сутки начинает литически снижаться («двугорбая» температурная кривая); развивается геморрагический синдром в виде петехиальной сыпи на боковых поверхностях грудной клетки и живота, кровоизлияний в местах инъекций, гематом, кровоточивости дёсен, кровянистых выделений из глаз и ушей, а также носовых, лёгочных, желудочно-кишечных и маточных кровотечений. Состояние больного резко ухудшается: выражены симптомы интоксикации, приглушённость сердечных тонов, артериальная гипотензия, брадикардия сменяется тахикардией, печень увеличивается. Выявляют вялость, адинамию, иногда оглушённость и спутанность сознания, реже — возбуждение, галлюцинации, бред. Часто менингеальные симптомы (ригидность затылочных мышц, симптом Кёрнига), выявляют преходящую анизокорию, пирамидные знаки, нарушение конвергенции. Больные имеют характерный внешний вид: зев, лицо, шея и верхняя часть грудной клетки гиперемированы; склеры инъецированы; на мягком нёбе и слизистой оболочке ротовой полости выражена энантема; редко возникает желтуха. Тяжесть и исход заболевания обусловлены выраженностью геморрагического синдрома. Желтушность в сочетании с другими проявлениями поражения печени — плохие прогностические признаки. Доминирование гепатита в клинической картине может привести к летальному исходу. Период реконвалесценции длительный (от 1–2 мес до 1–2 лет и более); начинается с нормализации температуры тела, прекращения проявлений геморрагического синдрома. Для этого периода характерны астеновегетативные расстройства: слабость, повышенная утомляемость, головокружение, головные и боли в сердце, инъекция сосудов склер, гиперемия слизистой оболочки ротоглотки, гипотензия и лабильность пульса (сохраняются в течение 2–3 нед). Осложнения: Специфические: ИТШ и геморрагический шок; ДВС-синдром; очаговая пневмония; отёк лёгкого; острая сердечно-сосудистая, почечная и печёночная недостаточность; постгеморрагическая анемия. Неспецифические: пневмонии, отит, паротит, флегмоны, абсцессы мягких тканей в местах инъекций, миокардит, ангины, перитонит, тромбофлебит, сепсис
Диагностика. Клинические признаки. • Острое начало заболевания с высокой температурой, гиперемия лица и видимых слизистых оболочек, спонтанные мышечные и суставные боли, интенсивная головная боль, тошнота, рвота, кровоточивость дёсен, геморрагическая энантема на слизистых оболочках, петехиальная сыпь с типичной локализацией; гепатомегалия; брадикардия; гипотензия; носовые, лёгочные, желудочно-кишечные, маточные кровотечения; двухволновая температурная кривая. • Наличие на теле следов укусов клещей. • Эпидемиологический анамнез (пребывание в эндемичном для КГЛ регионе, контакт с больным КГЛ). • Сезонность. Специфическая и неспецифическая лабораторная диагностика Неспецифическая лабораторная диагностика. • Определение группы крови и резус-фактора. • Клинический анализ крови. Характерны: выраженная лейкопения, лимфоцитоз с нейтрофильным сдвигом влево до палочкоядерных, тромбоцитопения, умеренная анемия, повышение СОЭ. • Общий анализ мочи. В начальном периоде выявляют: незначительную альбуминурию, микрогематурию, цилиндрурию; в период разгара — гематурию. • Коагулограмма. Для КГЛ характерны признаки гиперкоагуляции (укорочение тромбинового времени до 10–15 с и времени свёртывания крови; повышение содержания фибриногена в плазме крови до 4,5–8 г/л, увеличение протромбинового индекса до 100–120%) или гипокоагуляции (удлинение тромбинового времени до 25–50 с, времени свёртывания крови; снижение содержания фибриногена в плазме крови до 1–2 г/л, а протромбинового индекса до 30–60%). • Биохимический анализ крови. Выявляют уменьшение содержания общего белка в сыворотке крови (при профузных кровотечениях), гипоальбуминемию, гипербилилирубинемию, повышение активности аланиловой и аспарагиновой аминотрансфераз. • Анализ кала для выявления внутрикишечного кровотечения. Специфическая лабораторная диагностика. • ИФА. • Методы флюоресцирующих антител (в парных сыворотках). • ПЦР. Инструментальные методы • УЗИ почек, печени, органов брюшной полости. • ЭКГ. • Рентгенография органов грудной клетки. • КТ головного мозга.
Лечение. Показания к госпитализации Больные КГЛ подлежат скорейшей госпитализации в инфекционный стационар, независимо от тяжести и периода течения заболевания, с максимально щадящей транспортировкой, исключением толчков и тряски. Транспортировка пациента противопоказана в период кровотечений. Пациента с КГЛ нужно размещать в боксе с соблюдением правил противоэпидемического режима для возбудителей I группы патогенности. Немедленно подают экстренное извещение в ГЦСЭН (учётная форма № 58). Необходимо соблюдение строгого постельного режима; круглосуточное медицинское наблюдение. Рекомендовано щадящее питание. В период кровотечений следует принимать жидкую холодную пищу (супы-пюре, кисели); мясные отвары, соки противопоказаны (вводят в рацион после прекращения кровотечений). В период реконвалесценции показано употребление продуктов, богатых белком. Медикаментозное лечение Включает специфическое, патогенетическое и симптоматическое лечение. Следует избегать необоснованного назначения медицинских манипуляций, сопровождающихся травматизацией кожного и слизистого покровов. Лечение необходимо проводить под ежедневным контролем коагулограммы и количества тромбоцитов (2 раза в сутки). Этиотропное лечение Предпочтительно назначать рибавирин в первые 4 сут от начала заболевания (период максимальной вирусемии). Используют рибавирин в форме капсул по 200 мг. Рекомендуемая «ударная» доза рибавирина составляет 2000 мг однократно (10 капсул) — 30 мг/кг на средний вес больного 70 кг, с последующим переходом на дозу 1200 мг/сут в 2 приёма (если вес больного больше 75 кг) или 1000 мг/сут в 2 приёма (если вес больного меньше 75 кг). Рибавирин принимают внутрь, не разжёвывая и запивая водой одновременно с приёмом пищи. Патогенетическое лечение Включает: G дезинтоксикационное лечение (внутривенно вводят 5–10% растворы глюкозы, изотонический раствор натрия хлорида с аскорбиновой кислотой и кокарбоксилазой); G профилактику ДВС-синдрома с использованием ангиопротекторов (кальция глюконат, этамзилат, рутозид, кальция добезилат), свежезамороженной плазмы, ингибиторов протеаз (апротинин); G антиоксидантное лечение (витамин Е, убихинон композитум). Лечение синдрома диссеминированного внутрисосудистого свёртывания: G при гиперкоагуляции назначают гепарин натрия до 10 000–15 000 ЕД/сут, при гипокоагуляции — до 5000 ЕД/сут внутривенно (противопоказано введение гепарина натрия без крови и плазмы); G применяют инфузию свежезамороженной плазмы крови до 600–800 мл/сут внутривенно капельно; G используют ингибиторы протеаз (апротинин до 1000 ЕД/кг в сутки) и ангиопротекторы (этамзилат до 6–8 мл/сут); G проводят регуляцию клеточной мембранной проницаемости (глюкокортикоиды по 60–90 мг/сут внутривенно); G при выраженной тромбоцитопении назначают концентрат тромбоцитов. Вирусные инфекции 849 Г Восстановление объёма циркулирующих эритроцитов осуществляют введением лава 18 эритроцитарной массы при потере 25–30% объёма циркулирующей крови, снижении содержания гемоглобина ниже 70–80 г/л и гематокрита ниже 25%, возникновении циркуляторных нарушений, коррекции VIII фактора свёртывания крови и фибриногена введением криопреципитата. Противопоказано переливание консервированной крови со сроком хранения более 3 сут. При желудочно-кишечных кровотечениях показан приём внутрь охлаждённой аминокапроновой кислоты, антацидов (алгелдрат + магния гидроксид), циметидина. При развитии сердечно-сосудистой недостаточности применяют оксигенотерапию, сердечные гликозиды и кардиотоники (строфантин-К, ландыша травы гликозид, никетамид) внутривенно. Лечение ИТШ проводят аналогично лечению ГЛПС. При осложнениях проводят антибактериальное лечение. В периоде реконвалесценции назначают общеукрепляющие ЛС, витамины, а также проводят коррекцию анемии.
Профилактика. Вакцина не имеет доказательной базы.
Снижение риска передачи вируса от клеща человеку:
o носить защитную одежду (длинные рукава, длинные брюки);
o носить светлую одежду, позволяющую легко обнаружить клещей на одежде;
o применять разрешенные к применению акарициды для одежды;
o применять разрешенные к применению репелленты для кожи и одежды;
o регулярно осматривать одежду и кожу в целях обнаружения клещей; в случае их обнаружения удалять их безопасными методами;
o после удаления клеща необходимо в течение 14 дней наблюдать за своим состоянием здоровья и при малейшем его ухудшении обращаться к врачу;
o при обнаружении клеща на теле необходимо немедленно обратиться в ближайшее лечебно-профилактическое учреждение;
o стремиться к недопущению поражения животных клещами или проводить борьбу против клещей в помещениях для содержания животных;
o избегать пребывания в районах, где имеется большое количество клещей, и в те сезоны, когда они наиболее активны;
Снижение риска передачи вируса от животных человеку:
o надевать перчатки и другую защитную одежду при обращении с животными или их тканями в эндемичных районах, особенно во время забоя, разделки туш и выбраковки на скотобойнях или в домашних условиях;
o содержать животных в карантине до их поступления на скотобойни или в обычном порядке обрабатывать животных пестицидами за две недели до забоя;
o владельцам сельскохозяйственных животных, лицам, посещающим пастбища, выполняющим полевые работы, находившихся на отдыхе в природном биотопе и не отмечавших укуса клеща, при ухудшении самочувствия (повышение температуры, головная и мышечная боль, слабость) необходимо немедленно обратиться к врачу.
Снижение риска передачи инфекции от человека человеку в отдельных сообществах:
o избегать тесного физического контакта с людьми, инфицированными ККГЛ;
o надевать перчатки и защитную одежду при уходе за больными людьми;
o регулярно мыть руки после ухода за больными людьми или их посещения.
37. Бруцеллез: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Бруцеллёз (лихорадка мальтийская, лихорадка гибралтарская, лихорадка средиземноморская, лихорадка ундулирующая, болезнь Банга, болезнь Брюса, мелитококкоз, мелитококция) — зоонозная инфекционная болезнь с многообразными механизмами передачи возбудителя, характеризующаяся лихорадкой, поражением опорно-двигательного аппарата, нервной системы, половых органов.
Этиология. Возбудители — представители рода Brucella семейства Brucellaceae. Бруцеллёз человека может быть обусловлен четырьмя видами бруцелл: B. melitensis, В. abortus, В. suis и B. canis. Наиболее частая причина болезни — Brucella melitensis, которая подразделяется на три биотипа. Основные хозяева — овцы и козы. Несколько реже встречаются Brucella abortus, представленные девятью биотипами; основной хозяин — крупный рогатый скот. У третьего вида бруцелл, Brucella suis, выделяют 4 биотипа. Основные хозяева — свиньи (типы 1–3), зайцы (тип 2) и северный олень (биотип 4). Относительно редко диагностируют заболевание, обусловленное Brucella canis. Основной хозяин данного микроорганизма — собаки. Бруцеллы отличаются выраженным полиморфизмом, они могут быть шаровидной, овальной и палочковидной формы. Размер их равен 0,3–0,6 мкм для кокквых и 0,6–2,5 мкм для палочковидных форм. Они неподвижны, спор не образуют, жгутиков не имеют, грамотрицательны. Растут медленно на сложных питательных средах. Бруцеллы — внутриклеточные паразиты, они антигенно однородны, содержат эндотоксин. Отличаются значительной изменчивостью и переходят из S-формы в K- и L-формы. Бруцеллы устойчивы в окружающей среде. В воде сохраняются свыше 2 мес, в молоке — 40 дней, в брынзе — 2 мес, в сыром мясе — 3 мес, в засоленном мясе — до 30 дней, в шерсти — до 4 мес. При кипячении погибают мгновенно, чувствительны к дезинфицирующим средствам, к антибиотикам тетрациклиновой группы, аминогликозидам, рифампицину, эритромицину.
Эпидемиология. Резервуар и источник возбудителя — домашние животные (овцы, козы, коровы, свиньи, реже собаки). Хотя к бруцеллёзу чувствительны дикие животные (зайцы, северные олени), природных очагов инфекции нет. Бруцеллёз распространён во многих странах мира (до 500 тыс. случаев в год), особенно в регионах с животноводческой ориентацией сельского хозяйства. В России бруцеллёз регистрируют в Республике Дагестан, Краснодарском и Ставропольском крае, на Южном Урале, Алтае, в Республике Тыва. Человек заражается от больных животных контактным, алиментарным, редко — аэрогенным путём. Заражение контактным путём носит профессиональный характер, особенно часто происходит при попадании на кожу околоплодной жидкости (помощь при отёлах, ягнении, при уходе за новорождёнными телятами, ягнятами). Часто заражаются ветеринарные работники, телятницы, чабаны и др. Заражение может наступить и при контакте с мясом инфицированных животных. Алиментарное заражение часто происходит при употреблении непастеризованного молока или приготовленных из него продуктов (брынза, сыр, масло). Аэрогенное заражение возможно при попадании в дыхательные пути пыли, содержащей бруцеллы (в местах выпаса и в загонах для содержания овец), а также в лабораториях при нарушении техники безопасности. Этот путь инфицирования наблюдают относительно редко. Чаще заболевают лица трудоспособного возраста (18–50 лет). Восприимчивость высокая. Инфицирующая доза составляет всего от 10 до 100 микробных тел. Постинфекционный иммунитет ненапряжённый, через 5–6 лет возможна реинфекция.
Патогенез. Входные ворота инфекции — микротравмы кожи, слизистые оболочки органов пищеварения и респираторного тракта. В месте внедрения возбудителя изменений не наблюдают. По лимфатическим путям бруцеллы достигают регионарных лимфатических узлов, но и здесь выраженные изменения отсутствуют. Размножение и накопление бруцелл происходит преимущественно в лимфатических узлах, из которых они периодически поступают в кровь, а гибель сопровождается освобождением эндотоксина, вызывающего лихорадку, поражение вегетативной нервной системы. С кровотоком возбудитель разносится по всему организму, концентрируясь в органах и тканях, богатых макрофагами (печень, селезёнка, мышцы, фасции, суставные сумки, сухожилия), где вследствие незавершённого фагоцитоза длительно сохраняется, вызывает воспалительную реакцию с образованием специфических гранулём. Для бруцеллёза характерна выраженная аллергическая перестройка организма, резко выражена ГЗТ, сохраняющаяся длительное время даже после освобождения организма от возбудителя. Аллергия играет большую роль в формировании вторичных очагов инфекции. Бруцеллёз отличается склонностью к хроническому течению, что связано с длительным персистированием бруцелл в организме. До введения в лечебную практику антибиотиков бруцеллы сохранялись в организме до двух лет, более длительное течение болезни связано с влиянием антибиотиков: часть бруцелл может переходить в L-формы и длительно сохраняется внутриклеточно.
Клиника. Инкубационный период при остром начале бруцеллёза продолжается около 3 нед, однако если бруцеллёз начинается как первично-латентный, который затем переходит в клинически выраженную форму, то инкубация может длиться несколько месяцев. Многообразие клинических проявлений болезни обусловило необходимость разработать классификацию клинических форм. Н.И. Рагоза показал фазность динамики бруцеллёзного процесса. Он выделил четыре фазы: · компенсированной инфекции (первично-латентная); · острого сепсиса без местных поражений (декомпенсация), · подострого или хронического рецидивирующего заболевания с образованием местных поражений (декомпенсация или субкомпенсация); · восстановления компенсации с остаточными явлениями или без них. С этими фазами тесно связаны и выделены пять клинических форм бруцеллёза: · первично-латентная; · остросептическая; · первично-хроническая метастатическая; · вторично-хроническая метастатическая; · вторично-латентная. В качестве отдельного варианта выделена септико-метастатическая форма, к которой относят те случаи, когда на фоне остросептической формы обнаруживают отдельные очаговые изменения (метастазы). В классификации показана динамика дальнейшего развития каждой выделенной формы. Первично-латентная форма бруцеллёза характеризуется состоянием практического здоровья. Включение её в классификацию клинических форм обусловлено тем, что при ослаблении защитных сил организма она может перейти или в остросептическую или в первично-хроническую метастатическую форму. При тщательном обследовании лиц с этой формой бруцеллёзной инфекции иногда можно обнаружить микросимптомы в виде небольшого увеличения периферических лимфатических узлов, субфебрилитета, повышенной потливости при физическом напряжении. Однако эти лица считают себя здоровыми и полностью сохраняют работоспособность. Остросептическая форма характеризуется высокой лихорадкой (39–40 °С и выше), температурная кривая имеет в ряде случаев тенденцию к волнообразному течению, нередко неправильного (септического) типа с большой суточной амплитудой, повторными приступами озноба и пота. Несмотря на высокую и очень высокую температуру тела, самочувствие больного остаётся удовлетворительным (при температуре 39 °С и выше больной может читать, смотреть телевизор и т.д.). Отсутствуют и другие признаки общей интоксикации. Характерно умеренное увеличение всех групп лимфатических узлов, некоторые из них чувствительны при пальпации. К концу первой недели болезни часто увеличиваются печень и селезёнка. При исследовании периферической крови отмечается лейкопения, СОЭ не повышена. Главное отличие этой формы — отсутствие очаговых изменений (метастазов). Без антибиотикотерапии лихорадка может длиться 3–4 нед и более. Эта форма не угрожает жизни больного и даже без этиотропного лечения заканчивается выздоровлением. В связи с этим остросептическую форму бруцеллёза нельзя считать сепсисом, а нужно рассматривать как один из вариантов бруцеллёза. Хронические формы бруцеллёза в одних случаях развиваются сразу, минуя острую фазу, в других случаях признаки хронического бруцеллёза появляются спустя какое-то время после остросептической формы бруцеллёза. По клиническим проявлениям первично- и вторично-хронические метастатические формы бруцеллёза ничем не различаются. Единственное отличие — наличие или отсутствие остросептической формы в анамнезе. Клинически хронические формы характеризуются синдромом общей интоксикации, на фоне которой наблюдают ряд органных поражений. Отмечают длительный субфебрилитет, слабость, повышенную раздражительность, плохой сон, нарушение аппетита, снижение работоспособности. Почти у всех больных наблюдают генерализованную лимфаденопатию, причём наряду с относительно недавно появившимися увеличенными узлами (мягкие, чувствительные или болезненные при пальпации) отмечают мелкие, очень плотные безболезненные склерозированные лимфатические узлы (0,5–0,7 см в диаметре). Часто обнаруживают увеличение печени и селезёнки. На этом фоне выявляют органные поражения. Наиболее типично поражение опорно-двигательного аппарата. Больные жалуются на боли в мышцах и суставах, преимущественно в крупных. Для бруцеллёза характерен полиартрит, при каждом обострении в процесс вовлекаются новые суставы. Чаще поражаются коленный, локтевой, плечевой, тазобедренный суставы, редко — мелкие суставы кисти и стоп. Характерны периартрит, параартрит, бурсит, экзостозы. Суставы опухают, подвижность в них ограничена, кожа над ними, как правило, нормальной окраски. Нарушение подвижности и деформация суставов обусловлены разрастанием костной ткани. Поражается позвоночник, чаще в поясничном отделе. Для бруцеллёза типичен сакроилеит, диагностическая значимость его крайне велика, так как другие этиологические агенты вызывают его очень редко. При хронических формах бруцеллёза часто поражаются не только суставы, но и мышцы. Миозиты проявляются тупыми, продолжительными болями в поражённых мышцах, интенсивность их нередко связана с изменениями погоды. При пальпации, чаще в мышцах конечностей и поясницы, определяют более болезненные участки, а в толще мышц прощупывают болезненные уплотнения различных размеров и формы. Чаще они пальпируются в виде тяжей, валиков, реже имеют округлую или овальную форму. Со временем в одном участке изменения мышц проходят, но появляются воспалительные очаги в других мышечных группах. После введения специфического антигена (например, при постановке пробы Бюрне) болевые ощущения в области поражённых мышц заметно усиливаются, а иногда можно определить и увеличение размеров воспалительного инфильтрата. Помимо миозитов, у больных бруцеллёзом часто (до 50–60%) выявляют фиброзит (целлюлит), который может локализоваться в подкожной клетчатке на голенях, предплечьях и особенно часто на спине и пояснице. Размеры области фиброзитов (целлюлитов) колеблются от 5–10 мм до 3–4 см. Вначале их прощупывают в виде мягких овальных образований, болезненных или чувствительных при пальпации (иногда больные сами обращают внимание на их появление). В дальнейшем они уменьшаются в размерах, могут полностью рассосаться или склерозируются и остаются на длительное время в виде небольших плотных образований, безболезненных при пальпации. При обострениях возможно появление новых фиброзитов. Поражение нервной системы при хроническом бруцеллёзе проявляется чаще всего невритом, полиневритом, радикулитом. Поражение ЦНС (миелит, менингит, энцефалит, менингоэнцефалит) наблюдают редко, но эти осложнения протекают длительно и довольно тяжело. Изменения половой системы у мужчин выражены орхитом, эпидидимитом; снижена половая функция. У женщин наблюдают сальпингит, метрит, эндометрит. Возникает аменорея, может развиться бесплодие. У беременных часты аборты, мертворождения, преждевременные роды. Описан врождённый бруцеллёз у детей. Иногда наблюдают поражения глаз (ирит, хориоретинит, увеит, кератиты, атрофия зрительного нерва и др.). При аэрогенном заражении часто развиваются вялотекущие бруцеллёзные пневмонии, которые безуспешно лечатся антибиотиками. Возможны миокардит, эндокардит, аортит и другие поражения сердечно-сосудистой системы. Вторично-хроническая форма протекает так же, как и первично-хроническая. И та и другая заканчивается переходом во вторично-латентную форму, может неоднократно рецидивировать. Вторично-латентная форма отличается от первично-латентной тем, что она значительно чаще переходит в манифестные формы (рецидивирует); кроме того, на фоне вторичной латенции возможно развитие различных резидуальных явлений после хронических форм (ограничение подвижности суставов, бесплодие, нарушение зрения и т.д.). Течение бруцеллёза зависит от вида возбудителя. При овечьем бруцеллёзе (Brucella melitensis) болезнь чаще начинается с остросептической формы и протекает тяжелее, при заражении от коров (Brucella abortus) часто возникает как первично-хроническая метастатическая или даже как первично-латентная форма. Однако нужно учитывать, что при совместном содержании скота (овец и коров) иногда отмечают инфицирование коров от овец, и тогда человек заражается от коров Brucella melitensis. Осложнения, вызванные вторичной флорой, редки.
Осложнения. Полиартрит с развитием контрактур (тугоподвижности суставов), спондилёз — заболевание позвоночника, связанное с изменениями костной ткани по краям тел позвонков; острая почечная недостаточность — уменьшение объёма или отсутствие мочи, слабость, тошнота, боли в животе, повышение артериального давления, увеличение уровня креатинина в крови и др.; менингит, менингоэнцефалит, полиневрит — мозговая симптоматика, боли в области иннервации поражённых нервов;миокардит, эндокардит — тахикардия, боли в области сердца, изменения ЭКГ; пневмония — кашель, одышка, боли в грудной клетке, изменения рентгенограммы органов грудной клетки; поражения глаз — ирит, иридоциклит, увеит; абсцесс печени — нарастающие боли в правом подреберье, гектическая лихорадка (с большими и быстрыми подъёмами и падениями температуры); отит — боли в ухе, снижение слуха, головокружения; у детей может наблюдаться артериальная гипертензия, панкреатит, холецистит; синдром Кавасаки — сочетание миокардита, водянки желчного пузыря и синдрома экзантемы (покраснение и припухлость ладоней и подошв с последующим чешуйчатым шелушением кожи или поверхности органа)
Диагностика. Стандарты обследования: общий анализ крови, мочи (в динамике два раза), кал на яйца глистов, биохимическое исследование крови (концентрация билирубина, активность АЛТ, АСТ), кровь на Brucellae spp., анализ крови на реакцию Райта, РПГА с бруцеллёзным эритроцитарным диагностикумом, реакция Кумбса (в динамике два раза), проба Бюрне, ЭКГ, УЗИ внутренних органов, рентгенография позвоночника, суставов, консультация врача-офтальмолога, невролога (по показаниям). При диагностике бруцеллёза учитывают эпидемиологические предпосылки. Во многих районах средней полосы и юго-запада России у животных бруцеллёз давно уже ликвидирован — следовательно, условия для заражения людей отсутствуют. В этих регионах бруцеллёз — «завозная» инфекция. Необходимо уточнить пребывание в местах, где бруцеллёз ещё встречают. Но иногда заражение происходит через продукты, инфицированные бруцеллами (брынза домашнего изготовления, молоко и др.). Лабораторное подтверждение бруцеллёза ограничено, поскольку бруцеллы относятся к опасным возбудителям. Их выделение можно проводить только в специальных лабораториях, оборудованных в соответствии с требованиями профилактики. При серологических и аллергологических исследованиях необходимо учитывать, что у привитых против бруцеллёза (прививают группы риска, профессионально контактирующие с животными) довольно долго могут быть положительными результаты и серологических реакций, и особенно аллергических проб. Из серологических реакций наиболее информативна РА (реакция Райта). Она предложена для выявления лиц, подлежащих обследованию на бруцеллёз, при массовых обследованиях по эпидемиологическим показаниям.. При остросептической форме бруцеллёза антитела можно определить на 2-й неделе болезни, в дальнейшем титр их нарастает. Аллергическая проба становится положительной в конце первой и на 2-й неделе. При хронических формах нарастания титра антител часто не обнаруживают. Следует учитывать, что постановка аллергической пробы (проба Бюрне) может спровоцировать появление антител или нарастание их титра. Другие серологические реакции: РПГА, острофазовые реакции — менее информативны по сравнению с реакцией Райта и не имеют существенного значения. В последние годы применяют более чувствительный метод ИФА для определения IgG- и IgM-антител. Отрицательные результаты пробы Бюрне позволяют исключить бруцеллёз (кроме ВИЧ-инфицированных, у которых исчезают все реакции ГЗТ).
Лечение. Длительность госпитализации составляет 26 дней для больных острым бруцеллёзом и 30 дней — хроническим. Комплекс терапии включает антибактериальную терапию, нестероидные противовоспалительные средства (НПВС), глюкокортикоиды, десенсибилизирующую, дезинтоксикационную, вакцино-, иммуно-, физиотерапию и санаторно-курортное лечение. Антибактериальную терапию проводят при остросептической и других формах болезни при наличии лихорадочной реакции. Продолжительность лечения составляет 1,5 мес. Рекомендуют одну из схем: Доксициклин внутрь по 100 мг два раза в сутки + стрептомицин в/м по 1 г/сут (первые 15 дней); Доксициклин внутрь по 100 мг два раза в сутки + рифампицин внутрь по 600– 900 мг/сут в 1–2 приёма; Ко-тримоксазол внутрь по 960 мг два раза в сутки + рифампицин внутрь по 600 мг 1–2 раза в сутки или стрептомицин в/м по 1 г один раз в сутки. Эффективны также комбинации доксициклина с гентамицином и рифампицина с офлоксацином. В связи с высокой эффективностью антибиотиков вакцинотерапию применяют редко. Используют лечебную бруцеллёзную вакцину. Лечебная бруцеллёзная вакцина — взвесь бруцелл овечьего и бычьего вида, инактивированных (для внутрикожного введения) либо убитых нагреванием (для внутривенного введения), выпускается в ампулах с точным указанием количества микробных клеток в 1 мл. Стандартная концентрация лечебной бруцеллёзной вакцины — 1 млрд микробных клеток в 1 мл вакцины. Рабочая концентрация предусматривает 500 тыс. микробных клеток в 1 мл. С целью десенсибилизации при всех формах бруцеллёза применяют антигистаминные препараты (хлоропирамин, мебгидролин, прометазин). При поражении опорно-двигательного аппарата (артрит, полиартрит) показаны НПВС: диклофенак, ибупрофен, индометацин, мелоксикам, нимесулид и др. При неэффективности НПВС их сочетают с глюкокортикоидами (преднизолон, дексаметазон, триамцинолон) в средних терапевтических дозах (30–40 мг преднизолона перорально) со снижением дозы через 3–4 дня. Продолжительность курса лечения 2–3 нед. Глюкокортикоиды показаны также при поражении нервной системы, орхитах. Хронические формы болезни, протекающие с обострением, при наличии изменений в иммунном статусе указывают на иммуносупрессию. Это показание к назначению иммуномодуляторов (имунофан, полиоксидоний и др.). При поражениях опорно-двигательного аппарата и периферической нервной системы рекомендуют физиотерапию (индуктотерапия, электрофорез новокаина, лидазы, димексида; ультравысокочастотная терапия, ионогальванотерапия, применение озокерита, парафиновых аппликаций, массаж, лечебная гимнастика и др.). После того как признаки активности процесса изчезают, назначают бальнеотерапию. Преимущество отдают местным курортам. При нейровегетативных нарушениях показаны гидрокарбонатные, гидросульфатно-сероводородные, радоновые воды. При поражениях опорно-двигательного аппарата и периферической нервной системы эффективна грязетерапия.
Профилактика. Основное направление — профилактика бруцеллёза у сельскохозяйственных животных: предупреждение заноса в благополучные хозяйства, систематические обследования и выбраковка больных животных в неблагополучных хозяйствах, вакцинация животных, гигиеническое содержание и дезинфекция помещений, в которых находятся животные. Лица, ухаживающие за ними, должны носить спецодежду, систематически обследоваться на бруцеллёз. Обязательны пастеризация молока, выдерживание брынзы не менее 2 мес, а твёрдых сыров — 3 мес. Работникам животноводства (а по показаниям — населению неблагополучных районов) вводят бруцеллёзную сухую живую вакцину (надкожно в объёме 2 капель или подкожно — 5 мл). Ревакцинацию проводят в половинной дозе через 10–12 мес.
38. Лептоспироз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Лептоспироз (болезнь Васильева–Вейля, инфекционная желтуха, японская 7-дневная лихорадка, нанукаями, водная лихорадка, иктерогеморрагическая лихорадка и др.) — острая зоонозная природно-очаговая инфекционная болезнь с преимущественно водным путём передачи возбудителя, характеризующаяся общей интоксикацией, лихорадкой, поражением почек, печени, ЦНС, геморрагическим диатезом и высокой летальностью. Лептоспироз регистрируется во всех регионах, кроме Арктики и Антарктиды, и является одним из самых распространенных зоонозов в мире, особенно в тропических странах. Заболеваемость (инцидентность) человека лептоспирозом высокая. Более половины случаев в мире протекает в тяжёлой форме.
Этиология. Род Leptospira семейства Leptospiraceae представлен двумя видами: паразитическим — L. interrogans и сапрофитным — L. biflexa. Оба вида подразделяют на многочисленные серотипы. Последние — основная таксономическая единица, формирующая серологические группы. В основу классификации лептоспир положено постоянство их антигенной структуры. На сегодняшний день известно 25 серогрупп, объединяющих около 200 патогенных серотипов лептоспир. Возбудитель лептоспироза человека и животных относят к виду L. interrogans. Лептоспиры — тонкие, подвижные микроорганизмы спиралевидной формы. Оба конца лептоспир, как правило, загнуты в виде крючьев, но встречаются и бескрючковые формы. Лептоспиры имеют три основных структурных элемента: наружную оболочку, осевую нить и цитоплазматический цилиндр, который винтообразно закручен вокруг продольной оси. Размножаются они путём поперечного деления. Лептоспиры грамотрицательны. Это строгие аэробы; их выращивают на питательных средах, содержащих сыворотку крови. Оптимум роста 27–30 °С, однако и в таких условиях они растут чрезвычайно медленно. Факторы патогенности лептоспир — экзотоксиноподобные вещества, эндотоксин, ферменты (фибринолизин, коагулаза, липаза и др.), а также инвазивная и адгезивная способность. Лептоспиры чувствительны к воздействию высоких температур: кипячение их убивает мгновенно, нагревание до 56–60 °С — в течение 20 мин. К действию низких температур лептоспиры более устойчивы. Так, при –30–70 °С и в замороженных органах они сохраняют жизнеспособность и вирулентность в течение многих месяцев. Жёлчь, желудочный сок и кислая моча человека губительно действуют на лептоспиры, а в слабощелочной моче травоядных они остаются жизнеспособными в течение нескольких суток. В воде открытых водоёмов при слабощелочной или нейтральной её реакции лептоспиры сохраняются в течение 1 мес, а в сырой и переувлажнённой почве они не теряют патогенность до 9 мес. На пищевых продуктах лептоспиры сохраняются до 1–2 сут, а под воздействием ультрафиолета и при высушивании погибают в течение 2 ч. Лептоспиры чувствительны к препаратам пенициллина, хлорамфениколу, тетрациклину и чрезвычайно чувствительны к действию обычных дезинфицирующих средств, кипячению, солению и маринованию. При этом низкие температуры не оказывают губительного воздействия на лептоспиры. Этим объясняют их способность зимовать в открытых водоёмах и влажной почве, полностью сохраняя вирулентность.
Эпидемиология. Лептоспироз — одна из самых распространённых природно-очаговых инфекционных болезней. Источник возбудителя инфекции — дикие, сельскохозяйственные и домашние животные. Роль отдельных видов животных как источника лептоспирозной инфекции далеко не одинакова в связи с различной степенью чувствительности их к этим микроорганизмам и с характером ответной реакции на заражение. Животные, у которых в результате инфицирования возникает хронический, а в ряде случаев и бессимптомный процесс, сопровождаемый длительным выделением лептоспир с мочой, имеют наибольшее эпидемиологическое и эпизоотологическое значение. Именно эти животные обеспечивают сохранение лептоспир как биологического вида. Наибольшее значение в природных очагах лептоспироза отводят представителям отряда грызунов, а также насекомоядным (ежи, землеройки). Биологическая пластичность лептоспир обусловливает возможность адаптации их к сельскохозяйственным и домашним животным (крупный рогатый скот, свиньи, лошади, собаки), а также к синантропным грызунам (серые крысы, мыши), которые формируют антропургические очаги инфекции, представляющие основную опасность для человека. С эпидемиологической точки зрения важна заболеваемость крупного и мелкого рогатого скота, а также свиней. Болеют животные любого возраста, но у взрослых лептоспироз протекает чаще в скрытой форме, а у молодняка — с более выраженными симптома 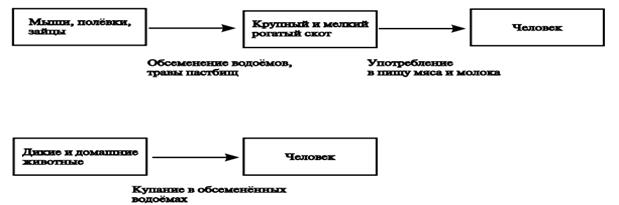
Человек не имеет значения в качестве источника инфекции. Основной фактор передачи возбудителя лептоспироза — вода, загрязнённая выделениями (мочой) инфицированных животных. Непосредственными причинами заражения людей оказывается употребление сырой воды для питья, умывание из открытых водоёмов, купание в небольших слабопроточных прудах или переход их вброд. Некоторое значение в передаче инфекции имеют и пищевые продукты, загрязнённые выделениями грызунов. Передача инфекции чаще всего происходит контактным путём, однако возможен и пищевой путь. Факторами передачи бывают и влажная почва, трава пастбищ, загрязнённые выделениями больных животных. Заражение может происходить при забое скота, разделке туш, а также при употреблении в пищу молока и термически не обработанного мяса. Зачастую лептоспирозом заболевают лица, имеющие профессиональный контакт с больными животными: ветеринары, дератизаторы и сельскохозяйственные работники. Для проникновения лептоспир достаточно малейших нарушений целостности кожного покрова. Эпидемические вспышки лептоспироза приурочены, как правило, к летне-осеннему периоду. Пик заболеваемости приходится на август. Различают три основных типа вспышек: водный, сельскохозяйственный и животноводческий. Лептоспироз встречают и в виде спорадических случаев, которые могут регистрироваться в течение всего года. Лептоспиры гидрофильны, поэтому для лептоспироза характерна высокая распространённость в областях, где много болотистых и сильно увлажнённых низменностей. Естественная восприимчивость людей к лептоспирозной инфекции значительна. Постинфекционный иммунитет прочный, но типоспецифический, поэтому возможны повторные заболевания, вызванные другими сероварами возбудителя.
Патогенез. Возбудитель проникает в организм человека благодаря своей подвижности. Входными воротами служат микроповреждения кожных покровов и слизистых оболочек полости рта, пищевода, конъюнктивы глаз и др. Известны случаи лабораторного заражения через повреждённую кожу. При внутрикожном проникновении в эксперименте на лабораторных животных лептоспиры проникают в кровь уже через 5–60 мин, очевидно, минуя лимфатические узлы, которые не выполняют барьерной функции при лептоспирозе. На месте внедрения возбудителя не возникает первичного аффекта. Дальнейшее распространение лептоспир происходит гематогенным путём, при этом лимфатические сосуды и регионарные лимфатические узлы также остаются интактными. С током крови лептоспиры попадают в различные органы и ткани: печень, селезёнку, почки, лёгкие, ЦНС, где происходят их размножение и накопление. Развивается первая фаза инфекции продолжительностью от 3 до 8 дней, что соответствует инкубационному периоду. Вторая фаза патогенеза лептоспироза — вторичная бактериемия, когда количество лептоспир в крови достигает максимума и они ещё продолжают размножаться в печени и селезёнке, надпочечниках, обусловливая клиническое начало болезни. С током крови лептоспиры снова разносятся по всему организму, преодолевая даже ГЭБ. В этот период наряду с размножением лептоспир начинается их разрушение как следствие появления антител, агглютинирующих к четвёртому дню болезни и лизирующих лептоспиры. Накопление в организме продуктов метаболизма и распада лептоспир сопровождается лихорадкой и интоксикацией, что повышает сенсибилизацию организма и вызывает гиперергические реакции. Эта фаза продолжается в течение 1 нед, однако может укорачиваться до нескольких дней. Максимальную концентрацию лептоспир к концу фазы лептоспиремии наблюдают в печени. Лептоспиры продуцируют гемолизин, который, оказывая влияние на мембрану эритроцитов, вызывает их гемолиз и высвобождение свободного билирубина. Кроме того, в печени развиваются деструктивные изменения с формированием воспаления и отёка ткани. При тяжёлом течении болезни основной фактор патологического процесса в печени — поражение мембран кровеносных капилляров, чем и объясняют наличие кровоизлияний и серозного отёка. Патогенез желтухи при лептоспирозе носит двоякий характер: с одной стороны, распад эритроцитов вследствие токсического воздействия на мембраны гемолизина и гемолитического антигена, а также в результате эритрофагии клетками ретикулоэндотелиальной системы в селезёнке, печени и других органах, с другой — вследствие развивающегося паренхиматозного воспаления с нарушением желчеобразующей и выделительной функции печени. Третья фаза патогенеза лептоспироза — токсическая. Лептоспиры гибнут вследствие бактерицидного действия крови и накопления антител, исчезают из крови и накапливаются в извитых канальцах почек. Накопленный вследствие гибели лептоспир токсин оказывает токсическое влияние на различные органы и системы. У части больных лептоспиры размножаются в извитых канальцах и выделяются из организма с мочой. В этом случае на первый план выступает поражение почек. Наиболее характерное поражение почек при лептоспирозе — дегенеративный процесс в эпителии канальцевого аппарата, поэтому их правильнее рассматривать как диффузный дистальный тубулярный нефроз. У больных появляются признаки ОПН с олигоанурией и уремической комой. Тяжёлое поражение почек — одна из наиболее частых причин смерти при лептоспирозе. В фазе токсемии повреждение органов и тканей обусловлено действием не только токсина и продуктов жизнедеятельности лептоспир, но и аутоантител, образующихся в результате распада поражённых тканей и клеток макроорганизма. Этот период совпадает со второй неделей болезни, но может несколько затягиваться. Токсин оказывает повреждающее действие на эндотелий капилляров, что повышает их проницаемость с формированием тромбов и развитием ДВС-синдрома. ЦНС поражается вследствие преодоления ГЭБ лептоспирами. У части больных развивается серозный или гнойный менингит, реже менингоэнцефалит. В отдельных случаях возникает специфический лептоспирозный миокардит. Патогномоничный симптом лептоспироза — развитие миозита с поражением скелетных, особенно икроножных мышц. Часто поражаются лёгкие (лептоспирозная пневмония), глаза (ириты, иридоциклиты), реже другие органы.
Клиника. Инкубационный период продолжается от 3 до 30 (чаще 7–10) дней. Болезнь начинается остро, без продромального периода, с сильного озноба, повышения температуры тела в течение 1–2 дней до высоких цифр (39–40 °С). Температура остаётся высокой в течение 6–10 дней, затем происходит её снижение или критически, или укороченным лизисом. У больных, не получавших антибиотики, можно наблюдать вторую лихорадочную волну. Возникают и другие симптомы интоксикации, такие, как сильная головная боль, боль в пояснице, слабость, отсутствие аппетита, жажда, тошнота, иногда рвота. В этот период также может развиться конъюнктивит. Характерный признак лептоспироза — боль в мышцах, преимущественно икроножных, но может возникать боль в мышцах бедра и поясничной области. При тяжёлых формах боль настолько сильна, что затрудняет движения больного. При пальпации отмечают резкую болезненность мышц. Интенсивность миалгий часто соответствует тяжести течения болезни. Миолиз приводит к развитию миоглобинемии, являющейся одной из причин развития ОПН. У части больных миалгию сопровождает гиперестезия кожи. Обращают на себя внимание гиперемия кожи лица и шеи, инъекция сосудов склер. При осмотре выявляют «симптом капюшона» — одутловатость лица и гиперемию кожи лица, шеи и верхней половины грудной клетки, инъекцию сосудов склер. При тяжёлом течении лептоспироза с 4–5-го дня болезни возникают иктеричность склер и желтушность кожных покровов. Клиническое течение можно схематично разделить на три периода: · начальный; · разгара; · выздоровления. У 30% больных в начальном, а иногда и в периоде разгара болезни возникает экзантема. Сыпь состоит из полиморфных элементов, расположенных на коже туловища и конечностей. По характеру сыпь может быть кореподобной, краснухоподобной, реже скарлатиноподобной. Могут встречаться и уртикарные элементы. Макулёзная сыпь склонна к слиянию отдельных элементов. В этих случаях образуются эритематозные поля. Эритематозную экзантему встречают наиболее часто, сыпь исчезает через 1–2 дня. После исчезновения сыпи возможно отрубевидное шелушение кожи. Нередко появляются герпетические высыпания (на губах, крыльях носа). Тромбогеморрагический синдром проявляется, помимо петехиальной сыпи, кровоизлияниями в кожу на местах инъекций, носовыми кровотечениями, кровоизлияниями в склеру. В этот период возможны небольшая боль в горле, покашливание. При объективном исследовании нередко обнаруживают умеренную гиперемию дужек, миндалин, мягкого нёба, на котором можно увидеть энантему, кровоизлияния. У части больных увеличиваются поднижнечелюстные, задние шейные лимфатические узлы. Со стороны сердечно-сосудистой системы обращают на себя внимание относительная брадикардия, снижение АД. Тоны сердца приглушены, при ЭКГ можно обнаружить признаки диффузного поражения миокарда. Возможно развитие специфической лептоспирозной пневмонии или бронхита. При её возникновении наблюдают притупление лёгочного звука и боль в грудной клетке. Печень увеличена, умеренно болезненна при пальпации, почти у половины больных пальпируется селезёнка. Признаками поражения ЦНС при лептоспирозе служат менингеальный синдром: головокружение, бред, бессонница, головная боль и положительные менингеальные симптомы (ригидность затылочных мышц; симптом Кернига; верхний, средний и нижний симптомы Брудзинского). При исследовании цереброспинальной жидкости отмечают признаки серозного менингита: цитоз с преобладанием нейтрофилов. Со стороны мочевыделительной системы можно наблюдать признаки ОПН: снижение диуреза вплоть до развития олигоанурии, появление в моче белка, гиалиновых и зернистых цилиндров, почечного эпителия. В крови увеличено содержание калия, мочевины, креатинина. При исследовании периферической крови определяют повышение СОЭ и нейтрофильный лейкоцитоз со сдвигом формулы влево, нередко до миелоцитов, анэозинофилию. В разгаре болезни с 5–6-го дня в тяжёлых случаях нарастает интоксикация, усиливаются головная боль, мышечная слабость, появляется отвращение к пище, учащается рвота, хотя температура тела снижается. У части больных возникает желтуха, интенсивность которой соответствует тяжести течения болезни и которая длится от нескольких дней до нескольких недель. В этот период наблюдают наиболее тяжёлые проявления геморрагического синдрома: кровоизлияния в кожу и слизистые оболочки, кровотечения из дёсен, желудочно-кишечные кровотечения, кровохарканье, кровоизлияния в оболочки и вещество головного мозга. Чаще геморрагический синдром наблюдают при желтушной форме болезни. Возникают клинические и ЭКГ-признаки поражения сердца, оболочек мозга. Особого внимания заслуживает поражение почек: нарастающая азотемия, протеинурия. В результате гемолиза и нарушения эритропоэза нарастают анемия гипорегенераторного типа, тромбоцитопения, лейкоцитоз, лимфопения, нарушается агрегационная способность тромбоцитов, СОЭ достигает 40–60 мм/ч. При биохимическом исследовании крови выявляют умеренную гипербилирубинемию с повышенным содержанием как связанного, так и свободного билирубина при небольшом повышении активности трансфераз. В то же время в связи с поражением мышц резко возрастает активность креатинфосфокиназы, нарушается белковосинтетическая функция печени, снижается уровень альбумина. Состояние начинает улучшаться с конца второй недели, период реконвалесценции с 20–25-го дня болезни. В этот период возможен рецидив болезни, который обычно протекает легче основной волны. В остальных случаях температура тела стойко нормализуется, но длительно сохраняется астенический синдром, возможен полиурический криз. Функции печени и особенно почек восстанавливаются медленно, длительно сохраняется недостаточность функции канальцев, что проявляется изогипостенурией и протеинурией; возможны трофические нарушения, нарастание анемии. В различных регионах течение может иметь различия по частоте желтушных форм, поражению ЦНС, развитию ОПН. Наиболее тяжело протекает лептоспироз, вызванный L. interrogans icterohaemorragiae. Повсеместны абортивные и стёртые формы болезни, протекающие с кратковременной (2–3 дня) лихорадкой без типичной органной патологии.
Осложнения. ИТШ, ОПН, острая печёночно-почечная недостаточность, ОДН (РДС), массивные кровотечения, кровоизлияния, миокардит, пневмония, в поздние сроки — увеит, ирит, иридоциклит.
Диагностика. Важную роль в диагностике лептоспироза играет эпиданамнез. Следует учитывать профессию больного (сельскохозяйственный рабочий, охотник, ветеринар, дератизатор), а также контакт с дикими и домашними животными. Следует обратить внимание на то, купался ли пациент в открытых водоёмах, поскольку обсеменение воды лептоспирами в отдельных регионах чрезвычайно велико. Диагноз лептоспироза устанавливают на основании характерных клинических симптомов: острое начало, гипертермия, миалгия, гиперемия лица, сочетанное поражение печени и почек, геморрагический синдром, островоспалительные изменения в крови. Лабораторное подтверждение диагноза получают при бактериоскопическом, бактериологическом, биологическом и серологическом исследованиях. В первые дни болезни лептоспиры обнаруживают в крови с помощью темнопольной микроскопии, позднее в осадке мочи или СМЖ. При посеве крови, мочи или СМЖ на питательные среды, содержащие сыворотку крови, удаётся получить более достоверные результаты, хотя этот метод требует времени, поскольку, как уже было сказано, лептоспиры растут довольно медленно. Первичные посевы крови, мочи, тканей органов, подозрительных на содержание лептоспир, рекомендуют выдерживать первые 5–6 дней при температуре 37 °С, а затем при 28–30 °С. Биологический метод заключается в заражении животных: мышей, хомяков и морских свинок, однако в последнее время у этого метода появилось много противников, считающих его негуманным. Наиболее информативны серологические методы, в частности реакция микроагглютинации, рекомендованная ВОЗ. Положительным считают нарастание титра антител 1:100 и выше. Используют также РАЛ лептоспир в голландской модификации. Антитела появляются поздно, не ранее 8–10-го дня болезни, поэтому целесообразно исследовать парные сыворотки, взятые с интервалом в 7–10 сут.
Лечение. Лечение осуществляют в условиях стационара. Госпитализацию проводят по эпидемиологическим показаниям. Режим в остром периоде постельный. Диету определяют клинические особенности болезни. При доминировании почечного синдрома — стол № 7, печёночного — стол № 5, при сочетанных поражениях — стол № 5 с ограничением соли или стол № 7 с ограничением жиров. Этиотропная терапия. Из антибиотиков препаратами выбора являются пенициллины: бензилпенициллина натриевая соль 6–8 млн ЕД/сут (6–8- кратное внутримышечное введение) до 3–5 дня нормальной температуры. Эффективны ампициллин или ампиокс 4–9 г/сут (4–6 раз), цефотаксим по 4 г/сут (4 раза), левомицетин-сукцинат натрия 3 г/сут (3 раза). Необходимо помнить, что аминогликозиды, тетрациклины и макролиды (особенно в больших дозах) нефро- и гепатотоксичны, поэтому назначение их при лептоспирозе нежелательно. В случаях лептоспирозного менингита дозу пенициллина устанавливают до 18–20 млн ЕД/сут и вводят одновременно внутримышечно и внутривенно до снижения плеоцитоза до 33 клеток в 1 мл. Противолептоспирозный гетерологичный g-глобулин вводят внутримышечно по Безредко в дозе 5–10 мл в день в течение 3 сут (5 мл при легком течении болезни, 10 мл – при средней тяжести и тяжелом). Патогенетическая терапия предполагает дезинтоксикацию, коррекцию метаболизма, поддержание функции жизненно важных органов.
Профилактика. Профилактику осуществляют совместно органы Роспотребнадзора и ветеринарной службы. Проводят выявление и лечение ценных животных, регулярную дератизацию населённых мест, охраняют водоёмы от загрязнения выделениями животных, запрещают купание в непроточных водоёмах, обеззараживают воду из открытых источников воды, борются с бездомными собаками. Проводят вакцинацию сельскохозяйственных животных и собак, плановую вакцинацию лиц, работа которых связана с риском заражения лептоспирозом: работников животноводческих хозяйств, зоопарков, зоомагазинов, собачьих питомников, звероводческих хозяйств, предприятий по переработке животноводческого сырья, сотрудников лабораторий, работающих с культурами лептоспир. Вводят вакцину для профилактики лептоспироза с 7 лет в дозе 0,5 мл подкожно однократно, ревакцинация через год.
39. Клещевой энцефалит: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Клещевой энцефалит (весенне-летний энцефалит, таёжный энцефалит, русский энцефалит, дальневосточный энцефалит, клещевой энцефаломиелит) — природно-очаговая вирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, характеризующаяся лихорадкой и преимущественным поражением ЦНС.
Этиология. Вирус клещевого энцефалита принадлежит к семейству Flaviviridae. Вирус состоит из нуклеокапсида с кубическим типом симметрии и покрыт оболочкой. Нуклеокапсид содержит РНК и протеин С (core). Оболочка состоит из двух гликопротеидов (мембранного М, оболочечного Е) и липидов. На основе анализа гомологии фрагмента гена, кодирующего белок Е, выделяют пять основных генотипов вируса: генотип 1 — дальневосточный вариант; генотип 2 — западный (центрально-европейский) вариант; генотип 3 — греко-турецкий вариант; генотип 4 — восточно-сибирский вариант; генотип 5 — урало-сибирский вариант. Генотип 5 — самый распространённый, обнаружен на большей части ареала вируса клещевого энцефалита. Вирус культивируют в куриных эмбрионах и культурах тканей различного происхождения. При длительном пассировании патогенность вируса снижается. Среди лабораторных животных наиболее чувствительны к заражению вирусом белые мыши, сосунки крыс, хомяки и обезьяны, среди домашних животных — овцы, козы, свиньи, лошади. Вирус в неодинаковой степени устойчив к различным факторам внешней среды: при кипячении погибает в течение 2–3 мин, легко разрушается при пастеризации, обработке растворителями и дезинфектантами, но способен длительно сохранять жизнеспособность при низких температурах, в высушенном состоянии. Вирус достаточно долго сохраняется в таких продуктах питания, как молоко или масло, которые иногда могут быть источниками инфицирования. Вирус устойчив к действию низких концентраций соляной кислоты, поэтому возможен пищевой путь заражения.
Эпидемиология. Клещевой энцефалит — природно-очаговое заболевание. Штаммы центрально-европейского варианта распространены в Европе до территории Сибири. За Уральским хребтом преобладают урало-сибирский и восточно-сибирский генотипы вируса, на Дальнем Востоке — дальневосточный вариант. С генетическим разнообразием возбудителя, по всей видимости, связаны различия в клинической картине клещевого энцефалита в Европе, Сибири и на Дальнем Востоке. Основной резервуар и переносчик вируса в природе — иксодовые клещи Ixodes persulcatus, xodes ricinus с трансфазовой (личинка–нимфа–имаго) и трансовариальной передачей возбудителя. Дополнительные резервуары вируса — грызуны (бурундук, полевая мышь), зайцы, ежи, птицы (дрозд, щегол, чечётка, зяблик), хищники (волк, медведь), крупные дикие животные (лоси, олени). Восприимчивы к вирусу клещевого энцефалита и некоторые сельскохозяйственные животные, среди которых наиболее чувствительны козы. В связи с тем, что круг резервуарных хозяев достаточно широк, происходит непрерывная циркуляция вируса в природе. Клещ заражается вирусом при укусе млекопитающих, находящихся в вирусемической фазе. Основной путь инфицирования человека — трансмиссивная передача через укусы клещей. Риск инфицирования людей тесно связан с активностью клещей. Сезонный пик этой активности зависит от климатических особенностей географических регионов, но максимален весной и летом (с апреля до августа). Чаще болеют лица в возрасте 20–60 лет. В структуре заболевших в настоящее время преобладают городские жители. Возможна также передача вируса алиментарным путём (при употреблении в пищу сырого молока коз и коров), а также в результате раздавливания клеща при его удалении с тела человека и, наконец, аэрозольным путём при нарушении условий работы в лабораториях. Восприимчивость к клещевому энцефалиту высокая, независимо от пола и возраста, особенно среди лиц, впервые посещающих природный очаг. У коренных жителей преобладают субклинические формы инфекции (один клинический случай на 60 инаппарантных). Иммунитет после перенесённого клещевого энцефалита стойкий, пожизненный. В крови переболевших в течение всей жизни сохраняются вируснейтрализующие антитела. Больной как источник инфекции для окружающих не опасен.
Патогенез. После внедрения вирус локально размножается в клетках кожи. На месте укуса в тканях развиваются дегенеративно-воспалительные изменения. При алиментарном пути заражения фиксация вируса происходит в эпителиальных клетках ЖКТ. Первая волна вирусемии (транзиторная) обусловлена проникновением вируса в кровь из мест первичной локализации. В конце инкубационного периода возникает вторая волна вирусемии, совпадающая по времени с началом размножения вируса во внутренних органах. Заключительная фаза — внедрение и репликация вируса в клетках ЦНС и периферической нервной системы. «Плюс-нитевая» РНК вируса клещевого энцефалита способна непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е. выполнять функции мРНК. Вирусом клещевого энцефалита в ЦНС поражено преимущественно серое вещество, вследствие чего развивается полиоэнцефалит. Наблюдаемые поражения неспецифичны и включают клеточное воспаление, гиперплазию, глиальную пролиферацию и некроз нейронов. Прогредиентные формы клещевого энцефалита связывают с длительным сохранением вируса в активной форме в клетках ЦНС. В развитии персистирующей инфекции значительную роль отводят мутантным формам вируса.
Клиника. Инкубационный период при заражении через укус клеща составляет 5–25 (в среднем 7–14) дней, а при пищевом пути заражения — 2–3 дня. Заболевание, независимо от формы, в подавляющем большинстве случаев начинается остро. Редко возникает период продромы длительностью 1–3 дня. Лихорадочную форму клещевого энцефалита регистрируют в 40–50% случаев. У большинства больных заболевание начинается остро. Лихорадочный период длится от нескольких часов до 5–6 дней. В острый период болезни температура тела повышается до 38–40 °С и выше. Иногда наблюдают двухволновую и даже трёхволновую лихорадку. Больных беспокоят различной интенсивности головная боль, общая слабость, недомогание, озноб, чувство жара, потливость, головокружение, боль в глазных яблоках и светобоязнь, снижение аппетита, боли в мышцах, в костях, в позвоночнике, в области верхних и нижних конечностей, в пояснице, в области шеи и в суставах. Характерна тошнота, возможна рвота в течение одного или нескольких дней. Отмечают также инъекцию сосудов склер и конъюнктив, гиперемию лица, шеи и верхней половины туловища, выраженную гиперемию слизистых оболочек и ротоглотки. В ряде случаев отмечают бледность кожных покровов. Возможны явления менингизма. При этом воспалительные изменения в СМЖ отсутствуют. В большинстве случаев заболевание заканчивается полным клиническим выздоровлением. Однако у ряда пациентов после выписки из стационара сохраняется астеновегетативный синдром. Менингеальная форма — наиболее распространённая форма клещевого энцефалита. В структуре заболеваемости она составляет 50–60%. Клиническая картина характеризуется выраженным общеинфекционным и менингеальным симптомами. В большинстве случаев начало болезни острое. Температура тела повышается до высоких значений. Лихорадка сопровождается ознобом, чувством жара и потливостью. Характерна головная боль различной интенсивности и локализации. Отмечают анорексию, тошноту и частую рвоту. В некоторых случаях выражены миастения, боли в глазных яблоках, светобоязнь, шаткая походка и тремор рук. При осмотре выявляют гиперемию лица, шеи и верхней части туловища, инъекцию сосудов склер и конъюнктив. Менингеальный синдром при поступлении обнаруживают у половины больных. У остальных он развивается на 1–5-й день пребывания в стационаре. Выявляют преходящие нарушения, обусловленные внутричерепной гипертензией; асимметрию лица, анизокорию, недоведение глазных яблок кнаружи, нистагм, оживление или угнетение сухожильных рефлексов, анизорефлексию. Давление СМЖ, как правило, повышено (250–300 мм вод.ст.). Плеоцитоз составляет от нескольких десятков до нескольких сотен клеток в 1 мкл СМЖ. Преобладают лимфоциты, в ранние сроки могут преобладать нейтрофилы. Содержание глюкозы СМЖ нормальное. Изменения в СМЖ сохраняются сравнительно долго: от 2–3 нед до нескольких месяцев. Астеновегетативный синдром сохраняется дольше, чем при лихорадочной форме. Характерны раздражительность, плаксивость. Доброкачественное течение менингеальной формы клещевого энцефалита не исключает возможности развития в дальнейшем клинической картины хронической формы заболевания. Менингоэнцефалитическая форма отличается тяжёлым течением и высокой летальностью. Частота этой формы в отдельных географических регионах — от 5 до 15%. Для острого периода болезни характерны высокая температура, более выраженная интоксикация, выраженные менингеальные и общемозговые симптомы, а также признаки очагового поражения головного мозга. Характерны глубокие нарушения сознания вплоть до развития комы. У больных, поступавших в бессознательном и сопорозном состоянии, наблюдают двигательное возбуждение, судорожный синдром, мышечную дистонию, фибриллярные и фасцикулярные подергивания в отдельных мышечных группах. Часто обнаруживают нистагм. Характерно появление подкорковых гиперкинезов, гемипарезов, а также поражения черепных нервов: III, IV, V, VI пар, несколько чаще VII, IX, X, XI и XII пар. При стволовых поражениях появляются бульбарный, бульбопонтинный синдромы, реже — симптомы поражения среднего мозга. Отмечают нарушения глотания, поперхивание, гнусавый оттенок голоса или афония, паралич мышц языка, при распространении процесса на мост — симптомы поражения ядер VII и VI черепных нервов. Нередко выявляют лёгкие пирамидные знаки, повышение рефлексов, клонусы, патологические рефлексы. Поражения ствола мозга чрезвычайно опасны из-за возможного развития нарушений дыхания и сердечной деятельности. Бульбарные расстройства — одна из основных причин высокой смертности при менингоэнцефалитической форме клещевого энцефалита. При исследовании СМЖ обнаруживают лимфоцитарный плеоцитоз. Концентрация белка повышена до 0,6–1,6 г/л. Гемиплегия среди очаговых поражений нервной системы занимает особое место. В первые дни лихорадочного периода (чаще у лиц старшего возраста) развивается синдром гемиплегии по центральному типу, по течению и по локализации напоминающий сосудистые поражения нервной системы (инсульты). Эти нарушения часто нестойкие и уже в раннем периоде имеют тенденцию к обратному развитию. У 27,3–40,0% пациентов развивается астеновегетативный синдром. К остаточным явлениям относятся парезы лицевых нервов. Полиомиелитическая форма — самая тяжёлая форма инфекции. Наиболее часто встречалась в прежние годы, в настоящее время наблюдается у 1–2% больных. При этой форме высока инвалидизация больных. Неврологический статус характеризуется значительным полиморфизмом. У больных с полиомиелитической формой заболевания возможно внезапное развитие слабости в какой-либо конечности или появление онемения в ней. В дальнейшем в этих конечностях развиваются двигательные нарушения. На фоне лихорадки и общемозговых симптомов развиваются вялые парезы шейно-плечевой мускулатуры и верхних конечностей. Нередко парезы симметричны и охватывают всю мускулатуру шеи. Поднятая рука падает пассивно, голова свисает на грудь. Сухожильные рефлексы не вызываются. В конце второй недели развиваются атрофии поражённых мышц. Парезы и параличи нижних конечностей встречаются редко. Течение болезни всегда тяжёлое. Улучшение общего состояния наступает медленно. Лишь у половины больных умеренно восстанавливаются утраченные функции. В СМЖ выявляют плеоцитоз от нескольких сотен до тысячи клеток в 1 мкл. Остаточные явления при полиомиелитической форме характерны для всех больных. Отмечаются слабость мышц шеи и верхних конечностей, симптом «свисающей» головы, парез мышц верхних конечностей, гипотрофия мышц шеи, плечевого пояса, предплечий, межрёберных мышц. Полирадикулоневритическую форму диагностируют у 1–3% больных. Ведущие симптомы — мононевриты (лицевого и седалищного нервов), шейно-плечевой радикулоневрит, а также полирадикулоневрит с восходящим течением или без него. В клинической картине преобладают невралгии, корешковые симптомы, болезненность мышц и нервов, периферические параличи или парезы. У больных появляются боли по ходу нервных стволов, парестезии (чувство «ползания мурашек», покалывание). Двухволновая лихорадка встречается при всех формах заболевания, но чаще при менингеальной форме. Этот тип лихорадки более характерен для заболеваний, вызванных центрально-европейским и восточно-сибирским генотипами вируса. Для первой лихорадочной волны обязательно наличие выраженного инфекционно-токсического синдрома. Наблюдается острое начало, внезапное повышение температуры до 38–39 °С, сопровождающееся головной болью и общей слабостью. Спустя 5–7 дней состояние больных улучшается, температура тела нормализуется, но через несколько дней повторно повышается. Нередко на фоне второй волны у больных появляется менингеальный синдром. Хроническое прогредиентное течение наблюдают у 1–3% больных. Хронические формы возникают спустя несколько месяцев, а иногда и лет после острого периода болезни, преимущественно при менингоэнцефалитической, реже менингеальной формах болезни. Основная клиническая форма хронического периода — кожевниковская эпилепсия, которая выражается в постоянных миоклонических гиперкинезах, захватывающих прежде всего мышцы лица, шеи, плечевого пояса. Периодически, особенно при эмоциональном напряжении, происходит приступообразное усиление и генерализация миоклоний или переход их в большой тонико-клонический приступ с потерей сознания. Также наблюдается синдром хронического подострого полиомиелита, обусловленного медленно прогрессирующей дегенерацией периферических мотонейронов передних рогов спинного мозга, который клинически характеризуется нарастающими атрофическими парезами конечностей, в основном верхних, с постоянным снижением мышечного тонуса и сухожильных рефлексов. Гиперкинетический синдром характеризуется появлением спонтанных ритмичных мышечных сокращений в отдельных мышечных группах паретических конечностей уже в остром периоде болезни. Нередко прогредиентные формы сопровождаются нарушениями психики вплоть до деменции. Часто клинические симптомы носят смешанный характер, когда прогрессирование гиперкинезов сочетается с нарастающей амиотрофией и, иногда, психическими нарушениями. По мере нарастания тяжести симптомов больные инвалидизируются. В последние годы относительно редко наблюдают тяжёлые клинические формы острого периода, что не исключает развития в дальнейшем хронической прогредиентной формы болезни
Осложнения. Развитие эпилепсии после менингеальной формы, отек головного мозга с летальным исходом после менингоэнцефалитической формы, поражение черепно-мозговых нервов с развитием косоглазия, гнусавости голоса, затруднений глотания, речи, параличи мышц шеи, туловища и конечностей после полиомиелитоподобной формы, обездвиженность и атрофия мышц после полирадикулоневритической формы энцефалита и другие серьезные последствия.
Диагностика. Диагноз основан на анамнестических, клинико-эпидемиологических и лабораторных данных. Большое значение в эндемичных регионах придают посещению леса, парка, дачи в весенне-летний период, факту присасывания клеща, а также употреблению в пищу некипячёного козьего или коровьего молока. Ранние клинические диагностические признаки заболевания — повышение температуры тела до 39–40 °С, ознобы, головная боль, головокружение, тошнота, рвота, общая слабость, боли в мышцах, суставах, пояснице. При осмотре обращают внимание на наличие гиперемии лица, шеи и верхней части туловища, инъекцию сосудов склер, конъюнктивит и гиперемию ротоглотки. Больные вялые, адинамичные. Необходимо тщательно осмотреть кожные покровы, так как на месте присасывания клещей могут оставаться точки или различных размеров гиперемированные пятна. У всех больных необходимо исследовать неврологический статус. В периферической крови обнаруживают умеренный лимфоцитарный лейкоцитоз, иногда сдвиг влево с увеличением количества палочкоядерных лейкоцитов, повышение СОЭ. При двухволновом течении заболевания на первой волне у большинства больных наблюдается лейкопения с относительным лимфоцитозом, во время второй волны — лейкоцитоз с нейтрофильным сдвигом и повышение СОЭ. При менингеальных и очаговых формах заболевания в СМЖ обнаруживают лимфоцитарный плеоцитоз, от нескольких десятков до нескольких сотен клеток в 1 мкл. Лабораторная диагностика клещевого энцефалита основана на выявлении антител в крови заболевших. Используют РСК, РТГА, РН и другие методы. Стандарт диагностики — ИФА. В последние годы в клиническую практику внедряют метод ПЦР.
Лечение. Все больные с подозрением на клещевой энцефалит подлежат госпитализации в специализированное инфекционное отделение с наличием палаты интенсивной терапии. Показан строгий постельный режим, независимо от общего состояния и самочувствия в течение всего лихорадочного периода и 7 дней после нормализации температуры. Специальная диета не требуется (общий стол). В течение лихорадочного периода рекомендуют обильное питьё: морсы, соки, гидрокарбонатные минеральные воды. Серотерапию при необходимости проводят не позже чем в первые 3—4 дня заболевания только человеческим противоклещевым иммуноглобулином в объеме 2—3 дозы взрослым (доза 3 мл) и более (20—30 мл). В остром периоде применяют дегидратирующую терапию, противосудорожные средства, нейролептики и транквилизаторы. Широко используют дезинтоксикационное и противовоспалительное лечение, витаминотерапию. В случае нарушения дыхательных функций показан перевод на искусственную вентиляцию легких. В периоде реконвалесценции подключают массаж, лечебную физкультуру и др
Профилактика. Неспецифическая профилактика связана с защитой человека от нападения клещей. Общественная профилактика направлена на уничтожение или сокращение численности клещей. Меры личной профилактики предусматривают использование при посещении леса специально подобранной одежды, применение различных репеллентов, взаимоосмотры после посещения леса и парков в черте города. Специфическая профилактика включает активную и пассивную иммунизацию населения. Вакцинацию (Использоваться для укола могут инактивированные составы или вещества, содержащие живой многократно ослабленный вирус) осуществляют тканевой культуральной вакциной (троекратные прививки) с последующей ревакцинацией через 4, 6 и 12 мес. Специфическую серопрофилактику (экстренная профилактика) проводят гомологичным донорским иммуноглобулином как предэкспозиционно (до предполагаемого укуса клеща, при выходе в зону риска), так и постэкспозиционно (после укуса клеща). Иммуноглобулин вводят внутримышечно из расчёта 0,1 мл/кг однократно за несколько часов до выхода в лесную зону или в течение первых суток после укуса клеща. В последующие 2–3 дня эффективность постэкспозиционной иммунопрофилактики снижается. У непривитых больных значительно чаще встречаются паралитические формы, выше процент остаточных явлений и летальность. Тяжёлые формы среди непривитых в 4 раза чаще, чем у привитых.
40. Бореллиоз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Болезнь Лайма (иксодовый клещевой боррелиоз, системный клещевой боррелиоз, лайм-боррелиоз) — природно-очаговая инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, характеризующаяся преимущественным поражением кожи, нервной системы, сердца, суставов и склонностью к хроническому течению.
Этиология. Возбудитель — грамотрицательная спирохета комплекса Borrelia burgdorferi sensu lato семейства Spirochaetaceaе рода Borreliae. B. burgdorferi — самая крупная из боррелий. Она способна активно передвигаться с помощью жгутиков. Микробная клетка состоит из протоплазматического цилиндра, который окружён трёхслойной клеточной мембраной, содержащей термостабильный ЛПС со свойствами эндотоксина. Различают три группы антигенов боррелий: поверхностные (OspA, OspB, OspD, OspE и OspF), жгутиковый и цитоплазматический. Боррелии малоустойчивы в окружающей среде: гибнут при высыхании; хорошо сохраняются при низких температурах; при температуре 50 °С гибнут в течение 10 мин; погибают под действием ультрафиолетового облучения.
Эпидемилогия. Географическое распространение болезни Лайма сходно с ареалом клещевого энцефалита, что может привести к одновременному заражению двумя возбудителями и развитию микст-инфекции. Резервуар возбудителя — мышевидные грызуны, дикие и домашние животные; птицы, распространяющие инфицированных клещей при миграционных перелётах. Передача боррелий человеку осуществляется через укусы иксодовых клещей: I. ricinus, I. persulcatus — в Европе и Азии; I. scapularis, I. pacificus — в Северной Америке. Клещи могут нападать на человека во всех стадиях жизненного цикла: личинка → нимфа → имаго. Установлена возможность трансовариальной и трансфазовой передачи возбудителя у клещей. Весенне-летняя сезонность болезни обусловлена периодом активности клещей (май–сентябрь). Естественная восприимчивость людей близка к абсолютной. Случаи заболевания регистрируются среди всех возрастных групп. Чаще болеет взрослое трудоспособное население. Постинфекционный иммунитет нестерильный; возможно повторное заражение.
Патогенез. Из места укуса со слюной клеща боррелии проникают в кожу, вызывая развитие мигрирующей кольцевидной эритемы. После размножения возбудителя в области входных ворот происходит гематогенная и лимфогенная диссеминация в лимфатические узлы, внутренние органы, суставы, ЦНС. При этом наблюдается частичная гибель боррелий с высвобожением эндотоксина, обусловливающего явления интоксикации (недомогание, головная боль, отсутствие аппетита, лихорадка). B. burgdorferi стимулируют выработку различных медиаторов воспаления (ИЛ-1, ИЛ-6, ФНО-α), участвующих в развитии лайм-артритов. В патогенезе нейроборрелиоза предполагается участие аутоиммунных реакций. Существенное значение имеют процессы, связанные с накоплением специфических иммунных комплексов, содержащих антигены спирохет, в синовиальной оболочке суставов, дерме, почках, миокарде. Иммунный ответ у больных относительно слабый. В ранние сроки заболевания начинают вырабатываться IgМ, содержание которых достигает максимального уровня на 3–6-й неделе болезни. IgG обнаруживаются позднее; их концентрация увеличивается через 1,5–3 мес после начала болезни.
Клиника. Инкубационный период 5–30, чаще — 10–14 дней. Различают 3 основных этапа болезни: 1) общеинфекционный с развитием эритемы на месте присасывания клеща; длительность — в среднем около 7 дней; 2) период неврологических и/или кардиальных осложнений; развивается чаще на 4—5-й неделе болезни; 3) период воспалительных суставных нарушений; развивается чаще с 6-й недели болезни. В первом периоде ведущими симптомами являются: · на месте присасывания клеща возникает папула или макула. В среднем через 7—10 дней покраснение распространяется периферически и формируется эритема со средним диаметром 10—15 см. Эритема чаще возникает на бедрах, ягодицах или в подмышечных областях. Наружная граница эритемы обычно интенсивно красная и, как правило, не возвышается над уровнем соседней кожи. Центральная часть более бледная, с просветлением. Большинство больных указывают на неприятные ощущения в области эритемы, меньшая часть испытывает сильное жжение или боль. Эритемное кольцо обычно теплое на ощупь. · региональная лимфоаденопатия · лихорадка (температура тела обычно невысокая) · интоксикационный синдром (недомогание, слабость, мышечные боли, артралгии) Во втором периоде ведущими являются симптомы поражения центральной нервной (серозный менингит, поражение черепно-мозговых нервов, полирадикулоневрит) и сердечно-сосудистой (различной степени изменения предсердно-желудочковой проводимости, миокардиты, перикардиты, увеличение размеров сердца с недостаточностью левого желудочка и др.) систем. В третьем периоде преимущественно поражаются суставы. Артрит обычно начинается остро. Чаще поражается один или два сустава (как правило, крупные: коленные плечевые, локтевые). Средняя длительность воспалительных изменений в одном суставе относительно небольшая (около 8 дней), но у большинства больных бывают повторные атаки суставных болей с промежутками ремиссий.
Осложнения. После перенесённой инфекции может развиться нарушение высших психических функций, вплоть до развития слабоумия, параличи периферических нервов, потеря слуха и зрения, тяжёлые аритмии сердца. Также к числу осложнений болезни Лайма относятся множественные артриты, доброкачественные опухоли кожи в месте внедрения клеща.
Диагностика. При сборе анамнеза и осмотре пациента обращают внимание на: сезонность (апрель–август); посещение эндемичных районов, леса, нападение клещей; лихорадку; наличие сыпи на теле, эритемы в месте укуса клеща; ригидность мышц шеи; признаки воспаления суставов. Для лабораторной диагностики используют следующие методы: обнаружение фрагментов ДНК в ПЦР и определение антител к боррелиям. Основу диагностического алгоритма болезни Лайма составляет серологическая диагностика (ИФА, РНИФ). Для исключения ложноположительных реакций в качестве подтверждающего теста используют иммуноблоттинг. Исследования на наличие антител к боррелиям желательно проводить в динамике в парных сыворотках, взятых с интервалом в 2–4 нед.
Лечение. Режим активности больного определяется тяжестью течения заболевания: палатный режим — при лёгком, среднетяжёлом течении болезни; постельный режим — при тяжёлом течении, миокардите, нарушениях ритма сердца, менингоэнцефалите, полиартрите. Специальной диеты для больных не требуется. Терапию проводят антибиотиками широкого спектра действия. Их назначают перорально или парентерально в зависимости от клинической картины и тяжести заболевания. Пероральный прием тетрациклина в дозе 0,5 г 4 раза в сутки в течение 14 дней является предпочтительным. Тетрациклин можно заменить доксициклином в дозе 0,1 г 2 раза в сутки. В случае аллергии к тетрациклину назначают внутримышечно пенициллин в дозе 6 000 000—8 000 000 ЕД в сутки на 4 приема в течение 10 дней. Можно применять эритромицин из расчета 40 мг/кг в сутки в течение 14 дней при 4-разовом приеме. Хороший эффект дает лечение левомицетином 2,0—4,0 г/сут в течение 10—14 дней при 4-разовом приеме. В случаях устойчивости возбудителей к действию указанных лекарств применяют препараты цефалоспоринового ряда (кефзол, клафоран, цефтриаксон).
Профилактика. Специфической профилактики не разработано. Мероприятия по предупреждению заражения: акарицидная обработка лесопарковых зон, мест массового отдыха людей, локальная обработка наиболее посещаемых лесных зон; ношение защитной одежды при прогулках в лесу; индивидуальное применение репеллентов; само- и взаимоосмотры после посещения леса; немедленное удаление обнаруженного клеща и обработка места укуса йодной настойкой; исследование клеща на наличие боррелий и вируса клещевого энцефалита в лаборатории; обращение к врачу при обнаружении первых признаков заболевания (повышение температуры тела, покраснение кожи в месте укуса). Для экстренной профилактики применяют антибиотики различных групп: доксициклин, бициллин-3, амоксициллин, амоксициллин тригидрат + клавулановая кислота.
41. Туляремия: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Туляремия (лат. tularemia; чумоподобная болезнь, кроличья лихорадка, малая чума, мышиная болезнь, лихорадка от оленьей мухи, эпидемический лимфаденит) — острая зоонозная бактериальная природно-очаговая инфекционная болезнь с разнообразными механизмами передачи возбудителя. Характеризуется лихорадкой, интоксикацией, воспалительными изменениями в области входных ворот инфекции, регионарным лимфаденитом
Этиология. Возбудитель — Francisella tularensis, род Francisella, семейство Brucellaceae. Грамотрицательная полиморфная (преимущественно кокковидная) неподвижная палочка, не образующая спор и капсул. Факультативный анаэроб. Возбудитель требователен к условиям культивирования, растёт на питательных средах с добавлением цистеина или яичного желтка, кроличьей дефибринированной крови, тканевых экстрактов (печени, селезёнки, мозга) и других стимуляторов роста. Из лабораторных животных повышенной восприимчивостью к туляремии обладают белые мыши и морские свинки. Микроорганизм содержит соматический (О) и оболочечный (Vi) антигены, с которыми связаны вирулентность и иммуногенные свойства возбудителя. Основной фактор патогенности — эндотоксин. F. tularensis устойчива в окружающей среде, долго (до нескольких месяцев) сохраняется во внешней среде, особенно при низкой температуре (например, в замороженных тушах животных). Кипячение убивает их немедленно. Для полного обеззараживания трупы инфицированных животных выдерживают в дезинфицирующем растворе не менее суток, после чего сжигают. Возбудитель чувствителен к хлорамфениколу, рифампицину, стрептомицину и другим аминогликозидам, антибиотикам тетрациклиновой группы.
Эпидемиология. Источником инфекции являются в основном различные грызуны и зайцы. Домашние животные (овцы, свиньи, крупный рогатый скот, северные олени и др.) обычно болеют легко, с незначительным обсеменением органов и тканей бактериями, и их значение в поддержании эпидемиологического процесса мало. Больной человек не опасен для окружающих. Природные очаги болезни обычно формируются в степных и лесостепных зонах, поймах и дельтах рек, на побережьях озер и болот, в тундре. Пути заражения туляремией человека разнообразны: контакт с больными грызунами и их выделениями (контактный), употребление зараженной пищи и воды (алиментарный, водный), через кровососущих насекомых (клещи и двукрылые — трансмиссивный), вдыхание инфицированной пыли (аэрогенный). Восприимчивость к болезни у человека составляет почти 100%. В результате перенесенной болезни обычно формируется длительный иммунитет, часто пожизненный
Патогенез. Возбудитель проникает через кожу и слизистые оболочки, даже неповрежденные. Входные ворота обычно определяют развитие клинической формы болезни. На месте входных ворот нередко развивается первичный аффект в виде небольшого красного инфильтрата с регионарным лимфаденитом (первичный бубон). Микробы, попавшие в лимфатические узлы, размножаются и частично гибнут. В лимфатических узлах возникает гнойное воспаление, часто с некрозом, вскрытием и образованием на коже длительно незаживающих язв. Эндотоксин, попадая в ток крови, вызывает общую интоксикацию. При прорыве лимфатического барьера развиваются бактериемия и генерализация инфекции с метастазированием и формированием вторичных туляремийных бубонов. Во внутренних органах и лимфатических узлах образуются специфические туляремийные гранулемы, микроскопически сходные с туберкулезными. Важную роль в патогенезе туляремии играет аллергизация организма.
Клиника. Инкубационный период составляет от нескольких часов до 3 нед (в среднем 3–7 дней). 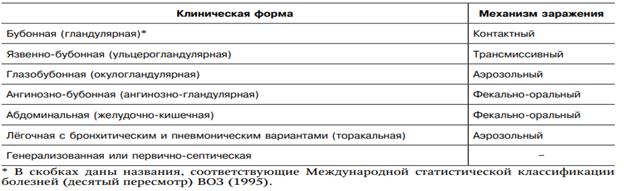
Заболевание, как правило, начинается остро. Для всех форм туляремии характерна следующая симптоматика: · быстрое повышение температуры тела до 39—40°С, сопровождающееся ознобом, головной болью, болями в мышцах (лихорадка ремиттирующего или интермиттирующего характера, ее продолжительность чаще 2—3 нед) · пастозность и гиперемия лица, конъюнктив, слизистой оболочки рта и носоглотки, инъекция склер · увеличение различных групп лимфатических узлов, в том числе мезентериальных · сыпь в виде эритемы, розеол, петехий или папул, иногда на симметричных участках («носки», «чулки», «перчатки» и др.); сыпь держится 8—12 дней, после нее остаются шелушение и пигментация · гепатолиенальный синдром · в начальном периоде болезни лейкопения крови, затем лейкоцитоз, палочкоядерный сдвиг, моноцитоз. Помимо общих проявлений туляремии, развиваются поражения, присущие различным формам болезни. Бубонная форма. Чаще бывают подмышечные, шейные и подчелюстные бубоны (увеличенный единичный узел). Лимфатический узел мало болезнен, имеет четкие контуры, постепенно увеличивается. При нагноении вскрытие обычно происходит через 2—4 нед, при этом выделяется густой сливкообразный гной, рубцевание медленное. Исходами бубона, помимо его вскрытия, могут быть склерозирование и рассасывание. Язвенно-бубонная форма. На месте укуса насекомого появляется папула, за 6—8 дней превращающаяся в неглубокую язву. Язва заживает медленно путем рубцевания. Формирование первичного бубона происходит аналогично таковому при бубонной форме. Часто наблюдается лимфангоит. Глазо-бубонная форма встречается при внесении возбудителя в глаз загрязненными руками. Чаще наблюдается одностороннее поражение: резкая гиперемия конъюнктив, появление папул и язвочек на них, отек век, значительное увеличение переднешейных, околоушных или подчелюстных лимфатических узлов. Процесс длится от нескольких недель до нескольких месяцев. Ангинозно-бубонная форма встречается при алиментарном пути заражения. Наблюдаются гиперплазия миндалин, серовато-белые налеты, чаще с одной стороны. Постепенно развивается некротический процесс, появляются глубокие, медленно заживающие язвы. Односторонний лимфаденит появляется одновременно с ангиной. При абдоминальной форме на первом плане находится поражение мезентериальных лимфатических узлов. Характерны сильные боли в животе, рвота, метеоризм, задержка стула, иногда диарея. Эти симптомы связаны с раздражением брюшины. Иногда пальпируются увеличенные брыжеечные лимфатические узлы. Легочная форма. Наиболее специфическими ее проявлениями являются неправильного типа лихорадка с обильными потами, слизисто-гнойная мокрота, определяемые рентгенологически с 7-го дня болезни увеличенные прикорневые, паратрахеальные и медиастинальные лимфатические узлы. Генерализованная форма характеризуется тяжелым тифоподобным или септическим течением при отсутствии первичного аффекта и регионарного лимфаденита.
Осложнения. Осложнения чаще отмечаются при генерализованной форме туляремии. Возможно развитие ИТШ, менингита, менингоэнцефалита, перикардита, миокардиодистрофии, полиартрита, вегетативных неврозов, перитонита (вследствие нагноения и самопроизвольного вскрытия мезентериальных лимфатических узлов при абдоминальной форме), перфорации роговицы, бронхоэктазий, абсцесса и гангрены лёгких (при пневмонической форме). Течение любой формы может осложниться туляремийной пневмонией.
Диагностика. Лабораторная диагностика основывается на кожно-аллергической пробе с туллярином и серологических реакциях. Бактериологическая диагностика с помощью заражения лабораторных животных доступна лишь специально оснащенным лабораториям. Наиболее распространенным методом серологической диагностики являются реакции агглютинации или пассивной гемагглютинации. Они становятся положительными обычно со 2-й недели болезни, и далее титр антител нарастает до 1:400—1:1600 и более. Учитывается нарастание титра антител в парных сыворотках в 4 раза и более. ИФА на твердофазном носителе положителен с 6–10-х суток заболевания (диагностический титр 1:400); по чувствительности он в 10–20 раз превышает другие методы серодиагностики. ПЦР, с помощью которой можно обнаружить специфическую ДНК в различных биологических субстратах, положительна в начальном лихорадочном периоде заболевания, поэтому её считают ценным методом ранней диагностики туляремии
Лечение. Ведущую роль в комплексной терапии играет антибактериальная терапия. Наиболее эффективны стрептомицин, тетрациклин, левомицетин и аминогликозиды. Суточная доза стрептомицина 1—2 г, тетрациклина 1,5—2 г, левомицетина 2 г. Обычно курс лечения заканчивается после 5-го дня нормальной температуры тела. На область бубонов до развития нагноения накладывают компрессы, мазевые повязки, применяют тепловые процедуры (диатермия, соллюкс и др.). При появлении флюктуации производят широкий разрез бубонов и опорожнение от гноя и некротических масс.
Профилактика. По эпидемическим показаниям проводится иммунизация живой туляремийной вакциной. Неспецифическая профилактика предусматривает контроль за природными очагами туляремии, своевременное выявление эпизоотий среди диких животных, проведение дератизационных и дезинсекционных мероприятий. При водной вспышке запрещают употреблять некипячёную воду и купаться, а при заражении колодезной воды принимают меры к очистке колодца от трупов грызунов и проводят дезинфекцию воды. При угрозе трансмиссивного заражения рекомендуется применять репелленты, защитную одежду, ограничивается въезд непривитого населения на неблагополучные территории. Для профилактики промысловых заражений целесообразно использовать перчатки при снятии шкурок с убитых грызунов и дезинфицировать руки. Проводят мероприятия по дезинсекции и дезинфекции на складах хранения шкурок. Необходима тщательная термическая обработка мяса (например, заячьего) перед употреблением в пищу. При скирдовании сена и обмолоте хлеба употребляют очки-консервы и защитные маски. Среди населения районов, неблагополучных по туляремии, необходимо проводить систематическую разъяснительную и санитарно-просветительную работу. Лиц, контактировавших с больным, не изолируют, так как заболевшие не контагиозны. В жилье больного осуществляют дезинфекцию.
42. Бешенство: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Бешенство (гидрофобия, hydrophobia, лат. — rabies, греч. — lyssa) — вирусная зоонозная природно-очаговая и антропургическая инфекционная болезнь с контактным механизмом передачи возбудителя через слюну заражённого животного, характеризуемая тяжёлым поражением ЦНС со смертельным исходом.
Этиология. РНК-содержащий рабдовирус. Различают “уличный” (“дикий”) и фиксированный вирус бешенства. Первый высокопатогенен для млекопитающих, которые начинают выделять вирус со слюной за 7—8 дней до появления клинических симптомов, поражает головной мозг с образованием специфических цитоплазматических включений — телец Бабеша-Негри. После внедрения через поврежденную кожу вирус по нервным стволам достигает головного мозга, вызывая в нем отек, кровоизлияния, дегенерацию нервных клеток. Вирус попадает также в слюнные железы и со слюной выделяется во внешнюю среду. Фиксированный вирус (получен Пастером) не патогенен для людей и используется для получения антирабических вакцин.
Эпидемиология. Основной резервуар бешенства в природе — дикие млекопитающие, различные в разных регионах мира. Выделяют две эпидемические формы заболевания: городское бешенство (антропургические очаги), основной резервуар — домашние собаки и кошки; лесное бешенство, резервуар — различные дикие животные. Бешенство встречается на всех континентах, кроме Австралии и Антарктиды. В некоторых островных государствах (Великобритания, Мальта, Новая Зеландия, Япония) бешенства практически нет благодаря строгим карантинным мерам для ввозимых собак, кошек и других хищников. Источником инфекции являются инфицированные животные: чаще собаки, реже кошки, лисы, волки и др.). В принципе, любое теплокровное животное, включая летучих мышей и птиц, восприимчиво к инфекции. Больной человек в естественных условиях эпидемиологического значения не имеет. Заражение человека осуществляется контактным путем — укус или ослюнение больным животным поврежденных наружных слизистых оболочек или кожных покровов. Восприимчивость людей к бешенству зависит от ряда факторов: глубина и тяжесть укусов (этот фактор обуславливает дозу попавшего вируса), место укуса (при укусах в лицо заведомо бешеными животными заболевание возникало в 90%, при укусах в кисти рук — в 63%, а при укусах в проксимальные отделы рук и ног — лишь в 23% случаев), укус в защищенную или незащищенную кожу (во втором случае риск развития заболевания значительно выше).
Патогенез. После укуса вирус бешенства проникает в организм человека через повреждённый эпителий, внедряется в поперечнополосатые мышцы; в нервную систему вирус попадает через нервно-мышечные синапсы и сухожильные рецепторы Гольджи (в этих структурах есть уязвимые для вируса безмиелиновые нервные окончания). Далее вирус медленно, со скоростью около 3 мм/ч, продвигается по нервным волокнам в ЦНС, по видимому, с аксоплазматическим током. При естественном заражении бешенством вирусемии нет, но в некоторых опытах на животных циркуляция вируса в крови зарегистрирована. Достигнув ЦНС, вирус инфицирует нейроны, репликация происходит почти исключительно в сером веществе. После репликации в нейронах мозга вирус распространяется в обратном направлении по вегетативным нервным волокнам — в слюнные железы (это и объясняет наличие вируса в слюне уже в конце инкубационного периода), в слёзные железы, в роговицу, почки, лёгкие, печень, кишечник, поджелудочную железу, скелетные мышцы, кожу, сердце, сосочки языка, надпочечники, волосяные фолликулы и др. Наличие вируса в волосяных фолликулах и роговице используют для прижизненной диагностики заболевания (наличие вирусного антигена исследуют в биоптате кожи, взятом в заушной области, и в мазке-отпечатке с роговицы). Смерть наступает вследствие поражения жизненно важных центров — дыхательного и сосудодвигательного. Патоморфологическое исследование мозга умерших позволяет выявить умеренные воспалительные изменения с относительно негрубой деструкцией нервных клеток, сопровождаемые отёком–набуханием вещества головного мозга. Гистологическая картина напоминает таковую при других вирусных инфекциях ЦНС: полнокровие, более или менее выраженный хроматолиз, пикноз ядер и нейронофагия, инфильтрация периваскулярных пространств лимфоцитами и плазматическими клетками, пролиферация микроглии, гидропическая дистрофия. Обращает на себя внимание несоответствие между тяжёлыми неврологическими проявлениями болезни и скудными патоморфологическими изменениями в веществе мозга. В клетках мозга вирус бешенства образует оксифильные цитоплазматические включения (тельца Бабеша–Негри), чаще всего обнаруживаемые в гиппокампе, клетках Пуркинье коры мозжечка, стволе мозга, гипоталамусе и спинномозговых ганглиях. Включения имеют размер около 10 нм, это участки цитоплазмы нервных клеток и скопления вирусных частиц. У 20% больных тельца Бабеша–Негри выявить не удаётся, однако их отсутствие не исключает диагноз бешенства.
Клиника. Продолжительность инкубационного периода чрезвычайно колеблется. Длительность инкубационного периода — от 7 дней до года и более (чаще 30–90 дней), зависит от локализации укусов (чем больше расстояние до головного мозга, тем он продолжительней), их глубины и обширности. Наиболее короткий инкубационный период характерен для укусов в область лица, головы, промежности, гениталий, наиболее длительный — для одиночных укусов в туловище и нижние конечности. Зависит от степени тяжести повреждений тканей, возраста укушенного (короче — у детей) и др. В течение болезни различают 3 стадии, каждая из которых длиться 1-3 дня: · предвестников (депрессии) · возбуждения · параличей Первые признаки начинающейся болезни обнаруживаются почти всегда в месте укуса. Больные начинают ощущать зуд, тянущие и ноющие боли, невралгические боли по ходу нервных путей, ближайших к месту укуса. В это же время появляются беспричинная тревога, депрессия, бессонница. Вторая стадия характеризуется фобиями (гидро-, аэро-, фото- и акустикофобии) и возбуждением. Фобии — это специфический судорожный приступ в ответ на какой-либо раздражитель. Например, приступ гидрофобии развивается, когда больной пытается выпить воду. Возникают чрезвычайно болезненные судорожные сокращения мышц глотки и гортани, дыхание становится шумным, возможна кратковременная остановка дыхания, наблюдаются повышенное потоотделение, слюнотечение. В дальнейшем подобные приступы возникают уже даже при виде воды или при звуке льющейся воды. Аэрофобия — возникновение судорожного приступа от дуновения в лицо струи воздуха, фотофобия — от яркого света, акустикофобия — от громкого звука. Приступы длятся несколько секунд. Повторяясь, они часто следуют друг за другом, наступают от малейшего раздражения. У больного появляются слуховые и зрительные галлюцинации, часто угрожающего характера. Это делает его агрессивным, больной порывается бежать. В третьем периоде болезни возбуждение сменяется параличами мышц конечностей, лица, языка, гортани, глотки, дыхательных мышц и др. Приступы фобий возникают в этом периоде все реже и реже. Наступает мнимое благополучие и больные начинают надеяться на выздоровление, однако в течение 1-2 дней наступает смерть, либо от паралича дыхания, либо от паралича сердечной мышцы. В качестве вариантов течения выделяют бульбарную форму с выраженными симптомами поражения продолговатого мозга, паралитическую (начинается с параличей, иногда типа Ландри) и мозжечковую с мозжечковыми расстройствами.
Диагностика. В настоящее время появилась возможность прижизненной лабораторной диагностики бешенства: исследование отпечатков роговицы с помощью методики флюоресцирующих антител, выделение вируса из цереброспинальной жидкости, слюны и слез путем интрацеребрального заражения новорожденных лабораторных животных. Возможно выявление специфических антител в крови больного серологическими методами. Постмортальный лабораторный диагноз заключается в обнаружении в нервных клетках головного мозга телец Бабеша—Негри, выявлении положительной флюоресценции и выделении из головного и спинного мозга, а также из подчелюстных слюнных желез вируса, вызывающего у белых мышей типичную картину бешенства.
Лечение. Перечень показаний к госпитализации пострадавших от укусов, оцарапывания и ослюнения животными и больных гидрофобией: хирургические показания (множественные рваные раны, укусы в лицо, шею, кисти и пальцы рук); отягощённый терапевтический анамнез; инфицированные укушенные раны; отягощённый аллергологический анамнез, лица с необычными поствакцинальными реакциями и осложнениями на антирабические препараты и повторно прививаемые; отягощённый неврологический анамнез; отягощённый психоневрологический анамнез; беременные женщины, пострадавшие от укусов животных; новорождённые, пострадавшие от укусов животных; больные гидрофобией и пострадавшие от укусов инфицированных животных. Режим определяется показанием к госпитализации. Больных гидрофобией госпитализируют в ОРИТ. Развитие гидрофобии сопровождается нарушением глотания, что требует установки назогастрального зонда и проведения зондового питания. Эффективного лечения бешенства не существует. При развитии заболевания больного госпитализируют в инфекционную больницу (в ОРИТ), где с соблюдением противоэпидемических мероприятий проводят инфузионную, противосудорожную и седативную терапию, при необходимости вводят мышечные релаксанты, наркотические средства, проводят ИВЛ. НО СУЩЕСТВУЕТ МИЛУОКСКИЙ ПРОТОКОЛ, согласно которому необходимо поместить человека в искусственную кому. Терапия: седация, рибавирин, амантадин.
Профилактика. При укусе животным необходимо провести следующие мероприятия: · промыть рану водой с мылом и обработать настойкой йода или спиртом, если необходимо наложение швов, его производят не раннее, чем через 24 часа после укуса · наблюдать за укусившим животным в течение 10 дней (если за этот период у животного симптомы бешенства не появились, никакие другие мероприятия не нужны) · антирабическая вакцинация проводится, если 1) у животного лабораторно подтвержден диагноз бешенства; 2) у животного имеются симптомы, подозрительные на бешенство; 3) нельзя наблюдать за животным в течение указанного срока; 4) укусило дикое животное; 5) животное погибло до истечения срока наблюдения за ним. Иммунопрофилактика бешенства является активно-пассивной. Вводится антирабический Ig (пассивная профилактика, т. к. препарат содержит готовые антитела) и одновременно с ним начинается курс вакцинопрофилактики (активная профилактика, т. к. препарат содержит антиген, в ответ на который вырабатываются собственные антитела человеческого организма). Таким образом, Ig защищает от заболевания в первые 2-е недели, а вакцина — спустя 2-е недели от начала специфической профилактики. 
43. Столбняк: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Столбняк (tetanus) — острая инфекционная болезнь из группы сапрозоонозов с контактным механизмом передачи возбудителя. В основе патогенеза болезни лежит действие токсина возбудителя на нервную систему. Клинически проявляется приступами генерализованных (тетанических) судорог, возникающих на фоне мышечного гипертонуса.
Этиология. Возбудитель — столбнячная Гр (+) палочка Сlostridium tetani, подвижная, анаэроб, образует споры, десятилетиями сохраняющиеся в грунте, выделяет сильный экзотоксин, который по своей силе уступает только ботулотоскину. Столбнячный экзотоксин состоит из 2-х фракций: тетаноспазмина (нейротоксин, поражает двигательные клетки нервной системы) и тетаногемолизина (вызывает гемолиз эритроцитов).
Эпидемиология. Источник возбудителя — многие виды животных, особенно жвачных, в пищеварительном тракте которых обнаруживают споры и вегетативные формы возбудителя. Возбудитель также можно выявить в кишечнике человека. Попадая с испражнениями в почву, споры столбнячной палочки сохраняются в ней годами, а при благоприятных температурных условиях, отсутствии кислорода или потреблении его аэробной флорой они прорастают, что приводит к накоплению спор. Увеличение почвенной популяции возбудителя особенно характерно для стран тропического пояса. Таким образом, почва служит естественным резервуаром возбудителя. Заражение происходит при проникновении спор в ткани при ранениях, особенно осколочных, бытовых, производственных; сельскохозяйственных травмах вместе с частицами почвы, инородными телами. В мирное время наиболее частая причина заражения — мелкие травмы ног, а в развивающихся странах — пупочная ранка у новорождённых. Возможно возникновение столбняка после ожогов, обморожений, внебольничных абортов, операций, родов, при различных воспалительных процессах, трофических язвах, распадающихся опухолях. Столбняк военного времени связан с обширными ранениями. Иногда входные ворота инфекции установить не удаётся («криптогенный столбняк»). Восприимчивость к столбняку высокая. В странах с умеренным климатом отмечается летняя сезонность (сельскохозяйственный травматизм). Постинфекционный иммунитет не вырабатывается. Более высокую заболеваемость наблюдают в условиях жаркого влажного климата, что связано с замедленным заживлением ран, повышенной обсеменённостью почвы возбудителем и широко распространённым обычаем в ряде стран обрабатывать пупочную ранку почвой или экскрементами животных.
Патогенез. Попадая в организм через повреждения наружного покрова, споры возбудителя остаются в месте входных ворот. При наличии анаэробных условий (некротические ткани, сгустки крови, ишемия, инородные тела, флора, потребляющая кислород) и отсутствии достаточного уровня иммунной защиты споры прорастают в вегетативные формы. После этого начинается интенсивная выработка столбнячного экзотоксина. Токсин гематогенным, лимфогенным и периневральным путями распространяется по организму и прочно фиксируется в нервной ткани. Он избирательно блокирует тормозящее действие вставочных нейронов на мотонейроны прежде всего в двигательных клетках передних рогов спинного мозга. Импульсы, спонтанно возникающие в мотонейронах, беспрепятственно проводятся к поперечнополосатым мышцам, обусловливая их тоническое напряжение. Необходимо отметить, что в первую очередь происходит сокращение поперечнополосатых мышц, которые, с одной стороны, ближе находятся к месту травмы, а с другой — выступают в качестве относительно (к единице площади) «самых сильных» в организме человека (жевательная и мимическая мускулатура). Помимо этого, блокада нейронов ретикулярной формации ствола мозга способствует торможению парасимпатической нервной системы, что приводит к активации симпатической нервной системы, а это, в свою очередь, вызывает повышение температуры тела, артериальную гипертензию и выраженное потоотделение, вплоть до развития обезвоживания. Постоянное мышечное напряжение сочетается с нарушением микроциркуляции. Возникает порочный круг: метаболический ацидоз и нарушения микроциркуляции ведут к развитию судорог, а судорожный синдром в свою очередь усугубляет метаболический ацидоз и нарушения микроциркуляции. Если больной не умирает на «пике» судорожного приступа от остановки дыхания или сердечной деятельности, то при дальнейшем течении болезни причинами смерти могут быть прямое действие токсина на дыхательный и сосудодвигательный центры в сочетании с глубокими метаболическими нарушениями, а также гнойно-септические осложнения
Клиника. По распространенности процесса столбняк подразделяют на общий, или генерализованный, и местный. У человека болезнь обычно протекает в виде генерализованного процесса, когда симптоматика развивается по нисходящему типу. Местный столбняк наблюдается редко. После инкубационного периода в среднем 5—14 дней (он может быть короче и длиннее — до месяца) болезнь начинается остро. Иногда отмечаются продромальные явления в виде общего недомогания, тянущих болей в ране, фибриллярных подергиваний прилегающих к ней мышц, повышенной реакции больного на внешние раздражители. Ранними признаками болезни являются: тризм (тоническое напряжением жевательных мышц), «сардоническая улыбка» (risus sardonicus) (тетанические судороги мимической мускулатуры), дисфагия (затруднение глотания вследствие спазма глотательных мышц). Несколько позже присоединяются другие специфические проявления столбняка: опистотонус (больные лежат в положении на спине с запрокинутой назад головой и приподнятой над кроватью поясничной частью тела, так что между спиной и постелью можно свободно подвести руку), тоническое напряжение мышц конечностей (мышцы стоп и кистей, как правило, свободны от напряжения), живота (с 3—4-го дня болезни живот становится твердыми, как доска), межреберных мышц и мышц диафрагмы, что сопровождается ограничением дыхательных экскурсий, поверхностным и учащенным дыханием; сильные боли в мышцах вследствие постоянного напряжения их, тетанические судороги продолжительностью от нескольких секунд до минуты и более, сопровождающиеся сильным болевым синдромом, цианозом, потливостью на фоне сохраненного сознания, повышение температуры тела (чем тяжелее протекает заболевание, тем выше температура тела у больного)
Диагностика. Диагноз столбняка в ранние сроки устанавливают, если выявляют тризм, сардоническую улыбку и дисфагию. Позднее появляется ригидность мышц затылка; гипертонус распространяется на другие мышцы туловища, присоединяются тетанические судороги, характерная особенность которых — сохранение гипертонуса мышц после приступа. Отличительная черта болезни — ясное сознание, лихорадка, потливость и гиперсаливация. Лабораторная диагностика столбняка имеет второстепенное значение. При появлении клинических симптомов болезни токсин в крови невозможно обнаружить даже самыми чувствительными методами. Выявление антитоксических антител не имеет диагностического значения, поскольку оно свидетельствует лишь о прививках в анамнезе. При столбняке нарастания титров антител не происходит, так как даже летальные дозы экзотоксина не вызывают иммунного ответа. В отдельных случаях применяют бактериологические методы (микроскопия мазков-отпечатков, гистологическое исследование тканей, иссекаемых при хирургической обработке ран, посевы раневого отделяемого на питательные среды в анаэробных условиях), позволяющие обнаружить возбудитель в месте расположения входных ворот инфекции. Выделить культуру возбудителя из раны удаётся не более чем у 30% больных. Типично отсутствие патологических изменений СМЖ.
Лечение. При подозрении на столбняк больные подлежат экстренной госпитализации в отделение реанимации в связи с возможным нарушением жизненно важных функций, необходимостью интенсивной терапии и ухода. Важен лечебно-охранительный режим, помогающий уменьшить частоту судорожных приступов. Пациентов размещают в отдельных палатах, максимально изолируя от внешних раздражителей, способных провоцировать судороги. Большое значение имеет полноценное энтеральное (зондовое) и/или парентеральное питание специальными питательными смесями, концентрированными растворами глюкозы (10–70%), смесями аминокислот и жировыми эмульсиями. Питание осуществляется из расчёта (учитывая большие энерготраты при судорогах и высокой температуре) 2500–3000 ккал/сут. Возможности этиотропной терапии весьма ограничены. Проводят хирургическую обработку ран, чтобы удалить нежизнеспособные ткани, инородные тела, вскрыть карманы, создать отток раневого отделяемого, что предотвращает дальнейшую выработку токсина возбудителем. Перед обработкой рану обкалывают противостолбнячной сывороткой в дозе 1000–3000 МЕ. Хирургические манипуляции производятся под общим наркозом, чтобы избежать приступов судорог. Для нейтрализации циркулирующего экзотоксина вводят внутримышечно однократно 50–100 тыс. МЕ противостолбнячной очищенной концентрированной сыворотки или, что предпочтительнее, 900 МЕ противостолбнячного иммуноглобулина. На фиксированный в тканях токсин не удаётся воздействовать никакими средствами. По данным ряда авторов, ни раннее, ни повторное назначение этих препаратов не предупреждает развития тяжёлых форм и летального исхода болезни, поэтому важную роль играют патогенетические методы терапии. При среднетяжёлом и тяжёлом течении столбняка необходимо назначать миорелаксанты, поэтому больных сразу переводят на ИВЛ. Помимо этого, необходимо использовать весь арсенал противосудорожных средств. Антибиотики следует назначать больным с тяжёлыми формами столбняка для профилактики и лечения пневмоний и сепсиса. При тяжёлом течении болезни для борьбы с гиповолемией показана инфузионная терапия (кристаллоиды). Показано назначение средств, улучшающих микроциркуляцию (пентоксифиллин, никотиновая кислота) и уменьшающих метаболический ацидоз (раствор натрия гидрокарбоната в расчётных дозах). Эффективно использование гипербарической оксигенации, иммуноглобулинов — иммуноглобулина человека нормального (пентаглобин) и метаболических средств (большие дозы водорастворимых витаминов, триметазидин, мельдоний, анаболические стероиды). При длительной ИВЛ на первый план выходят вопросы ухода за больным.
Профилактика. Специфические. В календаре прививок предусмотрена трёхкратная вакцинация детей с интервалом 5 лет. В развивающихся странах важное значение для предупреждения столбняка новорождённых имеет вакцинация женщин детородного возраста. Используют столбнячный анатоксин или ассоциированную вакцину АКДС. Поскольку в каждом конкретном случае степень напряжённости иммунитета неизвестна и некоторая часть населения не привита, при угрозе развития заболевания необходимо проведение экстренной профилактики. С этой целью осуществляют тщательную первичную и хирургическую обработку ран, при травмах с нарушениями целостности кожи и слизистых оболочек, ожогах и обморожениях II–III степени, укусах животных, внебольничных родах и абортах вводят гетерогенную противостолбнячную сыворотку в дозе 3000 ME или высокоактивный противостолбнячный иммуноглобулин человека в дозе 300 ME. Пассивная иммунизация не всегда предупреждает заболевание, в связи с чем необходима активная иммунизация столбнячным анатоксином в дозе 10–20 ME. Сыворотку и анатоксин следует вводить в разные участки тела. Неспецифические. Большое значение имеет профилактика травматизма.
44. Амебиаз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Амёбиаз (англ. amebiasis) — антропонозная протозойная болезнь с фекально-оральным механизмом передачи. Характеризуется язвенным поражением толстой кишки, тенденцией к хроническому рецидивирующему течению, внекишечными осложнениями в виде абсцессов печени и других органов.
Этиология. Возбудитель — Entamoeba histolytica. Жизненный цикл этого простейшего включает две стадии: вегетативную (трофозоит) и покоя (циста). Трофозоит в свою очередь может существовать в виде двух форм : большая вегетативная или тканевая (forma magna) и малая вегетативная или просветная (forma minuta). Большая вегетативная форма отличается от малой большими размерами и подвижностью, а также способностью фагоцитировать эритроциты. Во внешней среде вегетативные формы амеб быстро погибают, а цисты сохраняют свою жизнеспособность. Так, во влажной почве они сохраняются до 8 дней, в водопроводной воде — до 1 мес.
Эпидемиология. Особенно высока пораженность амебиазом в странах с тропическим и субтропическим климатом. Источником инвазии служат люди, больные амебиазом или амебо-, цистоносители. Устойчивость цист к неблагоприятным воздействиям ведет к их широкому рассеиванию во внешней среде. Механизм передачи — фекально-оральный. Факторами передачи служат вода, различные пищевые продукты (не подвергающиеся термической обработке), а также предметы обихода. Цисты могут распространяться механическими переносчиками: мухами и тараканами, в пищеварительной системе которых амёбы сохраняют жизнеспособность в течение нескольких суток. Пути передачи: водный, алиментарный, контактно-бытовой. Восприимчивость относительная. Иммунитет после перенесенного амебиаза кратковременный.
Патогенез. Цисты Е. histolytica, попавшие в желудок, проходят в кишечник без существенных изменений. В нижних отделах тонкой кишки они эксцистируются, а в слепой и восходящей, где амебы встречают наиболее благоприятные условия, начинается их активное размножение. Дальнейшее развитие инвазии может протекать по типу бессимптомного носительства. В этом случае амебы питаются содержимым кишки и ведут себя как непатогенные просветные формы (forma minuta). При наличии дополнительных факторов (микробный, ферментативный, цитолитический и др.) амеба внедряется в слизистую оболочку кишки, а затем в подслизистую ткань, где ведет себя как тканепаразит, возникают микроабсцессы. Прорыв их в просвет кишки ведет к образованию глубоких язв различной формы и величины с воспаленными, подрытыми, неровными и свисающими краями. При микроперфорациях возникает конгломерат, состоящий из спаек толстой кишки с сальником, петлями тонкой кишки и другими органами — так называемая амебома. Разрушение кровеносных сосудов, попавших в зону некроза и нагноения, может привести к гематогенной диссеминации амеб. В любом органе и ткани, где они оседают, развиваются коагуляционный некроз, а затем и нагноение. Абсцессы в основном формируются в печени, реже — в легких, головном мозге и других органах. В печени они обычно располагаются в правой доле.
Клиника. Инкубационный период длится от 1—2 нед до нескольких месяцев. Первым проявлением болезни, как правило, бывает симптоматика колита. Опорными симптомами амебного колита являются: · постепенное начало заболевания · нормальная или субфебрильная температура тела · явления проксимального колита (боли в правой подвздошной области, слепая и восходящая кишки спазмированы, уплотнены, болезненны при пальпации, стул калового характера с примесью крови (по типу “малинового желе” — кровь перемешана со слизью), гноя, тенезмы не характерны) При амебиазе возможно развитие двух групп специфических осложнении: кишечных и внекишечных. Среди первых наиболее часто встречаются периколиты или прободение амебных язв в рядом расположенные органы (брюшную полость, желудок, тонкую кишку, мочевой пузырь). Возможно сужение просвета кишки и появление признаков частичной кишечной непроходимости. Кроме того, часто могут возникать небольшие кишечные кровотечения. К внекишечным формам амебиаза относят абсцессы, возникающие в различных органах и тканях, поражения кожи и гениталий. Амебные абсцессы печени проявляются ознобами, лихорадкой и потливостью. Печень увеличивается, становится болезненной в зоне поражения. Локализация боли выявляется пальпацией в межреберных промежутках. При рентгенологическом обследовании больных амебными абсцессами печени часто обнаруживается высокое стояние купола диафрагмы, его выбухание и ограничение подвижности. В крови — нейтрофильный лейкоцитоз, резкое увеличение СОЭ. При сдавлении абсцессом крупных желчных протоков возникает желтуха различной интенсивности. Амебные абсцессы легких, мозга и других органов также протекают с лихорадкой, лейкоцитозом, нарастанием СОЭ. Случаи амебных поражении кожи и гениталий сопровождаются развитием обширных, быстро распространяющихся язвенно-некротических изменений, часто напоминающих злокачественный процесс и редко распознающихся своевременно.
Осложнения. Перфорация кишечника (чаще в области слепой кишки, реже в ректосигмоидальном участке), следствием которой может стать перитонит или абсцесс брюшной полости; амёбный аппендицит; амёбные стриктуры кишечника (обычно единичные, расположенные в области слепой или сигмовидной кишки); кишечное кровотечение, формирование амебомы. Наиболее серьёзное осложнение при внекишечном амёбиазе — прорыв абсцесса в окружающие органы.
Диагностика. Наиболее простой и надёжный метод диагностики кишечного амёбиаза — микроскопическое исследование фекалий для выявления вегетативных форм (трофозоитов) и цист. Трофозоиты лучше выявляь у больных при диарее, а цисты — в оформленном стуле. Обнаружение только цист амёб не подтверждает наличия инвазивного амёбиаза. В последние годы разработан чувствительный и специфичный метод ПЦР, позволяющий относительно просто и быстро идентифицировать в фекалиях одновременно E. histolytica и E. dispar. При клинических данных, указывающих на возможное поражение кишечника, рекомендуют проводить ректо- или колоноскопию с получением биопсийного материала. Этими методами можно выявить язвы в кишечнике, амебомы, стриктуры и другие патологические изменения. Характерная черта изменений при амёбиазе — очаговый, а не диффузный тип поражения. Диагностику внекишечного амёбиаза, в частности абсцесса печени, проводят с помощью УЗИ и КТ, которые позволяют определять локализацию, размеры, число абсцессов, а также контролировать результаты лечения. Рентгенологическое исследование позволяет выявить высокое стояние купола диафрагмы, наличие выпота в плевральную полость, абсцессы в лёгких. При необходимости аспирируют содержимое абсцесса печени, однако вероятность выявления амёб в некротических массах невелика, так как они обычно расположены по периферии области поражения. Специфические противоамёбные антитела c помощью серологических методов (ИФА, НРИФ) обнаруживают у 75–80% больных инвазивным кишечным амёбиазом и у 96–100% — при внекишечных поражениях; даже у бессимптомных носителей E. histolytica положительные результаты могут достигать 10%. Эти тесты особенно полезны для диагностики внекишечного амёбиаза, поскольку в этих случаях в фекалиях инвазивные стадии E. histolytica, как правило, отсутствуют. В эндемических очагах серологические методы рекомендуют применять у всех больных с подозрением на амёбиаз, которым планируют назначить глюкокортикоиды.
Лечение. 
Аспирацию (или чрескожное дренирование) абсцесса рекомендуют при больших размерах (более 6 см в диаметре), локализации абсцесса в левой доле или высоко в правой доле печени, сильных болях в животе и напряжении брюшной стенки, при которых вероятна угроза разрыва абсцесса, а также в случаях, когда химиотерапия неэффективна в течение 48 ч после её начал
Профилактика. Основными мерами профилактики амёбиаза являются защита водоёмов от фекального загрязнения и обеспечение качественного водоснабжения; предотвращение загрязнения пищевых продуктов цистами амёб; раннее выявление и лечение больных и бессимптомных носителей; систематическое санитарное просвещение. Кипячение воды — более эффективный метод уничтожения цист амёб по сравнению с применением химических средств
45. Энтеробиоз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Энтеробиоз (лат. enterobiosis; англ. enterobiasis, oxyuriasis) — антропонозный контагиозный гельминтоз человека, характеризующийся перианальным зудом и кишечными расстройствами
Этиология. Возбудитель — Enterobius vermicularis (острица). Мелкий круглый гельминт длиной 2-12 мм, длительность жизни взрослой особи до 1 мес. Источником инфекции является больной человек. Гельминт паразитирует в нижней части тонкой и верхних отделах толстой кишки. До достижения половой зрелости фиксируется головным концом к слизистой оболочке. Оплодотворенные взрослые самки теряют способность к прикреплению и перемещаются кишечной перистальтикой к прямой кишке. Затем они активно выползают из заднего прохода и откладывают яйца в перианальные складки. Из яйца в течение 4-6 ч. формируется инвазивная для человека подвижная личинка.
Эпидемиология. От больного человека заражение происходит контактно-бытовым путем (через загрязненные личинками руки, игрушки, посуду и т. д.). Кроме того, для энтеробиоза характерен феномен аутоинвазии: больной человек расчесывает зудящие места, а затем грязными руками заносит личинки в рот. Так инфекционный процесс может поддерживаться годам
Патогенез. Острицы наносят механическое повреждение при фиксации на слизистой оболочке кишечника, особенно сильно травмируют её самки своим длинным и острым хвостовым концом. Механическое раздражение и действие продуктов жизнедеятельности гельминтов вызывают зуд кожи в перианальной зоне. Острицы иногда погружаются в толщу слизистой оболочки кишки, при этом вокруг них формируются гранулёмы. В результате заноса патогенных микроорганизмов в глубь тканей острицы могут способствовать развитию тифлита, аппендицита, а сами гельминты, проникая в червеобразный отросток, способны вызвать аппендикулярную колику. Эктопическая миграция остриц бывает причиной вагинита, эндометрита и сальпингита у девочек. Описаны случаи, когда гельминтов находили в органах брюшной полости при нарушении целостности кишечной стенки, обусловленном другими болезнями, на фоне которых протекала инвазия.
Клиника. Наиболее специфическими проявлениями энтеробиоза являются активное выползание гельминтов из заднего прохода и резко выраженный аллергический компонент (зудящие дерматиты, эозинофилия крови). Больных беспокоит интенсивный зуд (ночью, когда самки выползают, чтобы отложить яйца), который может отмечаться не только в перианальной области, но и в области половых органов, на внутренней поверхности бедер, в нижних отделах передней брюшной стенки. Зуд обусловлен сильно аллергизирующим веществом, которое выделяет самка. Длительное и сильное расчёсывание зудящих мест (вокруг заднего прохода, в области промежности, половых губ) способствует лихенизации кожи и развитию экзематозного дерматита, пиодермии, сфинктерита, иногда парапроктита. Энтеробиоз во многих случаях бывает «пусковым фактором» зудящих дерматозов аногенитальной области. Больные, особенно дети, становятся раздражительными, жалуются на плохой сон, повышенную утомляемость; у детей регистрируются обмороки, эпилептиформные припадки, ночное недержание мочи. При массивной инвазии возникают нарушения со стороны ЖКТ: боли и урчание в животе, метеоризм, тошнота, рвота, запор или понос, иногда с примесью слизи. При проникновении остриц в червеобразный отросток могут появиться симптомы острого живота, в таких случаях больных оперируют: в удалённом аппендиксе обнаруживают катаральные изменения, в его просвете и толще слизистой оболочки находят яйца и взрослых гельминтов при кладке яиц. Кроме того, острицы могут заползать в женские половые органы, вызывая их воспаление
Осложнения. Дерматит
Диагностика. Взрослых гельминтов иногда обнаруживают на поверхности испражнений. Метод выбора для выявления яиц остриц — исследование материала (соскоба), полученного с перианальных складок с помощью тампона, шпателя, прозрачной липкой ленты, методом отпечатка с применением стеклянных глазных палочек с клеевым слоем по Рабиновичу. Рекомендуют не менее трёх повторных исследований, чтобы полностью исключить вероятность инвазии.
Лечение. Пирантел внутрь по 5–10 мг/кг однократно; повторный приём в той же дозе через 2 нед. Необходимость повторного лечения выбранным антигельминтным препаратом через 2 нед связана с тем, что из-за возможности ре- и суперинвазий один курс может не оказать должного эффекта. Непременные условия успешной дегельминтизации при энтеробиозе — одновременное лечение всех членов семьи (детского коллектива) и строгое соблюдение гигиенического режима для исключения повторного заражения. Перед лечением проводят тщательную влажную уборку помещения. Больного ребёнка рекомендуется вымыть (душ), перед сном сменить нижнее бельё, надеть трусы, плотно облегающие бёдра. Утром ребёнка необходимо подмыть, сменить нижнее бельё, постельное белье заменить или прогладить горячим утюгом. В помещении ежедневно следует проводить влажную уборку. То же самое выполняют при проведении повторного курса лечения. Контроль за эффективностью лечения с помощью указанных выше паразитологических методов проводят через 15 дней после полного завершения курса лечения.
Профилактика. В профилактике энтеробиоза значение придают выявлению источника инвазии и устранению путей передачи возбудителя. С этой целью один раз в год (после летнего периода при формировании детского коллектива или по эпидемическим показаниям) проводят плановые профилактические обследования детей и обслуживающего персонала. Детей, больных энтеробиозом, в период лечения и проведения контрольного обследования отстраняют от посещения дошкольных и образовательных учреждений. Если выявлено 20% и более заражённых энтеробиозом при проведении плановых профилактических обследований в организованных коллективах, в соответствии с нормативными документами одновременно всем детям и персоналу проводят противогельминтное лечение (двукратно с интервалом в 2 нед). В очаге энтеробиоза необходимо строго соблюдать чистоту жилища, служебных, школьных помещений. Лица, соприкасающиеся с больными, должны соблюдать чистоту тела, одежды, мыть руки перед едой и после посещения туалета.
46. Аскаридоз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Аскаридоз (лат. ascaridosis) — гельминтоз из группы кишечных нематодозов, вызываемый аскаридами (обычно Ascaris lumbricoides), характеризующийся в ранней стадии явлениями аллергии, а в поздней — диспепсическими явлениями и осложнениями при проникновении гельминтов в другие органы, а также в результате закупорки или спазма кишечника.
Этиология. Возбудитель аскаридоза — Ascaris lumbricoides (аскарида). Круглый гельминт длиной до 25-40 см. В цикле развития A. lumbricoides различают следующие стадии: половозрелую форму, яйцо, инвазионное яйцо, личинку.
Эпидемиология.. Источник инфекции — больной человек. Аскарида паразитирует в тонкой кишке человека, в котором удерживается, упираясь телом в его стенки. Продолжительность жизни одной особи около года. Питается содержимым тонкой кишки и клетками слизистой оболочки ее. Развитие яиц до инвазивной стадии происходит во внешней среде, поэтому заразиться аскаридозом непосредственно от человека не возможно. Прежде, чем яйца станут заразными, они должны 3 недели пролежать в почве. Человек заражается в результате заглатывания созревших яиц аскарид. Факторами передачи служат загрязнённые овощи, ягоды, другие пищевые продукты, вода, а также руки. В зоне умеренного климата сезон заражения длится до 7 мес — с апреля по октябрь, в условиях тёплого влажного климата — круглый год. В эндемичных очагах у людей формируется иммунитет к суперинвазии и реинвазии. Иммунный ответ более выражен в период паразитирования личиночных стадий гельминта, находящихся в процессе миграции. Иммунные реакции против личинок гельминта защищают хозяина от бесконтрольного увеличения интенсивности инвазии при повторном заражении. Для жителей эндемичных очагов, подверженных частым повторным заражениям, характерно развитие определённой невосприимчивости и, соответственно, кишечной инвазии низкой интенсивности. Аскаридоз широко распространён во влажных зонах умеренного, субтропического и тропического поясов, редко регистрируется в сухих степях, отсутствует в зоне вечной мерзлоты, высокогорья и пустынь. Аскаридозом в мире ежегодно поражаются более 1 млрд человек, большинство из которых составляют дети дошкольного и школьного возраста.
Патогенез. Из инвазионных яиц аскарид в тонкой кишке человека выходят рабдитовидные личинки, которые через 3–4 ч проникают в толщу слизистой оболочки. Далее происходит миграция личинок по системе портальной вены в печень, затем в лёгкие, где в течение 1–2 нед продолжается их развивитие. В печени на 5–6-й день после заражения и в лёгких (на 10-й день) личинки совершают линьку. В лёгких, разрывая капиллярную сеть и стенки альвеол, они проникают в просвет бронхов и продвигаются по воздухоносным путям в ротоглотку. С заглатываемой слюной и пищей личинки повторно попадают в тонкую кишку, где превращаются в половозрелых самцов и самок, совершив перед этим ещё две линьки. Продолжительность миграции личинок составляет около 2 нед, а созревание самок до начала откладывания яиц длится более 10 нед. В организме человека взрослая особь живёт 11–13 мес. В ранней миграционной стадии в основе патологических изменений лежит сенсибилизация организма продуктами метаболизма, линьки и распада погибших личинок. Аллергены аскарид самые сильные среди аллергенов паразитарного происхождения. При интенсивной инвазии наблюдается механическое повреждение стенки тонкой кишки, кровеносных сосудов, ткани печени, лёгких. Отмечают также эозинофильные инфильтраты в лёгких, капиллярный стаз, геморрагии. Клинические проявления в поздней кишечной стадии связаны с механическим воздействием гельминтов и продуктов их метаболизма на слизистую оболочку кишечника, что ведёт к нарушению пищеварения, моторной функции, нарушению азотистого баланса, гиповитаминозам. Один из выделяемых аскаридой полипетидов оказывает токсическое влияние на ЦНС. Аскариды могут мигрировать за пределы тонкой кишки: в жёлчные и панкреатические протоки, аппендикс, дыхательные пути. Иногда скопления аскарид приводят к закупорке, завороту кишки, инвагинации. Кишечная непроходимость чаще возникает при интенсивной инвазии, а инвагинация — при наличии единичных гельминтов или нескольких особей одного и того же пола. Аскариды существенно подавляют иммунологическую реактивность хозяина
Клиника. Выделяют две клинические стадии болезни — раннюю (миграционную) и позднюю (кишечную). Ранняя стадия часто протекает субклинически или бессимптомно. При клинически выраженной форме на 2–3-й день после заражения появляются такие признаки болезни, как недомогание, слабость, субфебрилитет. Наблюдаются уртикарные высыпания на коже, возможно увеличение селезёнки и печени. Более характерен симптомокомплекс поражения лёгких с образованием транзиторных инфильтратов, определяемых рентгенологически, и эозинофилией в периферической крови (синдром Лёффлера). В этих случаях появляются сухой кашель, иногда с мокротой с прожилками крови, одышка, боли в груди, удушье. В лёгких выслушивают сухие и влажные хрипы. В кишечной стадии аскаридоз у взрослых часто протекает со слабовыраженными симптомами или бессимптомно. Наблюдаемые симптомы (ухудшение аппетита, тошнота, иногда рвота, схваткообразные боли в животе, диарея или неустойчивый стул) малоспецифичны. Самочувствие больных ухудшается, снижается работоспособность, появляются головная боль, головокружение. У детей в ранней стадии аскаридоза может развиться пневмония, при интенсивной инвазии — тяжёлая интоксикация. Снижается масса тела, дети становятся капризными, рассеянными, возможны эпилептиформные приступы, менингизм, синдром Меньера (тошнота, рвота, боль при повороте головы-миграция личинок в среднее ухо); в анализе крови — нормо- и гипохромная анемия, эозинофилия.
Осложнения. Различают кишечные и внекишечные осложнения аскаридоза, которые возникают в поздней стадии инвазии и часто обусловлены повышенной подвижностью взрослых гельминтов. Наиболее частое осложнение, особенно у детей в возрасте от 4 до 8 лет, — непроходимость кишечника. При деструктивных изменениях слизистой оболочки кишечника или после оперативных вмешательств возможны проникновение аскарид в брюшную полость и развитие перитонита. Внедрение гельминтов в желчевыводящие и панкреатические ходы может привести к механической желтухе, реактивному панкреатиту, в случае присоединения вторичной бактериальной инфекции развиваются гнойный холангит, абсцессы печени, иногда аппендицит. При рвоте, антиперистальтических движениях аскариды могут попасть в пищевод, откуда они проникают в глотку, дыхательные пути, вызывая асфиксию
Диагностика. При распознавании ранней (миграционной) стадии аскаридоза необходимо ориентироваться на симптомы поражения лёгких в сочетании с эозинофилией крови. Редко удаётся обнаружить личинок аскарид в мокроте. Существуют методы серодиагностики (ИФА, РЛА), но они широкого применения в практике не имеют. Лабораторная диагностика аскаридоза в кишечной стадии заключается в выявлении яиц гельминтов в фекалиях. При отрицательных результатах в случае подозрения на гельминтоз рекомендуют проводить повторные исследования с интервалом 1–2 нед.
Лечение. Пирантел назначают по 10 мг/кг однократно внутрь после еды. При приёме указанных антигельминтных препаратов не требуется специальной диеты и назначения слабительных средств. Патогенетическая и симптоматическая терапия необходима при длительной и интенсивной инвазии: применяют пробиотики и ферментативные препараты. Дополнительные методы лечения При возникновении хирургических осложнений необходимо оперативное или инструментальное вмешательство.
Профилактика. В профилактике аскаридоза основное значение имеют санитарное благоустройство населённых мест и охрана почвы от фекального загрязнения. В индивидуальной профилактике важно строго соблюдать правила личной гигиены, тщательно промывать употребляемые в пищу сырые овощи, ягоды и фрукты. В очагах аскаридоза с поражённостью менее 10% населения один раз в два года проводят паразитологическое обследование 20% жителей; в очагах, где поражено более 10% жителей, ежегодно обследуют всё население. Для дегельминтизации используют антигельминтные препараты с учётом особенностей их применения в разных возрастных группах.
47. Токсокароз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика
Токсокароз (лат. toxocarosis) — хронический тканевый гельминтоз, вызываемый миграцией личинок гельминта собак Toxocara canis в организме человека. Характеризуется рецидивирующим течением с поражением внутренних органов и глаз.
Этиология. Возбудитель токсокароза (аскарида собачья) T. canis — раздельнополые нематоды, половозрелые особи которых достигают относительно больших размеров (длина самки 9–18 см, самца — 5–10 см). Яйца токсокары шаровидной формы, размером 65–75 мкм. Т. canis паразитирует у собак и других представителей семейства псовых. В жизненном цикле данного гельминта выделяют циклы развития — основной и два вспомогательных. Основной цикл развития токсокар соответствует по схеме «собака–почва–собака». Первый тип вспомогательного цикла характеризуется трансплацентарной передачей личинок токсокар плоду по схеме «окончательный хозяин (собака)–плацента– окончательный хозяин (щенок)». Второй тип вспомогательного цикла происходит с участием паратенических (резервуарных) хозяев. Ими могут быть грызуны, свиньи, овцы, птицы, земляные черви. В их организме мигрирующие личинки не способны превращаться во взрослых особей. Однако при поедании резервуарного хозяина собакой или другим животным семейства псовых личинки, попадая в кишечник облигатного хозяина, развиваются во взрослых гельминтов. Таким образом, широкому распространению токсокароза среди животных способствует совершенный механизм передачи возбудителя, при котором сочетаются прямой (заражение яйцами из окружающей среды), вертикальный (заражение плода личинками через плаценту), трансмаммарный (передача личинок с молоком) пути передачи и заражение через паратенических хозяев. Продолжительность жизни половозрелых особей в кишечнике основных хозяев составляет 4–6 мес. Самка Т. canis откладывает более 200 тыс. яиц в сутки. Срок созревания яиц в почве (от 5 сут до 1 мес) зависит от температуры окружающей среды и влажности. В средней полосе России яйца токсокар могут сохранять жизнеспособность в почве в течение всего года.
Эпидемиология. Токсокароз — зооноз с оральным механизмом передачи. Источник инвазии в синантропном очаге для людей — собаки, загрязняющие почву фекалиями, которые содержат яйца токсокар. Люди не могут быть источником инфекции, так как в организме человека взрослые особи паразита из личинок не образуются и яйца не выделяются. Человек служит резервуарным, или паратеническим, хозяином токсокар, однако фактически он «экологический тупик». Поражённость собак токсокарами колеблется в зависимости от пола, возраста, способа их содержания и практически во всех районах очень высокая — до 40–50% и выше, а в сельской местности может достигать 100%. Наибольшую поражённость отмечают у щенков в возрасте 1–3 мес. Прямой контакт с собаками не играет существенной роли в заражении людей. Основные предпосылки передачи возбудителя — загрязнённость почвы яйцами гельминта и контакт людей с ней. В настоящее время доказано значение геофагии в поражённости детей токсокарозом. Геофагия — пример прямого заражения возбудителями гельминтозов без участия каких-либо других факторов передачи, причём человек в этих случаях получает массивную инвазию, предопределяющую, как правило, тяжёлое течение болезни. Отмечают высокую поражённость токсокарозом владельцев приусадебных, дачных земельных участков, огородов, а также людей, живущих во дворах, где выгуливают собак, что подтверждает роль бытового контакта с почвой при заражении яйцами токсокар. Яйца токсокар могут передаваться с овощами и столовой зеленью. Факторами передачи токсокар бывают контаминированная шерсть животных, вода, руки. Установлена роль тараканов в распространении гельминтоза: они поедают значительное количество яиц токсокар и выделяют в окружающую среду до 25% яиц в жизнеспособном состоянии. Токсокароз распространён повсеместно. Наиболее часто им болеют дети. Установлена относительно высокая поражённость некоторых профессиональных групп: ветеринаров, рабочих коммунального хозяйства, садоводов-любителей. Люди заражаются токсокарозом в течение всего года, однако чаще заражение происходит в летне-осенний период, когда количество яиц в почве и контакт с ней максимальны.
Патогенез. T. canis — несвойственный человеку возбудитель гельминтоза, личинки которого никогда не превращаются во взрослых особей. Это возбудитель гельминтоза животных, способный в миграционной (ларвальной) стадии паразитировать у человека и вызывать заболевание, получившее название синдрома «Visceral larva migrans». Синдром характеризуется длительным рецидивирующим течением и полиорганными поражениями аллергической природы. В организме человека, как и у других партенических хозяев, циклы развития и миграции осуществляются следующим образом: из яиц токсокар, попавших в рот, а затем в желудок и тонкую кишку, выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает; их окружает воспалительный инфильтрат, и образуются гранулёмы. При интенсивной инвазии гранулематозное поражение тканей наблюдают в лёгких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах. Личинка в организме человека может выживать до 10 лет. Такая её жизнеспособность связана с выделением маскирующей субстанции, способной защитить личинку от агрессии эозинофилов и антител хозяина. Личинки гельминта, находящиеся в тканях, под влиянием различных факторов периодически возобновляют миграцию, что обусловливает рецидивы заболевания. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Экскреторно-секреторные антигены живых и соматические антигены погибших личинок оказывают сильное сенсибилизирующее действие с развитием реакций ГНТ и ГЗТ, которые проявляются отёками, кожной эритемой, нарушением проходимости дыхательных путей. Определённое значение в патогенезе имеют иммунные комплексы «антиген–антитело». Недостаточно изучены факторы, определяющие возникновение токсокароза глаз. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма. По сравнению с аскаридами и некоторыми другими гельминтами T. canis обладает наиболее сильным поливалентным иммуносупрессивным действием. Установлено, что при токсокарозе у детей уменьшается эффективность вакцинации и ревакцинации против кори, дифтерии и столбняка.
Клиника. Висцеральный токсокароз является самой частой формой (до 90% случаев заболевания). Субфебрильная лихорадка – один из ведущих синдромов висцерального токсокароза. Интоксикационный синдром выражен умеренно, проявляется снижением аппетита, недомоганием. У 50-65% больных отмечаются симптомы поражения респираторного тракта по типу обструктивного бронхита: длительный малопродуктвный кашель преимущественно в ночное время, приступы удушья, признаки дыхательной недостаточности. Всегда регистрируются «летучие» эозинофильные инфильтраты в легких. У 70-80% больных отмечаются симптомы поражения ЖКТ: боли в животе неопределенной локализации, метеоризм, флатуленция, рвота, диарея, гепатомегалия, желтуха, гипертрансфераземия. В клиническом анализе крови у пациентов с токсокарозом выявляют эозинофилию (от 20 до 85%), лейкоцитоз, снижение гемоглобина, повышение СОЭ. В биохимическом анализе крови отмечают гиперпротеинемию, снижение уровня альбуминов, гипергаммаглобулинемию, не более чем двух- трехкратное повышение уровня иммуноглобулина Е. Глазная форма (офтальмотоксокароз) развивается реже. По характеру патоморфологических изменений все случаи токсокароза глаза можно разделить на две основные группы: солитарные гранулемы и хронические эндоофтальмиты с экссудацией. Клинические варианты офтальмотоксокароза: гранулемы в заднем отделе глаза; гранулемы в периферических отделах глаза; увеит; хронический эндоофтальмит; абсцесс стекловидного тела; неврит зрительно нерва; кератит; мигрирующие личинки в стекловидном теле. Клиническими признаками поражения глаза при токсокарозе являются приобретенное косоглазие, снижение зрения, лейкокории. Как правило, токсокарозом поражается только один глаз. Личинки токсокар могут быть обнаружены при офтальмоскопическом исследовании в средах глаза. Больные данной формой токсокароза как правило имеют невысокие титры противотоксокарозных антител. Глазной токсокароз редко сочетается с висцеральными поражениями. Обычно поражается один глаз, но возможны и двусторонние поражения. В большинстве случаев глазная форма токсокароза регистрируется у детей старше 12 лет. Чаще болеют лица мужского пола. Кожная форма токсокароза встречается редко и характеризуется клинической картиной Larva migrans. Неврологическая форма токсокароза проявляется менингитом или менингоэнцефалитом. В этих случаях у больных наблюдаются гемипарезы, параличи, судороги, эпилептиформные припадки, атаксия, формируются поведенческие расстройства (гиперактивность, аффективные припадки, агрессия, задержка психомоторного развития). Поражение центральной нервной системы, как ведущего клинического проявления висцеральной формы токсокароза наблюдается редко. Поражения мышц при токсокарозе - редкое проявление инвазии. Клинически наблюдаются миалгии, усиливающиеся при физической нагрузке, ходьбе, болезненность мышц при пальпации, их уплотнение, - в сочетании с мигрирующей эритемой. Поражение щитовидной железы при токсокарозе протекает с симптомами объемного поражения щитовидной железы. Поражение лимфатических желез при токсокарозе наблюдается достаточно часто, проявляется полилимфаденопатией. Может отмечаться значительное увеличение лимфоузлов подчелюстной области, области шеи, ворот печени, селезенки. Пальпируемые лимфоузлы болезненные, подвижные, без воспалительных изменений.
Осложнения. Возможно нарушение функций жизненно важных органов (мозга, глаз и др.). В некоторых случаях вероятно развитие бронхиальной астмы. Глазной токсокароз — одна из возможных причин потери зрения.
Диагностика. Прижизненный паразитологический диагноз токсокароза возможен крайне редко и только при исследовании биопсийного материала, когда в тканях удаётся обнаружить и верифицировать личинки токсокар. Диагноз устанавливают на основании данных эпидемиологического анамнеза, клинической симптоматики. Учитывают наличие стойкой длительной эозинофилии, хотя при глазном токсокарозе она не всегда встречается. Указание на содержание в семье собаки или на тесный контакт с собаками, на геофагию свидетельствует об относительно высоком риске заражения токсокарозом. Иммунологические исследования направлены на определение содержания специфических IgG к антигену T. canis в сыворотке крови методом ИФА, который обладает высокой чувствительностью и достаточной специфичностью при висцеральной локализации личинок, однако недостаточно информативен при поражении глаз. В связи с циклическим течением инвазии с рецидивами и ремиссиями в динамике возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного. В клиническое исследование больных токсокарозом рекомендуют включать биохимический анализ крови, рентгенологическое исследование лёгких, по показаниям — бронхоскопию, бронхографию, ЭКГ, УЗИ органов брюшной полости.
Лечение. Альбендазол, пирантел-длительная терапия. Противопаразитарную терапию при глазном токсокарозе проводят по тем же схемам, что и при висцеральном токсокарозе. Показания к лечению определяют индивидуально, в зависимости от характера поражения глаз и с учётом возможных осложнений в результате лечения. До начала цикла лечения рекомендуют применять глюкокортикоиды в течение 1 мес (1 мг/кг преднизолона в сутки). Гранулёмы удаляют микрохирургическими методами, для разрушения личинок токсокар в средах глаза используют лазеркоагуляцию. Больным токсокарозом при лихорадке назначают жаропонижающие ЛС, для купирования аллергических проявлений — антигистаминные препараты, при наличии признаков бронхообструкции проводят бронхолитическую терапию. При бессимптомном течении инвазии с низкими титрами специфических антител этиотропную терапию не проводят.
Профилактика. Профилактика включает соблюдение личной гигиены, обучение детей санитарным навыкам. Важны своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4–5 нед, а также беременных самок. Необходимо ограничивать численность безнадзорных собак, оборудовать специальные площадки для выгула. Следует проводить систематическую санитарно-просветительную работу среди населения, сообщать информацию о возможных источниках инвазии и путях передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, владельцы домашних животных, персонал питомника служебных собак, землекопы и др.).
48. Дифиллоботриоз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Дифиллоботриозы — кишечные гельминтозы, вызываемые лентецами. Характеризуются хроническим течением с преимущественным нарушением деятельности ЖКТ и развитием мегалобластной анемии.
Этиология. Возбудитель дифиллоботриоза — Diphyllobotrium latum (лентец широкий). Это крупный ленточный гельминт длиной 2-10 м, тело которого состоит из головки, шейки и члеников. На головке паразита имеются 2-е присасывательные бороздки (ботрии), при помощи которых он фиксируется к слизистой оболочке кишок. Обитает лентец широкий в верхних отделах тонких кишок, питается эндоосмотически всей поверхностью тела, всасывая при этом различные пищевые вещества, в том числе витамин В12 и фолиевую кислоту. Развитие D. latum происходит со сменой трёх хозяев. Окончательные хозяева — человек, реже животные, питающиеся рыбой (кошка, собака, медведь, лисица и др.). В отличие от цепней зрелые членики лентеца не отрываются от стробилы. Яйца выделяются с фекалиями и сохраняют жизнеспособность в течение 3–30 дней, но продолжают развитие только при попадании в воду. В воде через 2–3 нед из яйца выходит корацидий, которого заглатывает промежуточный хозяин. В его теле происходит развитие второй личиночной стадии — процеркоида. Рачков, содержащих инвазионные личинки, проглатывает дополнительный хозяин — хищная (щука, окунь, ёрш, налим) или проходная лососёвая рыба (кета, горбуша), — в кишечнике которого рачки перевариваются, а процеркоиды мигрируют в мышцы, икру, печень и другие органы, где превращаются в плероцеркоиды (инвазионная для человека стадия).
Эпидемиология. Основным источником заражения окружающей среды служит человек, определённую роль могут играть домашние и дикие животные, питающиеся рыбой. Механизм заражения человека пероральный. Факторы передачи — инвазированная сырая, недостаточно просоленная или плохо термически обработанная рыба, а также икра. Заболеваемость дифиллоботриозом имеет очаговый характер. Чаще поражается взрослое население, особенно занятое ловлей и переработкой рыбы. Дифиллоботриозы распространены преимущественно в северном полушарии: в странах севера Европы, США, Канаде; в России основные очаги гельминтоза расположены в бассейне рек Северо-Западного региона, Волги, Енисея, Лены, на Сахалине.
Патогенез. Лентецы, прикрепляясь к слизистой оболочке тонкой кишки, ущемляют её ботриями, изъязвляя, некротизируя и атрофируя травмируемые участки. При множественной инвазии гельминты могут вызватъ непроходимость кишечника. Эозинофилия и катаральные явления в слизистой оболочке в раннем периоде болезни обусловлены сенсибилизацией организма к антигенам гельминта. Эндогенный гипо- и авитаминоз В12 и фолиевой кислоты лежит в основе патогенеза дифиллоботриозной мегалобластной анемии. Гельминт выделяет специфический белковый компонент (рилизинг-фактор), нарушающий связь витамина В12 и гастромукопротеина. В результате длительного паразитирования возбудителя (до 20 лет), даже одной особи гельминта, анемия приобретает черты пернициозной и сопровождается поражением периферических нервов и спинного мозга.
Клиника. Дифиллоботриоз нередко протекает бессимптомно или со слабовыраженными ощущениями дискомфорта в животе. Однако при любом клиническом течении наблюдают отхождение крупных фрагментов гельминта с каловыми массами. При манифестном течении инвазии возникают боли в животе, периодически приобретающие схваткообразный характер, тошнота, гиперсаливация. Аппетит иногда повышен, но отмечаются похудание и снижение работоспособности. При развитии анемии более выражены повышенная утомляемость, головокружение, сердцебиение. Раннее проявление анемии — глоссит, сопровождающийся жжением языка. В дальнейшем могут появиться боли при приёме пищи вследствие распространения воспалительно-дистрофических изменений на дёсны, слизистую оболочку щёк, нёба, глотки и пищевода. В тяжёлых случаях наблюдается увеличение печени и селезёнки. Неврологические нарушения при дифиллоботриозе: парестезии, нарушение чувства вибрации, онемение, атаксия — возникают чаще, чем при истинной пернициозной анемии, могут не сопровождаться признаками анемии. Позже нарушается проведение по боковым столбам, появляются спастичность, гиперрефлексия; больные становятся раздражительными, может развиться депрессия.
Осложнения. Основным осложнением дифиллоботриоза является В12-дефицитная анемия, иногда возможно развитие кишечной непроходимости.
Диагностика. Дифиллоботриоз диагностируют, основываясь на клинико-эпидемиологических данных (употребление рыбы, сочетание диспепсического синдрома с признаками анемии), выявлении яиц гельминтов при копроовоскопическом исследовании или в результате исследования выделенных при дефекации фрагментов стробилы гельминта. В мазках периферической крови определяют анизо- и пойкилоцитоз, базофильную зернистость эритроцитов (в них нередко видны тельца Жолли), ретикулоцитопению, тромбоцитопению, нейтропению. Дифиллоботриозная В12-дефицитная анемия развивается примерно у 2% инвазированных D. latum, примерно у 40% больных понижено содержание витамина в сыворотке крови. Чаще гематологические изменения регистрируют у лиц пожилого возраста.
Лечение. Специфическое лечение проводят празиквантелем (однократно) или никлозамидом. При выраженной анемии и уровне цианокобаламина в сыворотке менее 100 пг/мл до дегельминтизации показано лечение цианокобаламином в дозе 200–400 мкг/кг в течение 2–4 нед.
Профилактика. Чтобы предотвратить заражение, употреблять в пищу рыбу следует после тщательной термической обработки или длительного посола (последнее относится и к употреблению икры). Необходимо охранять водоёмы от загрязнения фекалиями человека и животных, проводить санитарно-просветительную работу среди населения очагов.
49. Малярия: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Малярия — антропонозная трансмиссивная протозойная болезнь, характеризующаяся поражением эритроцитов, рецидивирующим циклическим течением, приступами лихорадки, гепатоспленомегалией, анемией.
Этиология. Малярию человека вызывают 4 вида возбудителей; Plasmodium falciparum— возбудитель тропической малярии, P. vivax—возбудитель трехдневной малярии (вивакс-малярия), P. ovale—возбудитель овале-малярии и P. malariae — возбудитель четырехдневной малярии. Плазмодии малярии проделывают сложный цикл развития в организме позвоночного хозяина (тканевая и эритроцитарная шизогония) и в организме комара-переносчика (спорогония). При заражении во время укуса комара в организм проникают спорозоиты, которые превращаются в клетках печени в тканевые шизонты. Они многократно делятся и образуют большое число (до 50 000 из каждого шизонта) тканевых мерозоитов. Длительность преэритроцитарного цикла 6—9 суг Затем паразиты проникают в эритроциты, и начинается зритроцитарная шизогония. Продолжительность шизогонии у возбудителей четырехдневной малярии 72 ч, у остальных—48 ч.
Эпидемиология. Источником возбудителя инфекции выступает больной человек или паразитоноситель, в крови которого содержатся гаметоциты. Малярия — трансмиссивная инфекция, передающаяся через укус комара. Гаметоциты Р. vivax, Р. ovale и Р. malariae обнаруживаются в крови в первые дни болезни; их количество возрастает после нескольких циклов эритроцитарной шизогонии. При заражении P. falciparum человек становится источником инфекции спустя 10–12 дней после начала паразитемии и может им оставаться в течение 2 мес и более. Переносчики малярии в природных условиях — комары рода Anopheles. Кроме естественного трансмиссивного возможны другие пути передачи малярии: от матери плоду или новорождённому (вертикальная передача); трансфузионный путь — при переливании донорской крови, содержащей возбудитель, при трансплантации органов; парентеральное заражение возможно при медицинских манипуляциях. Вертикальная передача инфекции происходит у неиммунных к малярии матерей. Заражение чаще происходит при родах, когда её кровь попадает в кровоток плода при отслойке плаценты. В донорской крови плазмодии могут выживать 1–2 нед. Зарегистрированы случаи прививной малярии у наркоманов. Малярия — сезонная инфекция; это связано с активностью комаров-переносчиков. В районах с умеренным и субтропическим климатом сезон передачи ограничивается летне-осенними месяцами с устойчивой среднесуточной температурой выше 16 °С. В РФ длительность малярийного (эпидемического) сезона варьирует от 1,5 до 3 мес и более. В тропической зоне инфекция передаётся круглогодично, а перерывы связаны с режимом осадков. В настоящее время малярия остаётся наиболее широко распространённой в мире тропической болезнью. Из четырёх видов возбудителей малярии человека наиболее распространён в мире P. vivax. В субтропиках и тропиках в генофонде популяции P. vivax преобладают спорозоиты, вызывающие болезнь после короткой инкубации (10–21 день). Для гиперэндемичных очагов тропической Африки, где преобладает P. falciparum, характерна относительно стабильная иммунная структура коренного населения: дети в возрасте до 6 мес не заболевают благодаря пассивному иммунитету, полученному от матери; большинство детей в возрасте 6–24 мес поражены P. falciparum; пассивный иммунитет угас, активный ещё не развит; в этой группе наблюдают самую высокую смертность от малярии; у детей старше 2 лет P. falciparum обнаруживают реже, течение малярии смягчено в результате приобретённого иммунитета, с возрастом интенсивность паразитемии уменьшается; у взрослых P. falciparum обнаруживают редко вследствие высокой напряжённости иммунитета, при инфицировании клинические проявления отсутствуют. Легко переносят тропическую малярию также носители аномального гемоглобина S (серповидно-клеточная анемия) и лица с некоторыми другими генетически обусловленными аномалиями гемоглобина и ферментов эритроцитов (дефицит Г-6-ФДГ).
Патогенез. Вся клиническая картина малярии обусловлена эритроцитарной шизогонией — ростом и размножением в крови бесполых эритроцитарных форм паразита. Тканевая шизогония клинически не проявляется. Малярийный приступ связан с завершением эритроцитарной шизогонии, массовым распадом эритроцитов и попаданием в кровь большого числа мерозоитов, продуктов метаболизма паразитов, обладающих пирогенными и токсическими свойствами, которые провоцируют развитие лихорадочной реакции. Ввиду цикличности эритроцитарной шизогонии лихорадочные приступы повторяются каждые 48 ч при трёхдневной, овале- и тропической малярии и через 72 ч при четырёхдневной. В организм человека при заражении попадает гетерогенная популяция малярийных паразитов, и шизогония в начальном периоде протекает асинхронно, из-за этого тип лихорадки может быть неправильным. По мере формирования иммунных реакций способность к паразитированию в эритроцитах сохраняется у одной главной генерации плазмодиев, определяющей свойственный данному виду ритм лихорадки. Только при тропической малярии может быть несколько (2–3) основных генераций плазмодиев, поэтому лихорадка чаще носит неправильный характер. Анемия, характерная для малярии, — следствие разрушения эритроцитов находящимися в них паразитами. Известно, что Р. vivax и Р. ovale внедряются преимущественно в молодые эритроциты, Р. malariae — в зрелые. Р. falciparum инфицирует эритроциты разной степени зрелости, что способствует более значительному их поражению и гемолизу, поэтому при тропической малярии в генезе анемии гемолиз играет ведущую роль. Дополнительными факторами гемолиза эритроцитов выступают также аутоиммунные механизмы, повреждающие неинфицированные эритроциты. Развивающаяся при малярии гиперплазия ретикулоэндотелиальных элементов селезёнки угнетает гемопоэз, что усиливает анемию и тромбоцитопению. Увеличение печени и селезёнки вначале обусловлено застойными явлениями в органах, но вскоре в них происходит лимфоидная и ретикулоэндотелиальная гиперплазия. В результате гемолиза эритроцитов, а также поражения гепатоцитов развивается желтуха. Уменьшение всасывания углеводов и торможение глюконеогенеза в печени вызывает гипогликемию. Активация анаэробного гликолиза приводит к накоплению лактата в крови, цереброспинальной жидкости и возникновению лактат-ацидоза, что служит одной из причин тяжёлого течения тропической малярии. При тропической малярии изменяются свойства эритроцитов, вследствие чего нарушается микроциркуляция (цитоадгезия, секвестрация, розетинг). Цитоадгезия — приклеивание поражённых эритроцитов к эндотелиальным клеткам, причина секвестрации в капиллярах и посткапиллярных венулах. Основную роль в цитоадгезии отводят специфическим белкам-лигандам (их экспрессия на поверхности эритроцитов индуцируется паразитом) и рецепторам, находящимся на наружной поверхности эндотелиальных клеток. Закупорка сосудов вызывает ишемию поражённых органов. На мембранах эритроцитов возникают протуберанцы (кнобы), которые контактируют с выростами в форме псевдоподий, образующимися на эндотелиальных клетках. Некоторые разновидности Р. falciparum вызывают прилипание здоровых эритроцитов к инфицированным — в результате образуются «розетки». Эритроциты становятся ригидными, что ухудшает реологические свойства крови и усугубляет нарушение микроциркуляции. Важный повреждающий фактор — гипоксия, вызванная недостаточной кислородно-транспортной функцией заражённых эритроцитов. Наименее устойчива к гипоксии ткань мозга, что способствует развитию церебральной малярии. Возникают нарушения в свёртывающей системе крови: при тяжёлой тропической малярии наблюдают признаки ДВС-синдрома тромбоцитопении и гипофибриногенемии. Определённую роль в патогенезе тропической малярии отводят генерализованной неспецифической воспалительной реакции. Поражение сосудов вызывается в основном действием медиаторов воспаления. Наиболее активны продукты перекисного окисления липидов и протеазы, выделяемые гранулоцитами. В патогенезе тяжёлой малярии значительное внимание уделяют цитокинам, в частности ФНО и ИЛ (ИЛ-2 и ИЛ-6). Наиболее характерные изменения при тяжёлой тропической малярии возникают в головном мозге, где наблюдают отёк, набухание вещества мозга, периваскулярные и периганглионарные разрастания нейроглии (гранулёмы Дюрка). Капилляры блокируются инвазированными эритроцитами и паразитами; наблюдаются обширные гемостазы. Развивается периваскулярный отёк с геморрагиями и очаговыми некрозами. На основании патологоанатомической картины можно заключить, что в случаях малярийной комы развивается специфический менингоэнцефалит. Малярийная инфекция способна дезорганизовать иммунный ответ хозяина, что запускает каскад иммунопатологических реакций. Фиксация иммуноглобулинов и комплемента на базальных мембранах клубочков вызывает острую нефропатию. Нефротический синдром, развивающийся у больных четырёхдневной малярией, относят к иммунокомплексным гломерулопатиям.
Клиника.
Трёхдневная малярия. Инкубационный период составляет от 10–21 дня до 6–14 мес. Продромальные явления перед первичным малярийным приступом наблюдают редко, но они часто предшествуют рецидивам и выражаются чувством общего недомогания, слабостью, разбитостью, болями в поясничной области, конечностях, незначительным подъёмом температуры тела, ухудшением аппетита, головной болью. Продолжительность продромального периода в среднем составляет 1–5 дней. Вначале температурная кривая носит неправильный характер (инициальная лихорадка), что связано с несинхронным выходом в кровь нескольких генераций P. vivax. В последующем начинаются типичные малярийные приступы с интермиттирующей трёхдневной лихорадкой, свидетельствующие о формировании основной генерация паразитов в крови. В малярийном лихорадочном приступе клинически отчётливо выражены три фазы, непосредственно следующие одна за другой: стадия озноба, жара и пота. Приступ начинается с озноба, его интенсивность может быть разной — от лёгкого познабливания до потрясающего озноба. В это время больной ложится в постель, безуспешно пробует согреться, но озноб нарастает. Кожа становится сухой, на ощупь шероховатой или «гусиной», холодной, конечности и видимые слизистые цианотичными. Отмечают сильную головную боль, иногда рвоту, боли в суставах и поясничной области. Стадия озноба продолжается от нескольких минут до 1–2 ч, её сменяет стадия жара. Больной сбрасывает с себя одежду, бельё, но это не приносит ему облегчения. Температура тела достигает 40–41 °С, кожные покровы становятся сухими и горячими, лицо краснеет. Головная боль, боли в поясничной области и суставах усиливаются, возможны бред и спутанность сознания. Стадия жара продолжается от одного до нескольких часов и сменяется периодом потоотделения. Температура критически падает, потоотделение нередко профузное, поэтому больному приходится неоднократно менять бельё. Ослабленный перенесённым приступом, он вскоре засыпает. Продолжительность приступа составляет 6–10 ч. Характерным считают наступление приступов болезни в утренние и дневные часы. После приступа начинается период апирексии, длящийся около 40 ч. После 2–3 температурных приступов отчётливо увеличиваются печень и селезёнка. Изменения в крови: анемия, развивающаяся постепенно со второй недели болезни, лейкопения, нейтропения с палочкоядерным сдвигом влево, относительный лимфоцитоз, анэозинофилия и повышенная СОЭ. При естественном течении болезни без этиотропного лечения после 12–14 приступов (4–6 нед) интенсивность лихорадки уменьшается, приступы постепенно угасают, размеры печени и селезёнки сокращаются. Однако спустя 2 нед—2 мес возникают ранние рецидивы, характеризующиеся синхронной температурной кривой, увеличением печени и селезёнки, анемией. В последующем с нарастанием иммунитета паразиты исчезают из крови и наступает латентный период. Если в это время не провести лечение гистошизотропными препаратами, то через 6–8 мес (а иногда спустя 1–3 года) происходит активация «дремлющих» тканевых форм паразитов и развиваются отдалённые рецидивы. Они характеризуются острым началом, более лёгким течением, ранним увеличением селезёнки, коротким числом приступов (до 7–8), меньшей интенсивностью и длительностью паразитемии, наличием гаметоцитов в крови.
Овале-малярия. По многим клинико-патогенетическим признакам сходна с трёхдневной vivax-малярией. Инкубационный период 11–16 дней. При овале-малярии наблюдают склонность возбудителя к первичной латенции. При этом длительность инкубационного периода может растянуться на 2 мес—2 года и более. В клинической картине сначала преобладает интермиттирующая трёхдневная лихорадка, реже она бывает ежедневной. Лихорадочные приступы чаще возникают в вечерние часы, а не в первой половине дня, как это свойственно другим формам малярии. Овале-малярию характеризует преимущественно лёгкое течение с небольшим количеством пароксизмов, протекающих без выраженного озноба и с менее высокой температурой на пике приступов. Характерно, что пароксизмы при первичной атаке очень часто прекращаются спонтанно. Это объясняется быстрым формированием стойкого иммунитета. Если не проводится лечение гистошизотропными препаратами, возможны 1–3 рецидива с межрецидивным интервалом от 17 дней до 7 мес.
Четырёхдневная малярия. Протекает обычно доброкачественно. Инкубационный период от 3 до 6 нед. Продромальные симптомы наблюдают редко. Начало болезни острое. С первого приступа устанавливается интермиттирующая лихорадка с периодичностью приступов через 2 дня. Пароксизм обычно начинается в полдень, средняя его продолжительность составляет около 13 ч. Период озноба длительный и резко выраженный. Период жара продолжается до 6 ч, его сопровождают головная боль, миалгия, артралгия, иногда тошнота, рвота. Иногда больные беспокойны и бредят. В межприступный период состояние больных удовлетворительное. Анемия, гепатоспленомегалия развиваются медленно — не ранее чем через 2 нед после начала болезни. При отсутствии лечения наблюдается 8–14 приступов, но процесс эритроцитарной шизогонии на низком уровне длится многие годы. Чаще всего инфекция протекает в форме паразитоносительства без активизации эритроцитарной шизогонии, что делает таких лиц потенциально опасными донорами. В эндемичных очагах четырёхдневная малярия служит причиной нефротического синдрома с неблагоприятным прогнозом у детей.
Тропическая малярия. Наиболее тяжёлая форма малярийной инфекции. Инкубационный период составляет 8–16 дней. В конце его у части неиммунных лиц отмечают продромальные явления продолжительностью от нескольких часов до 1–2 дней: недомогание, слабость, разбитость, ломота в теле, миалгия и артралгия, головная боль. У большинства больных тропическая малярия начинается остро, без продромального периода, с подъёма температуры тела до 38–39 °С. Если в инфицированном организме у нескольких генераций Р. falciparum циклы эритроцитарной шизогонии заканчиваются не одновременно, клинически это часто выражается отсутствием циклической периодичности лихорадочных приступов. Приступы, протекающие с поочерёдной сменой фаз, начинаются с озноба продолжительностью от 30 мин до 1 ч. В этот период кожные покровы при осмотре бледные, холодные на ощупь, нередко с шероховатостью по типу «гусиной кожи». Озноб сопровождается подъёмом температуры тела до 38–39 °С. С прекращением озноба наступает вторая фаза пароксизма — жар. У больных возникает лёгкое ощущение тепла, иногда они испытывают чувство истинного жара. Кожные покровы становятся горячими на ощупь, лицо гиперемировано. Продолжительность этой фазы около 12 ч, её сменяет слабо выраженная потливость. Температура тела падает до нормальных и субнормальных цифр и через 1–2 ч повышается снова. В некоторых случаях начало тропической малярии сопровождают тошнота, рвота, диарея. Иногда регистрируют катаральные симптомы со стороны верхних дыхательных путей: кашель, насморк, боли в горле. В более поздние сроки наблюдают герпетические высыпания на губах и крыльях носа. В острой стадии у больных отмечают гиперемию конъюнктивы, при тяжёлом течении заболевания её могут сопровождать петехиальные или более крупные субконъюнктивальные кровоизлияния. В период разгара тропической малярии озноб менее выражен, чем в первые дни болезни, его продолжительность составляет 15–30 мин. Лихорадка продолжается сутками, периоды апирексии регистрируют редко. При лёгком течении болезни температура тела на пике достигает 38,5 °С, продолжительность лихорадки 3–4 дня; при средней степени тяжести — соответственно 39,5 °С и 6–7 дней. Тяжёлое течение болезни характеризуется повышением температуры тела до 40 °С и выше, а продолжительность её составляет восемь и более дней. Длительность отдельных пароксизмов (а по существу наслоение нескольких) при тропической малярии доходит до 30–40 ч. Преобладает неправильный тип температурной кривой, реже наблюдают ремиттирующий, изредка — интермиттирующий и постоянный типы. Увеличение печени обычно определяют на 3 день болезни, увеличение селезёнки — также с 3 дня, но его регистрируют чаще только перкуторно; чёткая пальпация становится возможной лишь на 5–6 день. При УЗИ органов брюшной полости увеличение размеров печени и селезёнки определяют уже на 2–3 день после того, как возникли клинические проявления тропической малярии. Нарушения пигментного обмена наблюдают только у больных с тяжёлым и реже среднетяжёлым течением тропической малярии. Более чем трёхкратное повышение активности аминотрансфераз в сыворотке расценивают как показатель неблагоприятного прогноза. К метаболическим нарушениям при тропической малярии относят изменения в системе гемостаза и гипогликемию. Нарушения со стороны сердечно-сосудистой системы имеют функциональный характер, выражаются тахикардией, приглушённостью сердечных тонов, гипотонией. Изредка выслушивают преходящий систолический шум на верхушке сердца. При тяжёлой форме болезни отмечают изменения на ЭКГ в виде деформации конечной части желудочкового комплекса: уплощение и обратную конфигурацию зубца Т, снижение сегмента ST. Одновременно снижается вольтаж зубцов R в стандартных отведениях. У больных с церебральной формой изменения зубца Р имеют тип Р-pulmonale. При тропической малярии часто наблюдают нарушения со стороны ЦНС, связанные с высокой лихорадкой и интоксикацией: головную боль, рвоту, менингизм, судороги, сонливость, иногда делириоподобный синдром, но сознание больного сохранено. Характерные признаки среднетяжёлой и тяжёлой малярийной инфекции — гемолитическая анемия и лейкопения, в лейкоцитарной формуле отмечают эозино- и нейтропению, относительный лимфоцитоз. При тяжёлых формах болезни возможен нейтрофильный лейкоцитоз; СОЭ постоянно и значительно повышена. Тромбоцитопения — признак, типичный для всех видов малярии. Как и при других инфекционных болезнях, у больных наблюдают преходящую протеинурию. Рецидивирующее течение тропической малярии обусловлено либо неполноценным этиотропным лечением, либо наличием резистентности P. falciparum к используемым химиопрепаратам. Естественное течение тропической малярии с благоприятным исходом продолжается не более 2 нед. При отсутствии этиотропной терапии через 7–10 дней возникают рецидивы. Беременность — общепризнанный фактор риска при тропической малярии. Это связано с более высокой заболеваемостью беременных, со склонностью к тяжёлым клиническим формам, с риском для здоровья и жизни ребёнка, с ограниченным терапевтическим арсеналом. Тропическую малярию у детей первых пяти лет следует считать потенциально смертельной болезнью. У детей младших возрастных групп (до 3–4 лет), особенно у детей грудного возраста, малярия отличается своеобразной клинической картиной: в ней отсутствует самый яркий клинический симптом — малярийный пароксизм. В то же время наблюдают такие симптомы, как судороги, рвота, понос, боли в животе, с быстро прогрессирующим ухудшением состояния ребёнка. Появление судорог и других мозговых симптомов не обязательно означает развитие церебральной малярии — это нередко один из симптомов нейротоксикоза. Паразитемия у детей младшего возраста обычно высокая: P. falciparum способны поражать до 20% эритроцитов. Болезнь может быстро приобрести злокачественное течение и закончиться смертью ребёнка.
Осложнения. Тяжёлые поражения ЦНС при тропической малярии объединены под названием «церебральная малярия», её основной признак — развитие коматозного состояния. Малярийная кома бывает осложнением первичной, повторной и рецидивирующей малярии, но чаще её наблюдают при первичной малярии, преимущественно у детей, беременных и у лиц молодого и среднего возраста. Частое осложнение всех форм малярийной инфекции — гипохромная анемия. Серьёзное проявление малярии — развитие ДВС-синдрома. Гемоглобинурийная лихорадка — следствие массивного внутрисосудистого гемолиза как при интенсивной инвазии, так и в результате применения некоторых противомалярийных препаратов (хинина, примахина, сульфаниламидов) у лиц с дефицитом фермента глюкозо-6-фосфатдегидрогеназы. Малярийный алгид. Отек легких. Разрыв селезенки. При тропической малярии возможны поражения роговой оболочки глаза, ирит, иридоциклит, помутнение стекловидного тела, неврит зрительного нерва, хориоретинит и кровоизлияния в сетчатку, есть сообщения о параличе глазных мышц, вызванном поражением III, IV и VI пар черепных нервов, о параличе аккомодации.
Диагностика. Диагноз основывается на эпидемиологических данных (пребывание в очаге малярии, отсутствие или недостаточность химиопрофилактики), на клинической картине болезни (характерные приступы) и подтверждается лабораторными исследованиями. Основной метод лабораторной диагностики малярии — микроскопическое исследование препаратов крови (методы толстой капли и тонкого мазка), окрашенных по Романовскому–Гимзе. В последние годы в эндемичных очагах для быстрого получения предварительного ответа используют экспресс-тесты (иммунохроматографические методы), основанные на обнаружении специфического белка НRP-2а и фермента pLDH Р. Falciparum. В современных условиях, особенно при массовых исследованиях, особое значение приобретает метод ПЦР, основанный на детекции ДНК малярийного паразита.
Лечение. При тропической малярии назначают хингамин (делагил, хлорохин): в 1-й день 1 г и через 6 ч еще 0,5 г препарата, затем в течение 4 дней по 0,5 г/сут. При лечении трех- и четырехдневной малярии вначале проводят трехдневный курс лечения хингамином: в 1-й день дают по 0,5 г 2 раза в сутки, на 2-й и 3-й день — по 0,5 г в один прием. Этот курс купирует приступы малярии, но не действует на тканевые формы паразита. Для радикального лечения сразу же после окончания приема хингамина проводят 10- дневный курс лечения примахином (по 0,027 r/сут) или хиноцидом (по 0,03 r/сут). Для лечения тропической малярии, вызванной лекарственно-устойчивыми плазмодиями, можно использовать хинина сульфат по 0,65 г 3 раза в сутки в течение 10 дней в сочетании с сульфапиридазином: в 1-й дань 1 г, в последующие 4 дня по 0,5 г. Эффективно сочетание хингамина (в 1 -и день 0,5 г 2 раза в сутки, в последующие 3—4 дня по 0,5 r/сут) с сульфапиридазином (1-й день 1 г, последующие 4 дня по 0,5 г/сут). Используют и другие препараты. Лечение малярийной комы лучше начинать с в/в капельного (60 капель в 1 мин) введения хинина дигидрохлорида в дозе 0,65 г в 250—500 мл изотонического раствора хлорида натрия. Вливание можно повторить через 8 ч. Суточная доза не должна превышать 2 г. Используют также 5% раствор делагила (выпускается в ампулах по 5 мл) по 10 мл через 6—8 ч, но не более 30 мл/сут. При тяжелых формах проводят и патогенетическое лечение. Назначают глюкокортикоиды (преднизолон по 30 мг 3 раза в сутки), антигистаминные препараты, инфузионную терапию и др.
Профилактика. Уничтожение комаров-переносчиков; предохранение людей от укусов комаров (использование репеллентов, сеток). Лицам, выезжающим в эндемичные по малярии местности, проводят химиопрофилактику (хингамин по 0,25 г 2 раза и неделю). Препарат назначают за 3 дня до прибытия в очаг и продолжают прием в течение 4—6 нед после выезда. За переболевшими малярией осуществляют диспансерное наблюдение в соответствии с инструкциями.
50. Герпетическая инфекция 1,2 типа, этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Гепетическая инфекция (простой герпес, herpes simplex) — широко распространённая антропонозная вирусная болезнь c преимущественно контактным механизмом передачи возбудителя, характеризуемая поражением наружных покровов, нервной системы и хроническим рецидивирующим течением.
Этиология. Возбудитель — ВПГ типа 1 и 2 (вирус герпеса человека типа 1 и 2). Геном ВПГ представлен двуспиральной линейной ДНК. Репликация вируса и сборка нуклеокапсидов происходят в ядре инфицированной клетки. Вирус обладает выраженным цитопатическим действием, вызывая гибель поражённых клеток, однако проникновение ВПГ в некоторые клетки (в частности, нейроны) не сопровождается репликацией вируса и гибелью клетки. Клетка оказывает на вирусный геном угнетающее влияние, приводя его в латентное состояние, когда существование вируса совместимо с её нормальной активностью. Через какое-то время может произойти активация вирусного генома с последующей репликацией вируса, в некоторых случаях вновь могут появляться герпетические высыпания, что свидетельствует о реактивации и переходе латентной формы инфекции в манифестную. Геномы ВПГ-1 и ВПГ-2 на 50% гомологичны. Оба вируса могут вызывать поражения кожи, внутренних органов, нервной системы, гениталий. Однако ВПГ-2 вызывает поражения гениталий значительно чаще. Есть данные, свидетельствующие о возможности мутации ВПГ с приобретением новых антигенных свойств. ВПГ устойчив к высушиванию, замораживанию, при температуре 50–52 °С инактивируется в течение 30 мин. Липопротеидная оболочка вируса растворяется под действием спиртов и кислот. Обычные дезинфицирующие средства существенного влияния на ВПГ не оказывают. Ультрафиолетовое облучение быстро инактивирует вирус.
Эпидемиология. Герпетическая инфекция распространена повсеместно. Антитела к ВПГ обнаруживают более чем у 90% населения в возрасте старше 40 лет. Эпидемиология герпетической инфекции, вызванной вирусами ВПГ-1 и ВПГ-2, различна. Первичное инфицирование ВПГ-1 происходит в первые годы жизни (от 6 мес до 3 лет), чаще всего проявляется везикулёзным стоматитом. Антитела к ВПГ-2 обнаруживают, как правило, у лиц, достигших половой зрелости. Наличие антител и их титр коррелируют с половой активностью. У 30% лиц, имеющих антитела к ВПГ-2, в анамнезе есть указания на перенесённую или текущую инфекцию половых органов, сопровождаемую высыпаниями. Источник ВПГ-1 — человек в период реактивации герпетической инфекции с выделением вируса в окружающую среду. Бессимптомное выделение со слюной ВПГ-1 отмечено у 2–9% взрослых и у 5–8% детей. Источник ВПГ-2 — больные генитальным герпесом и здоровые лица, в секрете слизистой оболочки половых органов которых содержится ВПГ-2. Различны и механизмы передачи ВПГ-1 и ВПГ-2. Ряд авторов относят ВПГ-1 к инфекции с аэрозольным механизмом передачи возбудителя. Однако, хотя инфицирование ВПГ-1 происходит в детском возрасте, в отличие от других детских капельных инфекций для инфекции ВПГ-1 очаговость (например, в детских учреждениях) и сезонность не характерны. Основные субстраты вируса — слюна, секрет слизистой оболочки ротоглотки, содержимое герпетических пузырьков, то есть передача вируса происходит путём прямого или непрямого (игрушки, посуда, другие ослюнённые предметы) контакта. Поражение респираторного тракта, наличие катаральных явлений, обеспечивающих воздушно-капельный путь передачи возбудителя, мало значимы. Основной механизм передачи ВПГ-2 — также контактный, но реализуется он преимущественно половым путём. Поскольку и передача ВПГ-1 также возможна половым путём (орально-генитальные контакты), герпетическую инфекцию относят к заболеваниям, передающимся половым путём. ВПГ можно обнаружить в слюне и половых путях у клинически здоровых лиц. Однако при наличии активных проявлений инфекции частота выделения вируса возрастает в несколько раз, а титр вируса в поражённых тканях — в 10–1000 раз и более. Возможна трансплацентарная передача вируса при наличии у беременной рецидива герпетической инфекции, сопровождаемого вирусемией. Однако чаще инфицирование плода происходит при прохождении через родовые пути. Передача вируса возможна при гемотрансфузии и трансплантации органов. Восприимчивость высокая. В результате перенесённой герпетической инфекции формируется нестерильный иммунитет, который в силу многообразных эндо- и экзогенных причин может нарушаться.
Патогенез. Вирус проникает в организм человека через слизистые оболочки, повреждённую кожу (в клетках ороговевающего эпителия кожи рецепторы к вирусу отсутствуют). Размножение вируса в эпителиальных клетках приводит к их гибели с образованием очагов некроза и везикул. Из первичного очага ВПГ путём ретроградного аксонального транспорта мигрирует в сенсорные ганглии: ВПГ-1 преимущественно в ганглий тройничного нерва, ВПГ-2 — в поясничные ганглии. В клетках сенсорных ганглиев репликация вируса подавляется, и он персистирует в них пожизненно. Первичная инфекция сопровождается формированием гуморального иммунитета, напряжённость которого поддерживается периодической активацией вируса и проникновением его в слизистые оболочки ротоглотки (ВПГ-1) и половых органов (ВПГ-2). В некоторых случаях реактивация вируса сопровождается клиническими проявлениями в виде пузырьковых высыпаний (рецидив герпетической инфекции). Возможно и гематогенное распространение вируса, о чём свидетельствует появление генерализованных высыпаний, поражение ЦНС и внутренних органов, а также обнаружение вируса в крови методом ПЦР. Рецидивы герпетической инфекции связывают со снижением уровня специфического иммунитета под воздействием неспецифических факторов (избыточная инсоляция, переохлаждение, инфекционные болезни, стрессы). Как правило, от одного больного выделяют один штамм ВПГ, но у больных с иммунодефицитом можно выделить несколько штаммов одного и того же подтипа вируса. Иммунный статус организма во многом определяет вероятность развития заболевания, тяжесть течения, риск развития латентной инфекции и персистенции вируса, частоту последующих рецидивов. Имеет значение состояние как гуморального, так и клеточного иммунитета. Заболевание у лиц с нарушениями клеточного иммунитета протекает значительно тяжелее. Герпетическая инфекция может вызывать иммунодефицитные состояния. Доказательством этого служит способность вируса размножаться в T- и B-лимфоцитах, что приводит к снижению их функциональной активности.
Клиника. Оролабиальный герпес. Первичная инфекция чаще наблюдается у детей и сопровождается выраженным гингивостоматитом (везикулезные высыпания появляются на губах и слизистой оболочке рта, болезненны, расположены на инфильтрированном основании, заполнены прозрачной жидкостью, которая со временем мутнеет, быстро эрозируются (на 3-4 день), эрозии покрываются желтыми корочками), распространением высыпаний на прилегающую кожу, общей интоксикацией и шейной лимфоаденопатией, длится около 2-3 нед. Вторичная инфекция характеризуется более легким течением (высыпания единичные, односторонние), отсутствием системных реакций и более быстрым выздоровлением (в течение 5-7 дней). Герпетический кератоконъюнктивит. Чаще односторонний; характеризуется фолликулярным конъюнктивитом с выраженным отеком конъюнктивы и склер, отделяемое при отсутствии вторичной инфекции серозное; на веках возможны пузырьковые высыпания. Присоединение кератита сопровождается образованием роговичных язв, после заживления которых возможны стойкие помутнения. Герпетический энцефалит. HSV1-инфекция является наиболее частой причиной спорадических вирусных энцефалитов. Начинается остро. Сопровождается лихорадкой, симптомокомплексом энцефалита чаще с нарушением поведенческих реакций (эксцентрическое поведение). Спинномозговая жидкость может быть розовой (вследствие геморрагического некроза ткани мозга), в жидкости появляются эритроциты, наблюдаются лимфоцитарный плеоцитоз до 1000 в мм3 , незначительное увеличение концентрации белка, уровень глюкозы, как правило, несколько повышен или нормальный. Поставить в первые часы госпитализации диагноз герпетического энцефалита с абсолютной достоверностью можно только на основании биопсии мозга с последующей постановкой реакции иммунофлюоресценции. В спинномозговой жидкости вирус обнаружить обычно не возможно. Однако в пользу диагноза герпетического энцефалита указывает обнаруживаемая при компьютерной томографии специфическая локализация процесса: поражаются теменные доли. Генитальный герпес. Первичная инфекция встречается чаще у молодых людей, передается половым путем. Сопровождается распространенными болезненными зудящими пузырьками с последующим их изъязвлением на половых органах и промежности, регионарной лимфоаденопатией, лихорадкой; у женщин наблюдаются болезненное мочеиспускание и патологические выделения из влагалища. Вторичная инфекция сопровождается единичными эрозиями без индурации, лихорадки и системных проявлений.
Осложнения. Осложнения обычно обусловлены присоединением вторичной микрофлоры.
Диагностика. иагноз при поражении кожи и слизистых оболочек устанавливают на основании клинических данных (характерная герпетическая сыпь). При поражении ЦНС, висцеральных и генерализованных формах необходима лабораторная диагностика. Диагноз герпетической инфекции подтверждают выделением вируса или серологически. Материалом для выделения ВПГ от больного служит содержимое герпетических пузырьков, слюна, кровь, СМЖ. У умерших для исследования берут кусочки мозга, внутренних органов. Для серологической диагностики используют РПГА, ИФА и другие методы, выявляющие специфические антитела. Поражение ЦНС диагностируют с помощью ПЦР. Для исследования используют СМЖ. Кроме того, определяют уровень антител в СМЖ и сыворотке крови (не ранее 10-го дня болезни). На высоком уровне антитела сохраняются в течение 1,5–2 мес и более. Для обнаружения специфического антигена в СМЖ применяют РИФ. Важное значение имеет обнаружение при МРТ характерных очагов в височных долях головного мозга.
Лечение. Ацикловир (Виролекс, Зовиракс, Лизавир) показан при первичной инфекции, при вторичной инфекции у лиц с риском развития герпетической экземы, энцефалита и др. осложнений, а также у больных с иммунодефицитом. Препарат при тяжелом течении вводят в/в по 5-10 мг/кг массы тела через каждые 8 часов; при оральном введении назначают по 0,2 г 5 раз в сутки в течение 5-10 дней. При нетяжелом течение можно ограничится мазью, содержащей ацикловир, которой смазывают высыпные элементы 5 раз в день в течение 5 дней. Генитальный герпесе можно также лечить фамцикловиром по 0,25 г 3 раза в день в течение 7 дней
Профилактика. Направлена на предупреждение рецидивов герпетической инфекции путём комплексного применения противовирусных препаратов, противогерпетической вакцины и иммуномодуляторов.








