Патогенетическая и симптоматическая терапия.
17. Иерсиниозы: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Иерсиниоз
Иерсиниоз (кишечный иерсиниоз) — острое инфекционное заболевание, зоофильный сапроноз с фекально-оральным механизмом передачи возбудителя (путь: алиментарный). Характеризуется развитием интоксикационного синдрома, преимущественным поражением ЖКТ, при генерализованной форме — полиорганным поражением. Имеет склонность к обострениям, рецидивам и хронизации. Больной человек опасности для окружающих не представляет.
Этиология. Возбудитель (Yersinia enterocolica) - грамотрицательная палочка семейства Enterobacteriaceae, анаэроб, хорошо растет на обычных питательных средах при низких температурах. Известно 30 сероваров. Заболевание у человека чаще вызывают 3-й, 5-й, 8-й и 9-й серовары. Растёт на «голодных» средах и на средах с обеднённым составом. Сохраняет жизнеспособность в широком температурном диапазоне: от 40 до –30 °С. Оптимальная температура для роста: 22–28 °С. Активно размножается в условиях бытового холодильника и овощехранилищ (от 4 до –4 °С). Метаболизм окислительный и бродильный. Имеют Н- и О-антигены. Некоторые штаммы содержат V- и W-антигены вирулентности, расположенные в наружной мембране. В развитии заболевания ведущую роль отводят факторам патогенности Y. enterocolitica: адгезии, колонизации на поверхности кишечного эпителия, энтеротоксигенности, инвазивности и цитотоксичности. Большинство штаммов не инвазивны. Не все инвазивные штаммы способны к внутриклеточному размножению. Белки наружной мембраны обеспечивают проникновение возбудителя через слизистую оболочку кишки неинвазивным путём. Адгезин бактерий, связывающийся с коллагеном,может способствовать развитию артрита у пациентов. IgА-гены — «острова высокой патогенности» иерсиний — контролируют синтез сериновой протеазы, разрушающей секреторный IgA слизистых оболочек. Пастеризация и кратковременное воздействие температуры до 80 °С не всегда приводят к гибели Y. enterocolitica.
Эпидемиология. Естественный резервуар для иерсиний — почва. Животным и птицам отводят роль вторичного резервуара и источника инфекции. Основные из них — грызуны, сельскохозяйственные животные (например, свиньи, рогатый скот, кролики), птицы и домашние животные (кошки, собаки). Основной механизм передачи заболевания — фекально-оральный. Человек инфицируется при употреблении воды и продуктов, контаминированных иерсиниями (овощи, молоко, молочные продукты). На территориях с жарким климатом около 80% всех вспышек связано с питьём заражённой воды. Описаны случаи иерсиниоза после переливания инфицированной крови. Восприимчивость высокая. К группам риска относят лиц, работающих в животноводстве, птицеводстве и на пищеблоках. Подъём начинается в марте и продолжается 4–5 мес, резко снижаясь к августу и повторно возрастая в конце года.
Патогенез. Характер взаимодействия иерсиний с макроорганизмом зависит от иммунологической реактивности второго, набора факторов патогенности штамма, дозы инфекта и пути введения. Основная масса бактерий преодолевает защитный барьер желудка. Развивается катарально-эрозивный, реже катарально-язвенный гастродуоденит. Затем развитие патологического процесса может пойти в двух направлениях: либо возникнут воспалительные изменения только в кишечнике, либо разовьётся генерализованный процесс с лимфо- и гематогенной диссеминацией возбудителя. Для иерсиниоза, вызванного слабоинвазивными штаммами Y. enterocolitica с выраженной энтеротоксигенностью, характерен, как правило, локализованный процесс, клинически проявляющийся интоксикацией и поражением ЖКТ (катарально-десквамативный, катарально-язвенный энтерит и энтероколит). Проникновение иерсиний в мезентериальные узлы вызывает развитие абдоминальной формы с мезентериальным лимфаденитом, терминальным илеитом или острым аппендицитом. Гастроинтестинальная и абдоминальная формы заболевания могут быть или самостоятельными, или одной из фаз генерализованного процесса. Инфекция распространяется инвазивным и неинвазивным путём. При первом способе иерсинии проникают через эпителий кишки, и тогда развивается циклическое заболевание с гастроинтестинальной, абдоминальной и генерализованной фазами болезни. Второй путь, осуществляемый через слизистую оболочку кишки внутри фагоцита, возможен, если заражение вызвано цитотоксическим и инвазивным штаммом. Зачастую он приводит к быстрой диссеминации возбудителя. В период реконвалесценции организм освобождается от иерсиний и восстанавливаются нарушенные функции органов и систем. При адекватном иммунном ответе заболевание заканчивается выздоровлением. Механизмы формирования затяжного течения и вторично-очаговых форм иерсиниоза недостаточно изучены. Ведущую роль отводят формирующимся уже в остром периоде болезни иммунопатологическим реакциям, длительной персистенции Y. enterocolitica и наследственным факторам. В течение 5 лет после острого иерсиниоза у части больных формируются системные заболевания (аутоиммунный тиреоидит, болезнь Крона, синдром Рейтера, ревматоидный артрит и др.).
Клиника. Инкубационный период от 15ч до 4 сут (чаще 1—2 дня). Основными клиническими формами являются: 1) гастроэнтероколитическая, 2) аппендикулярная, 3) септическая, 4) субклиническая. Заболевание начинается остро. Температура тела повышается до 38—40 °С. Лихорадка длится до 5 дней, при септических формах—дольше. Наблюдаются симптомы общей интоксикации (озноб, головная боль; боль в мышцах, суставах). При гастроэнтероколитической форме на этом фоне появляется схваткообразная боль в животе, чаще в нижних отделах справа или в пупочной области. Могут быть тошнота и рвота, стул жидкий зловонный, до 10 раз в сутки. Может быть примесь слизи, крови обычно не бывает. В отличие от дизентерии нет также тенезмов, ложных позывов, спазма и болезненности ситовидной кишки. При аппендикулярной форме, кроме того, появляются симптомы аппендицита (иногда гнойного). Лейкоцитоз до 15-109/л; СОЭ повышена. Септическая форма развивается у ослабленных лиц, протекает с лихорадкой неправильного типа, отмечаются повторные ознобы, профузный пот, увеличение печени и селезенки, нарастает анемизация, появляется желтуха. Эта форма заканчивается летально.
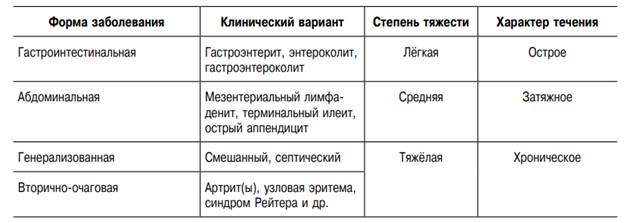
Гастроинтестинальная форма (гастроэнтерит, энтероколит, гастроэнтероколит) встречается наиболее часто. У большинства больных развивается гастроэнтеритический вариант иерсиниоза. Заболевание начинается остро, с симптомов поражения ЖКТ и симптомов интоксикации. Больных беспокоят боли в животе различной интенсивности, постоянного или схваткообразного характера, локализующиеся в эпигастрии, вокруг пупка, реже в правой подвздошной области. Стул учащён, иногда с примесью слизи и крови. У части больных наблюдают катаральные и дизурические симптомы, экзантему. Характерны симптомы «перчаток» и «носков». На 2–6-е сутки болезни преимущественно на кистях, ладонях, стопах, груди и бёдрах обнаруживают точечную, пятнисто-папулёзную или уртикарную сыпь, после которой появляется шелушение. Отмечают гиперемию или бледность кожи лица, склерит, гиперемию конъюнктив и слизистой оболочки полости рта, полиаденопатию. Язык на 5–6-й день становится «малиновым». При пальпации живота — локальная болезненность в правой подвздошной области, увеличение печени, реже — селезёнки. Температура нормализуется на 4–5-й день. Типичных изменений гемограммы нет. Заболевание чаще протекает в среднетяжёлой форме. Иногда единственный клинический симптом болезни — диарея. Выздоровление наступает в большинстве случаев через 1–2 нед. Возможны волнообразное течение, рецидивы и обострения.
Иерсиниоз необходимо дифференцировать от гастроэнтероколитов другой этиологии (дизентерия, сальмонелпезы, эшерихиозы), псевдотуберкулеза, аппендицита.
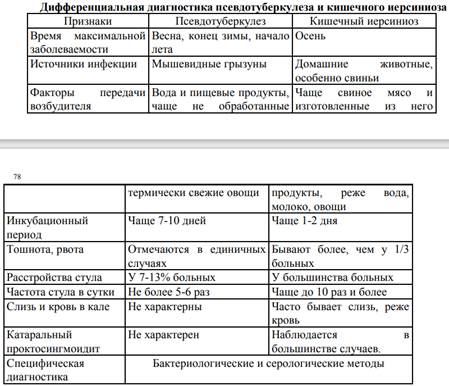
Диагностика. Сложна при любой форме и основывается на характерной клинической картине и лабораторной диагностике. В гемограмме при генерализованной форме обнаруживают лейкоцитоз, палочкоядерный сдвиг, эозинофилию (до 7%), лимфопению и увеличение СОЭ; в биохимическом анализе крови увеличение активности ферментов, реже — гипербилирубинемию. Специфическая лабораторная диагностика включает бактериологические, иммунологические и серологические методы. Основной метод — бактериологический. Иммунологические методы позволяют обнаружить антигены Y. enterocolitica в клиническом материале до 10-го дня от начала болезни (ИФА, РКА, РИФ, РНИФ, РАЛ, ПЦР, иммуноблоттинг). Серологические методы используют, чтобы определить специфические антитела к антигенам Y. enterocolitica (ИФА, РА, РСК, РПГА). Для диагностики и выбора тактики ведения больных рекомендуют следующие инструментальные методы: рентгенографию грудной клетки, поражённых суставов и сакроилеальных сочленений, ЭКГ, ЭхоКГ, УЗИ брюшной полости, ректороманоскопию, колоноскопию, КТ, диагностическую лапароскопию и сонографию.
Лечение. Из этиотропных средств применяют один из антибиотиков. Препараты выбора — фторхинолоны и цефалоспорины III поколения. Курс лечения зависит от формы и тяжести болезни; при легком течении — 5-7 дней, при среднетяжелом и тяжелом — до 14 дней. Прогноз в большинстве случаев благоприятный, за исключением септической формы.
Профилактика. Проводится так же, как при острых кишечных инфекциях и псевдотуберкулезе. Специфическая профилактика иерсиниоза не разработана.
18. Листериоз: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Листериоз - инфекционная болезнь из группы сапрозоонозов. У человека заболевание протекает либо в виде острого сепсиса (с поражением центральной нервной системы, миндалин, лимфатических узлов, печени, селезенки), либо в хронической форме (стертая). Характеризуюется множеством источников возбудителя инфекции, разнообразием путей и факторов его передачи, полиморфизмом клинических проявлений, высокой летальностью.
Этиология Возбудитель листериоза человека — вид Listeria monocytogenes рода Listeria— грамположительные неспорообразующие палочки правильной формы. Листерии — факультативные анаэробы. Они кислотонеустойчивы, неприхотливы, спор и капсул не образуют, хорошо растут на обычных питательных средах. Различают 16 серологических вариантов в зависимости от комбинации соматических (15) и жгутиковых (4) антигенов. Листерии ферментируют глюкозу. Они каталазоположительны, оксидазоотрицательны, образуют цитохромы, подвижны при 20–25 °С; могут превращаться в L-формы и паразитировать внутриклеточно, что обусловливает недостаточную в ряде случаев эффективность антибактериальной терапии, объясняет склонность листериоза к затяжному и хроническому течению, возможность латентной формы и бактерионосительства. Факторы патогенности — листериолизин О, обладающий гемолитической активностью и определяющий вирулентность микроба; фосфатидилинозитол; интерналин А; интерналин В; белок АctA и др. Листерии высокоустойчивы в окружающей среде, растут в широком интервале температур (от 1 до 45 °С) и рH (от 4 до 10), способны к размножению в почве, воде, на растениях, в органах трупов. В различных пищевых продуктах (молоко, масло, сыр, мясо и др.) размножаются при температуре бытового холодильника. При 70 °С погибают через 20–30 мин, при 100 °С — через 3–5 мин; инактивируются раствором формалина (0,5–1%), хлорамина (3–5%) и другими обычными дезинфицирующими средствами. Листерии чувствительны к пенициллинам, тетрациклинам, аминогликозидам, фторхинолонам 3-го поколения.
Эпидемиология. Сапрозооноз, основной источник и резервуар возбудителя — объекты окружающей среды, прежде всего почва. Листерии выделяются также из растений, силоса, пыли, водоёмов и сточных вод. Источником листерий бывают, кроме того, различные животные (кролики, свиньи, коровы, собаки, кошки, куры, мыши, крысы и др.). Основной путь заражения человека листериозом — пищевой, при употреблении различных продуктов питания (мясных, молочных, корнеплодов), не прошедших термической обработки, особенно если до этого они длительно хранились в холодильнике. Повышенную опасность представляют мягкие сыры, колбасные изделия в вакуумной упаковке, а также продукты быстрого приготовления. Возможен также контактный (от инфицированных животных и грызунов), аэрогенный (в помещениях при обработке шкур, шерсти, а также в больницах), трансмиссивный (при укусах насекомых, в частности клещей), половой путь заражения. Возможен вертикальный путь передачи (трансплацентарный и интранатальный). Несмотря на то что многие пищевые продукты контаминированы листериями и в течение жизни человека многократно происходит инфицирование, заболевают листериозом сравнительно редко: это зависит как от вирулентности листерий, так и от состояния иммунной системы человека. Наиболее восприимчивы люди с ослабленным иммунитетом, прежде всего беременные и новорождённые, а также ВИЧ-инфицированные, онкологические больные, больные сахарным диабетом, хроническим алкоголизмом и т.д. В связи с возможностью заражения от животных в группу риска входят также работники животноводческих ферм, мясокомбинатов, птицефабрик и т.д. После перенесённого листериоза формируется продолжительный иммунитет. Повторные случаи заболевания листериозом не описаны.
Патогенез. Листерии проникают в организм человека через слизистые оболочки ЖКТ, органов дыхания, глаз, половых путей, повреждённую кожу, через плаценту беременной к плоду. В месте входных ворот развивается воспалительный процесс, при этом часто вовлекаются регионарные лимфатические узлы. Резидентные макрофаги или моноциты поглощают бактерии в процессе неспецифического фагоцитоза. Часть листерий при этом погибает, оставшиеся размножаются внутриклеточно. При адекватной иммунной реакции организма дальнейшего продвижения листерий не происходит. В противном случае из входных ворот микробы могут распространяться гематогенным и лимфогенным путём, проникают в ретикулярно-эндотелиальную систему (печень, селезёнку, лимфатические узлы), в ЦНС, почки и т.д., где происходит их дальнейшее размножение с образованием гранулём, состоящих из ретикулярных, моноцитарных клеток, клеточного детрита, изменённых полиморфно-ядерных лейкоцитов; в центре же гранулём возникают скопления листерий (грамположительные аргирофильные короткие палочки, расположенные в виде цепочек или попарно). Прогрессирование процесса вызывает некротические изменения в центре гранулём. В дальнейшем происходят организация некротических очагов, рассасывание некротизированных клеточных элементов с возможным рубцеванием. Специфические гранулёмы чаще всего можно обнаружить в печени. Листерии способны преодолевать ГЭБ, поражать оболочки, вещество головного мозга. При врождённом листериозе гранулематозный процесс носит генерализованный характер, и его трактуют как гранулематозный сепсис. При наружном осмотре новорождённого с листериозом выявляют множественные бело-серые гранулёмы диаметром 1–2 мм, в части случаев сыпь на коже, папулёзную с геморрагическим венчиком или розеолёзную. На вскрытии умерших от листериоза все органы на поверхности или на разрезе словно посыпаны пшеном: бело-серые, серо-жёлтые гранулёмы обнаруживаются под плеврой, в лёгких, под капсулой печени и в её ткани, в почках, под мягкой мозговой оболочкой, в веществе головного мозга, селезёнке, лимфатических узлах, кишечнике, желудке, надпочечниках, тимусе. Микроскопически в коже наблюдают продуктивный васкулит, очажки некроза в дерме с образованием гранулём, гиперемию. В печени выявляют множественные субмилиарные очаги некроза гепатоцитов с выраженной гиперплазией и пролиферацией звездчатых эндотелиоцитов, на месте которых формируются описанные выше гранулёмы.
Клиника. Заболевание может приобретать острое, подострое, хроническое и абортивное течение, обычно склонно к рецидивированию. Выделяют следующие основные клинические формы листериоза: ангинозносептическую, нервную, глазо-железистую, септико-гранулематозную (у плодов и новорождѐнных), смешанную. Известны случаи длительного бессимптомного листериозного носительства. Инкубационный период. Варьирует от нескольких дней до 1,5 мес. Ангинозно-септическая форма. Встречают наиболее часто. Основное клиническое проявление - ангина. Она может быть катаральной или фолликулярной, клинически не отличимой от ангины стрептококковой этиологии. Обычно в таких случаях заболевание протекает благоприятно в течение 5-7 дней и заканчивается полным выздоровлением. При язвенно-плѐнчатой листериозной ангине температура тела повышается до 38,5-39 "С, возможны кашель и насморк, характерны боли в горле. У больных отмечают яркую гиперемию слизистой оболочки ротоглотки, увеличение и разрыхлѐнность миндалин, образование на них плѐнчатых налѐтов или язв, покрытых плѐнками. Регионарные лимфатические узлы увеличены, болезненны при пальпации. Для язвенно-плѐнчатой ангины характерны изменения гемограммы - лейкоцитоз, увеличение СОЭ и особенно повышение количества мононуклеаров (до 70% и более). Длительность заболевания в случаях его благоприятного течения составляет 12-14 дней. месте с тем язвенно-плѐнчатая и значительно реже фолликулярная листериозная ангины при прогрессировании процесса могут приводить к развитию сепсиса, что наблюдают преимущественно у взрослых. Высокая лихорадка принимает ремиттирующий характер, отмечают гиперемию лица, конъюнктивит, полиморфную сыпь на коже, белый налѐт на миндалинах. Развивается гепатолиенальный синдром, в некоторых случаях появляются слабо выраженные менингеальные симптомы. В крови сохраняется выраженный моноцитоз. Исход листериозного сепсиса при своевременном и полноценном лечении благоприятный. Гастроэнтеритическая форма характеризуется острейшим началом, быстрым повышением температуры тела до высоких цифр, выраженной интоксикацией (озноб, головная боль, артралгия и миалгия). Через несколько часов присоединяются тошнота, повторная необильная рвота, схваткообразные боли в животе, учащается стул. Каловые массы жидкие, иногда с примесью слизи и/или крови. Характерны вздутие живота, болезненность при его пальпации, особенно выраженная в правой подвздошной области. Продолжительность лихорадки 5–7 дней и более. Значительного обезвоживания обычно не бывает, доминируют симптомы интоксикации. Свойственная этой форме высокая летальность (20% и выше) обусловлена развитием ИТШ или переходом в более тяжёлые, нервную, септическую формы. Нервная форма (одна из наиболее распространенных). Проявляется в виде листериозного менингита, менингоэнцефалита или абсцесса мозга. Клиническая характеристика этих состояний не имеет существенных отличий от соответствующих нозологических форм иной бактериальной этиологии. Моноцитоз в периферической крови отмечают при нервной форме заболевания лишь в его ранний период, в дальнейшем обнаруживают лейкоцитоз и гранулоцитоз. Спинномозговая жидкость обычно остаѐтся прозрачной, ликворное давление и содержание белка повышены, цитоз имеет смешанный характер, показатели глюкозы и хлоридов изменяются незначительно. Можно наблюдать поражения периферической нервной системы - парезы и параличи отдельных групп мышц, полирадикулоневрит. При иммунодефицитных состояниях, включая ВИЧ-инфекцию, нервная форма листериоза проявляется как оппортунистическая инфекция. Одна из примечательных особенностей листериозного менингита — тяжёлые осложнения: гидроцефалия, ромбэнцефалит, энцефалополиневрит, деменция и др. Кроме головного, возможно поражение спинного мозга в виде интрамедуллярных абсцессов, кист, арахноидита, миелита и др. Глазо-железистая форма. Наблюдают редко; обычно она является следствием контакта с инфицированными животными. У больных отмечают повышение температуры тела, снижение остроты зрения. Развиваются конъюнктивит с отѐком конъюнктивы и многочисленными фолликулами на ней, отѐк век, сужение глазной щели, увеличение и небольшая болезненность околоушных и шейных лимфатических узлов. Роговица остаѐтся неизменѐнной. Заболевание протекает длительно, от 1 до 3 мес. Септико-гранулематозная форма. Наблюдают у плодов и новорождѐнных. При беременности листериоз может протекать в стѐртых и атипичных формах или в виде бессимптомного носительства и в таких случаях остаѐтся нераспознанным. При внутриутробном заражении плода в ранние сроки беременности возможна его гибель или тяжѐлые аномалии развития (гидроцефалия, микрогирия и др.). Листериоз новорождѐнных отличает тяжѐлое течение. Проявляется высокой лихорадкой, расстройствами дыхания и кровообращения: диспноэ, цианозом, глухостью тонов сердца. Возможны рвота, слизистый стул, экзантема розеолѐзно-папулѐзного характера. При развитии гнойного менингита чаще всего наблюдают летальный исход. Клинически листериоз новорождѐнных распознают редко ввиду его сходства с другими внутриутробными инфекциями. У грудных детей листериоз начинается как ОРВИ с повышения температуры тела, насморка, кашля, затем развивается мелкоочаговая бронхопневмония или гнойный плеврит. У части больных отмечают экзантему макуло-папулѐзного характера, увеличение печени, желтуху, менингеальные симптомы, иногда судороги, параличи. Характерный моноцитоз в гемограмме встречают редко. При выздоровлении после этой формы листериоза у 15-20% детей остаются расстройства со стороны периферической нервной системы и ЦНС. Хронический листериоз. Отличается скудностью клинических проявлений при обострениях заболевания: наблюдают кратковременную лихорадку с катаральными явлениями, довольно часто диспептические расстройства или иногда симптоматику хронического пиелонефрита. Септическая форма характеризуется повторными приступами озноба, лихорадкой с большими колебаниями температуры тела, интоксикацией, гепатосплномегалией. Возможно появление крупнопятнистой сыпи, преимущественно вокруг крупных суставов; на лице сыпь может иметь вид «бабочки». Часто возникает гепатит с желтухой, возможны полисерозит, пневмония. В гемограмме — анемия, тромбоцитопения. Развитие септической формы иногда бывает постепенным или подострым, первые признаки болезни в этих случаях — либо катаральные (першение или боль в горле, резь в глазах), либо диспепсические симптомы. Септическую форму листериоза чаще встречают у новорождённых, лиц с выраженным иммунодефицитом, у пациентов с циррозом печени, хроническим алкоголизмом. Летальность достигает 60%. Причиной смерти может быть ИТШ, массивное кровотечение вследствие развития ДВС-синдрома, острая дыхательная недостаточность (ОДН) и ОПН. При всех вышеописанных формах листериоза в крови отмечают лейкоцитоз (вплоть до гиперлейкоцитоза), палочкоядерный сдвиг влево, в некоторых случаях — моноцитоз. Описаны также редкие формы листериоза: эндокардит, дерматит, артрит, остеомиелит, абсцессы разных органов, паротит, уретрит, простатит и др.
Лабораторная диагностика. Нередко при листериозе, особенно при его ангинозно-септической форме, обращают внимание на большое количество (до 60-70%) моноцитов в периферической крови. В зависимости от формы заболевания проводят бактериологическое исследование крови, цереброспинальной жидкости, слизи из носоглотки и зева, отделяемого конъюнктивы, пунктатов лимфатических узлов, околоплодных вод, плаценты и т.д., а также разнообразного биологического материала, взятого от трупов погибших. Посевы рекомендовано делать в первые 7-10 сут болезни;. Суточные колонии листерий имеют сине-зелѐную окраску. Применяют РА с листериозным диагностикумом, РНГА и РСК с их постановкой в парных сыворотках. Возможны ложноположительные результаты из-за антигенного родства листерий и стафилококков. Возможно применение МФА и биологических проб на белых мышах, кератоконъюнктивальной пробы на кроликах. В качестве методов экспресс-диагностики рекомендуют иммунохимические (РИФ, ИФА), а также ПЦР.
Лечение. Проводится в соответствии с клинической формой листериоза. В этиотропной терапии эффективны тетрациклин по 300 мг 4 раза в сутки, доксициклин по 100 мг/сут (в первые сутки - 200 мг), эритромицин по 30 мг/кг/сут внутрь в 4 приѐма. При менингите и менингоэнцефалите назначают бензилпенициллина натриевую соль по 75-100 тыс. ЕД/кг внутривенно каждые 4 ч. Альтернативные препараты - кларитромицин, ципрофлоксацин. Антибиотики назначают в течение всего лихорадочного периода и с 7-го по 21-й день апирексии в зависимости от тяжести заболевания. Патогенетическую терапию проводят по общепринятым принципам. При глазо-железистой форме местно применяют 20% раствор сульфацила натрия (альбуцида), 1% гидрокортизоновую эмульсию. При генерализации инфекции (нервная, септическая формы), листериозе новорождённых рекомендуют сочетание ампициллина (взрослым 8–12 г/сут; детям 200 мг/кг в сутки) или амоксициллин + клавулановая кислота внутривенно (взрослым по 1,2 г три раза в сутки, детям 30 мг/кг в сутки) с гентамицином (5 мг/кг в сутки) в течение всего лихорадочного периода и ещё 5–7 дней, а в тяжёлых случаях до 2–3 нед с момента нормализации температуры.
Профилактика. Специфической профилактики листериоза у людей не разработано; неспецифическая включает контроль за продуктами питания, предусмотренный соответствующими нормативными документами, и санитарно-просветительную работу среди населения, особенно в группах риска. Следует исключить из рациона беременных продукты пищевой индустрии для быстрого питания, не прошедшие длительной термообработки (например, гамбургеры), а также брынзу, мягкие сыры и сырое молоко. Для профилактики листериоза новорождённых необходимо обследовать женщин с отягощённым акушерско-гинекологическим анамнезом, а также имеющих постоянный контакт с животными. Женщины с выявленным листериозом, клинически манифестным или бессимптомным, подлежат специфической терапии. В акушерских стационарах во избежание внутрибольничной инфекции необходим мониторинг листерий. Также необходимы дератизационные мероприятия, защита водоисточников и предприятий общественного питания от грызунов. В хозяйствах (животноводческих комплексах, фермах, отделениях, стадах), неблагополучных по листериозу, проводят поголовный осмотр животных и отбраковку животных, изоляцию и лечение согласно соответствующим инструктивно-методическим документам. Полученное от больных животных молоко кипятят, кожевенномеховое сырье обеззараживают.
Мероприятия в эпидемическом очаге. Госпитализацию больных проводят по клиническим и эпидемиологическим показаниям. Выписку из стационара осуществляют после клинического выздоровления и прекращения выделения листерий, устанавливаемого на основе бактериологических исследований. Все переболевшие подлежат диспансерному наблюдению в соответствии с инструктивно-методическими документами. Дезинфекцию проводят по той же схеме, что и при брюшном тифе. В очаге усиливают мероприятия по уничтожению грызунов и защите от них жилых и производственных помещений. Разобщение и экстренную профилактику в отношении контактных не проводят.
19. Сыпной тиф: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
ТИФ СЫПНОЙ (сыпной тиф эпидемический, вшивый) — острое риккетсиозное заболевание, характеризующееся лихорадкой, общей интоксикацией, поражением сосудов и нервной системы. Возможны рецидивы заболевания спустя много лет (болезнь Брилла). Относится к трансмиссивным антропонозам, передается вшами.
Этиология. Возбудитель сыпного тифа (риккетсии Провацека) — мелкие внутриклеточные Гр(-) микроорганизмы, обладающие выраженным полиморфизмом (кокки, короткие палочки, переходные формы). Различают типы А, B, C, D. Обладают гемолитической активностью и токсической субстанцией со свойствами как экзо-, так и эндотоксина. Имеется термолабильный антиген ОХ-19, что используется при серологической диагностике (реакция Вейля-Феликса с протейным антигеном ОХ-19). Относительно устойчивы во внешней среде, особенно при низких температурах. Растут только на культуре тканей и в курином эмбрионе.
Эпидемиология. Сыпной тиф — антропонозное заболевание. Источник и резервуар инфекции — человек, больной эпидемическим или рецидивирующим сыпным тифом (болезнь Брилла). Период заразности соответствует продолжительности риккетсиемии и составляет примерно 20–21 день: последние 2–3 дня инкубационного периода, весь лихорадочный период (16–17 дней) и ещё 2–8 дней после нормализации температуры. Основной механизм заражения трансмиссивный. Переносчики риккетсий — вши, преимущественно платяные (Pediculis humanus carporis), значительно реже головные (Pediculis humanus capitis). При отсутствии педикулёза больной не опасен для окружающих. Риккетсии проникают в пищеварительный аппарат вши при кровососании больного, размножаются в эпителиальных клетках и после их разрушения попадают в просвет кишечника и в фекалии вши. Вошь становится заразной через 5–6 дней после кровососания и сохраняет заразность до гибели от риккетсиоза (приблизительно около 2 нед). При каждом кровососании у вши происходит акт дефекации, на кожу попадают испражнения вши, содержащие огромное количество риккетсий. При укусе вошь впрыскивает в кожу ферментные вещества, вызывающие зуд. Человек инфицируется в результате проникновения риккетсии через повреждения кожи (ссадины, расчёсы) вследствие втирания фекалий вшей и частиц кишечной трубки раздавленных заражённых паразитов. Вши чувствительны к температурному режиму и быстро покидают тела умерших и заболевших с высокой температурой тела, переползая на здоровых людей. В казуистических случаях возможно заражение воздушно-пылевым путём при вдыхании высохших фекалий вшей или при попадании этих фекалий на конъюнктиву глаз. Известны случаи инфицирования аэрозольным путём в результате вдыхания заражённых риккетсиями пылевых частиц при встряхивании грязного белья, а также при переливании крови, взятой у доноров в последние дни инкубационного периода. Больной человек не выделяет риккетсии Провачека ни с одним из секретов. После перенесённого заболевания формируется длительный иммунитет, который может быть нестерильным, в связи с чем у некоторых переболевших (до 10%) через 20–40 лет при снижении иммунитета может возникнуть повторный (рецидивный) сыпной тиф — болезнь Брилла. Некоторые эпидемиологические особенности сыпного тифа: • заболеваемость в зимне-весенний период; • отсутствие эндемичных очагов; • влияние социальных факторов: педикулёза, плохих санитарно-гигиенических условий, скученности, массовой миграции, отсутствия централизованного водоснабжения, бань, прачечных; • возникновение эпидемий во время войн и стихийных бедствий; • риск заболевания у людей без определённого места жительств, а также у работников сфер обслуживания: парикмахерских, бань, прачечных, ЛПУ, транспорта и т.д.; • более частое возникновение болезни у мужчин 15–30 лет
Патогенез. Воротами инфекции служат мелкие повреждения кожи (чаще расчёсы). Уже через 5–15 мин риккетсии попадают в кровь, где некоторая часть их гибнет под действием бактерицидных факторов. А основная масса возбудителей проникает в эндотелий сосудов. В цитоплазме этих клеток происходит активное размножение риккетсий, что вызывает набухание, деструкцию и десквамацию эндотелия с развитием риккетсиемии. В крови часть риккетсий погибает, высвобождая эндотоксин, другая часть микроорганизмов внедряется в ещё не повреждённые клетки эндотелия мелких сосудов разных органов. Риккетсии Провацека, проникнув в организм человека, внедряются в клетки эндотелия сосудов (прежде всего капилляров, прекапилляров, мелких артериол), где интенсивно размножаются и попадают в кровь (риккетсемия). В результате распада риккетсий освобождается эндотоксин, обусловливающий специфическую интоксикацию. Риккетсиозный токсин вызывает сосудорасширяющее действие, вызывая диффузный капиллярный стаз. Поражение сосудов проявляется в развитии бородавчатого эндоваскулита, периваскулита, а при полной облитерации сосуда тромбом — деструктивного тромбоваскулита. Вокруг участка повреждения сосудов, в особенности капилляров, прекапилляров, артериол, микроскопически отмечаются скопление полиморфных клеточных элементов и макрофагов — специфические сыпнотифозные гранулемы или узелки Попова— Давыдовского. Больше всего их образуется в головном мозге, коже, надпочечниках, миокарде. Все это приводит к резкому нарушению функционального состояния перечисленных органов. Обратное развитие поражения сосудов начинается только на 20 день болезни и заканчивается к концу 4-й недели. У некоторых лиц риккетсии могут сохраняться и после выздоровления, вызывая через много лет рецидив сыпного тифа (болезнь Брилла). Патоморфология. При размножении риккетсий и гибели клеток эндотелия формируются специфические сыпнотифозные гранулёмы. Патоморфологическая основа сыпного тифа — генерализованный деструктивнопролиферативный эндоваскулит, включающий три компонента: · тромбообразование; · деструкцию сосудов стенки; · клеточную пролиферацию. Вокруг поражённых сосудов во всех органах и тканях, кроме печени, костного мозга и лимфатических узлов, возникает очаговая клеточная пролиферация, скопление полиморфных клеточных элементов и макрофагов с формированием специфических сыпнотифозных гранулём, именуемых узелками Попова– Давыдовского. Больше всего их в коже, надпочечниках, миокарде и, особенно, в сосудах, оболочках и веществе головного мозга. В ЦНС поражения наблюдают преимущественно в сером веществе продолговатого мозга и ядрах черепных нервов. Аналогичную картину отмечают в симпатических ганглиях, в частности шейных (с этим связаны гиперемия и одутловатость лица, гиперемия шеи, инъекция сосудов склер). Значительные повреждения происходят в прекапиллярах кожи и миокарда с проявлением экзантемы и развитием миокардита соответственно. Патологический процесс в надпочечниках обусловливает коллапс сосудов. В тяжёлых случаях возможно более глубокое поражение сосудов с сегментарным или круговым некрозом. В очагах деструкции эндотелия сосудов образуются тромбы, создавая предпосылки для возникновения тромбофлебита, тромбоэмболии. Изменения в органах можно охарактеризовать как сыпнотифозный энцефалит, интерстициальный миокардит, гранулематозный гепатит, интерстициальный нефрит. Интерстициальные инфильтраты обнаруживают также в крупных сосудах, эндокринных железах, селезёнке, костном мозге. Обратное развитие морфологических изменений начинается с 18–20-го дня после начала болезни и завершается к концу 4–5-й недели, а иногда и в более поздние сроки. У погибших отмечают миокардит, кровоизлияния в надпочечниках, увеличение селезёнки, отёк, набухание и кровоизлияния в мозговых оболочках и веществе головного мозга.
Клиника. Инкубационный период длится 12—14 дней. Начало заболевания острое. Появляются головная боль, слабость, общая разбитость, озноб, общая гиперестезия, бессонница, возбуждение, повышается температура тела (до 39—40 °С). Более специфическая симптоматика наблюдается при общем осмотре: одутловатое и гиперемированное лицо, гимеремированные конъюнктивы; симптом Киари (петехии на переходной складке конъюнктивы); энантема Розенберга (отдельные мелкие (до 0,1-0,5 мм) красные пятна на мягком небе); симптом Говорова-Годелье (язык при высовывании дрожит и как будто “цепляется” за нижние зубы); кожа горячая, сухая; слизистая оболочка ротоглотки гиперемирована; язык сухой, покрытый белым или бурым налетом. На 4—5-й день появляется сыпнотифозная экзантема. Сыпь обильная, полиморфная, состоит из розеол, первичных и вторичных петехий, исчезает спустя 6—7 дней. Отмечаются тахикардия, гипотензия, учащение дыхания. К 4—5-му дню увеличиваются печень и селезенка. При тяжелых формах может развиться сыпнотифозный энцефалит. Температура тела без антибиотикотерапии снижается укороченным лизисом к 8—12-му дню болезни, при назначении антибиотиков (тетрациклины, левомицетин) — нормализуется через 1—2 дня от начала лечения. Осложнения: пневмония, тромбозы вен, отиты и др. Для диагностики преобладающей сейчас болезни Брилла большое значение имеет указание на перенесенный в прошлом сыпной тиф. Для подтверждения диагноза используется РСК с риккетсиями Провацека и реакция агглютинации риккетсии. Антитела появляются на 2-й неделе болезни.
Осложнения. Выделяют осложнения, связанные с характерным для сыпного тифа поражением сосудов и вызванные вторичной бактериальной инфекцией. К первой группе относят коллапс, тромбоз, тромбоэмболию, тромбофлебит, эндартериит, разрывы сосудов головного мозга, поражение ядер черепно-мозговых нервов, полирадикулоневрит, кишечное кровотечение, миокардит, инфаркт, психозы периода реконвалесценции и более поздние. Вследствие сосудистых повреждений возникают пролежни и гангрена дистальных отделов конечностей. Критические состояния бывают обусловлены инфекционно-токсическим шоком, тромбоэмболией лёгочной артерии. Ко второй группе относят вторичную пневмонию, отит, паротит, абсцессы, фурункулёз, пиелит, пиелоцистит, стоматит, флегмоны подкожной клетчатки.
Лечение.
Режим. Диета. Всех больных с подозрением на сыпной тиф необходимо госпитализировать в инфекционную больницу (отделение). Им назначают строгий постельный режим до 5–6-го дня нормализации температуры тела. Затем больным разрешают садиться, а с 8-го дня они могут ходить по палате, сначала под наблюдением медицинской сестры, а затем самостоятельно. У пациентов необходимо постоянно контролировать АД. Специальную диету не назначают. Пища должна быть щадящей, довольно калорийной и содержащей витамины в суточной потребности. Большое значение имеют туалет ротовой полости (профилактика гнойного паротита и стоматита) и гигиена кожи (профилактика пролежней). Медикаментозная терапия. В соответствии со стандартом лечения больным назначают в качестве препаратов первого ряда антибиотики группы тетрациклинов (тетрациклин, доксициклин) и хлорамфеникол. Антибиотики назначают в обычных терапевтических дозах: доксициклин внутрь по 0,1 г два раза в сутки, со второго дня — один раз в сутки; тетрациклин внутрь в суточной дозе 2 г в четыре приёма (детям 20–30 мг/кг). При непереносимости тетрациклинов можно назначать хлорамфеникол по 0,5 г четыре раза в сутки внутрь. Обычно длительность курса составляет 4–5 сут. Для уменьшения интоксикации больному дают обильное питьё и внутривенно вводят 5% раствор глюкозы, изотонический раствор натрия хлорида, поляризующую смесь и тому подобные препараты, форсируя диурез. Для борьбы с сердечнососудистой недостаточностью назначают сердечные гликозиды, вазопрессоры, а также оксигенотерапию. При возбуждении, делирии проводят седативную терапию [барбитураты, диазепам (седуксен), галоперидол, натрия оксибутират, ремицидин]. При развитии ИТШ показано введение короткими курсами декстрана (реополиглюкин) в сочетании с глюкокортикоидами (преднизолон). Всем больным назначают рутозид (аскорутин), содержащий витамины С и Р, которые обладают сосудоукрепляющим эффектом. Для предупреждения тромбоэмболических осложнений, особенно у пожилых больных, применяют антикоагулянты [в раннем периоде — гепарин натрий (гепарин), позднее — фениндион (фенилин) и др.] под контролем коагулограммы. Показаны анальгетики, жаропонижающие средства. При менингеальном синдроме проводят дегидратацию салуретиками (фуросемид, ацетазоламид).
Профилактика. Направлена на борьбу с педикулезом. Лиц с повышенным риском заражения вакцинируют вакциной Е (сыпнотифозной комбинированной живой сухой) в дозе 0,25 мл подкожно однократно с ревакцинацией через 1 год или вакциной сыпнотифозной химической сухой в дозе 0,5 мл подкожно однократно с ревакцинацией через 4 мес. В очаге инфекции проводят санитарную обработку больных, камерную дезинфекцию постельных принадлежностей, одежды и белья. За контактными лицами наблюдают в течение 25 дней. В связи с трудностями клинической диагностики, сходством сыпного тифа с целым рядом других заболеваний, сопровождающихся лихорадкой, необходимостью своевременной диагностики каждого случая всем больным с лихорадкой более 5 дней следует проводить двукратное (с интервалом 10–14 дней) серологическое обследование на сыпной тиф.
20. Ботулизм: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Б отулизм — острая инфекционная болезнь из группы сапрозоонозов с фекально-оральным механизмом передачи, развивающаяся в результате употребления пищевых продуктов, в которых произошло накопление токсина возбудителя, блокирующего передачу нервных импульсов. Выделяют ботулизм пищевой, раневой и грудных детей, когда токсин образуется соответственно в ране и ЖКТ. Пищевой ботулизм составляет более 99% всех случаев болезни.
Этиология. Возбудители ботулизма — Clostridium botulinum представляют собою анаэробные подвижные Гр(+) палочки. По антигенным свойствам продуцируемых токсинов они подразделяются на 7 серологических типов — А, В, С, D, Е, F и G. Оптимальные условия роста вегетативных форм — крайне низкое остаточное давление кислорода и температурный режим в пределах 28-35°С. В то же время, прогревание при температуре 80°С в течение 30 мин вызывает их гибель. В неблагоприятных условиях, во внешней среде вегетативные формы возбудителей ботулизма образуют споры.
Эпидемиология. Споровые формы возбудителя можно обнаружить в пыли, воде и иле. Практически все пищевые продукты, загрязнённые почвой или содержимым кишечника животных, птиц, рыб, могут содержать споровые формы возбудителей ботулизма. В естественных условиях образование вегетативных форм и ботулотоксина наиболее интенсивно происходит после смерти животного, когда температура тела снижается до оптимальной для возбудителя. При создании анаэробных условий в результате потребления кислорода аэробными бактериями, водорослями в почве, придонном иле мелких водоёмов также возможны размножение вегетативных форм возбудителя и токсинообразование. Подавляющее число случаев ботулизма связано с употреблением консервов (грибы, бобы, овощи), рыбы и мяса домашнего приготовления. Если контаминируется твердофазный продукт (колбаса, копчёное мясо, рыба), то в нём возможно «гнёздное» образование токсина, поэтому заболевают не все лица, употреблявшие этот продукт. Значительно реже встречаются случаи заболевания в результате заражения лишь спорами возбудителей Cl. botulinum. К ним относят так называемые раневой ботулизм и ботулизм новорождённых. Раневой ботулизм может возникнуть вследствие загрязнения ран, в которых создаются анаэробные условия. При этом из попавших в рану спор прорастают вегетативные формы, которые и продуцируют ботулотоксины. Ботулизм младенцев наблюдают преимущественно у детей первых 6 мес жизни. Большинство заболевших находились на частичном или полном искусственном вскармливании. Иногда споры выделяли из мёда, используемого для приготовления питательных смесей, или находили в окружающей ребёнка среде: почве, бытовой пыли помещений и даже на коже кормящих матерей. Восприимчивость к ботулизму всеобщая. Иммунитет при ботулизме типоспецифический антибактериальный, выражен слабо, поэтому возможно повторное заболевание.
Патогенез. Заболевание вызывается исключительно токсином, который накапливается в пищевых продуктах в анаэробных условиях. Споры и вегетативные формы, которые могут попасть в организм человека с частичками почвы, не вызывают патологического процесса. Ботулотоксин всасывается в верхних отделах желудочно-кишечного тракта и избирательно поражает строго специфические структуры: большие (альфа-мотонейроны) передних рогов спинного мозга и аналогичные им ядра клеток черепно-мозговых нервов. Из этого положения вытекают 3 клинически важных факта: ей не наблюдается, т.к. помимо альфа-мотонейронов существуют еще бета-мотонейроны (малые), которые продолжают нормально функционировать. Каков генез нарушения функции нервной системы. Ботулотоксин нарушает высвобождение нейромедиатора (ацетилхолина) в нервно-мышечных синапсах и блокирует передачу импульса с нервного волокна на мышцу.
Клиника. Инкубационный период колеблется от нескольких часов до 2—5 дней. Выделяют следующие синдромы: паралитический, гастроинтестинальный и общетоксический. Последний выражен слабо. Гастроинтестинальный синдром — довольно частое проявление начального периода ботулизма. Он характеризуется тошнотой, рвотой, поносом и длится около суток. Неврологическая симптоматика развивается на фоне гастроинтестинального синдрома, а у некоторых больных лишь через 1—2 сут. Отмечаются общая слабость, сухость во рту, нарушение зрения (нечеткость видения вблизи, «туман», «сетка» перед глазами, диплопия). Объективно выявляется расширение зрачков, их вялая реакция на свет, анизокория, недостаточность какой-либо из глазодвигательных мышц (при диплопии), опущение век и невозможность их поднять (птоз), нистагм. Нередко наблюдается паралич мягкого неба (речь с носовым оттенком, при попытке глотания жидкость выливается через нос). Паралич мышц гортани ведет к осиплости голоса и даже к афонии. Нарушается глотание из-за паралича мышц глотки. Часты парезы мимических мышц. Возможны параличи жевательных мышц, мышц шеи и верхних конечностей. В тяжелых случаях быстро развивается недостаточность дыхательных мышц. Расстройств чувствительности не бывает. Сознание полностью сохранено. Лихорадка отсутствует. При тяжелых формах смерть наступает от паралича дыхания на 3—5-й день болезни. Диагноз основывается на характерной клинической симптоматике. Ботулизм нужно дифференцировать от стволовых энцефалитов, бульбарной формы полиомиелита, дифтерии, нарушения мозгового кровообращения, отравлений (атропином, беленой, мухоморами, этанолом и др.), а при наличии гастроинтестинального синдрома — от гастроэнтеритов другой этиологии. Учитывают эпидемические предпосылки (употребление определенных продуктов, групповой характер заболеваний). Лабораторное подтверждение диагноза является ретроспективным. Определяют наличие ботулотоксина (в остатках пищи, содержимом желудка, кишечника, сыворотке крови) или возбудителя. Осложнения. Наиболее типичными осложнениями являются аспирационная пневмония, ателектазы, гнойные трахеобронхиты или их сочетания. В связи с тем, что ботулотоксин в значительной степени снижает иммунную резистентность организма, определенную опасность представляют осложнения, связанные с инвазивными методами лечения (интубация, трахеостомия, ИВЛ, катетеризация мочевого пузыря и др.), обусловленные присоединением вторичной инфекции. Одним из наиболее частых осложнений лекарственной терапии ботулизма является сывороточная болезнь, развивающаяся примерно у каждого третьего больного, получавшего гетерологичную противоботулиническую сыворотку. Она развивается как правило, в периоде регрессии неврологических симптомов ботулизма. Редко встречается такое специфическое осложнение как «ботулинический миозит», когда на 2—3-й неделе тяжелого заболевания наблюдаются болезненные проявления, напоминающие обычный миозит. Чаще поражаются икроножные мышцы.
Диагностика. Диагноз ботулизма устанавливают на основании эпидемиологических данных (употребление консервов домашнего приготовления, групповые заболевания) и на всестороннем анализе клинической картины заболевания: характерная локализация и симметричность поражений нервной системы, отсутствие лихорадочно-интоксикационного, общемозгового и менингеального синдромов. Обнаружение ботулинического токсина в крови служит абсолютным подтверждением диагноза. Используют РН ботулотоксинов антитоксическими сыворотками путём биопробы на белых мышах. Для этого необходимо до введения лечебной антитоксической противоботулинической сыворотки взять у больного 15–30 мл венозной крови. Исследование позволяет уже в течение 8 ч определить наличие в ней ботулинического токсина и его тип. Аналогичные исследования проводят с промывными водами желудка или рвотными массами, испражнениями больного, остатками подозрительного продукта. Для выделения возбудителя ботулизма производят посевы содержимого желудка, испражнений, подозрительных продуктов на специальные питательные среды (Китта–Тароцци, казеиново-грибную, бульон Хоттингера и др.). Однако для определения серологического типа, продуцируемого возбудителем токсина, требуется дополнительное время. Исследованиям на определение токсина и выделение возбудителя подлежит секционный материал, а в случаях раневого ботулизма — отделяемое из раны, кусочки отторгающейся омертвевшей ткани, тампоны из раны. Ботулизм младенцев подтверждают, определяя ботулотоксины в их крови и/или возбудители в испражнениях.
Лечение. Режим постельный или полупостельный. Диета: стол № 10, зондовое или парентеральное питание в зависимости от состояния больного. Осуществляют энтеральное питание через назогастральный зонд, при этом необходимо помнить, что желудочное кормление предпочтительнее дуоденального. Методика — инфузия в течение 16 ч. Предпочтительны питательные смеси с высокой энергетической плотностью (например, «Isocal HCN», «Osmolite HN»), при ДН — «Pulmocare». Объём белка в сутки определяют из расчёта 25 ккал/кг массы тела и 1,5 г/кг массы тела. При застойном отделяемом из желудка переходят на парентеральное питание с обязательным частичным энтеральным питанием из расчёта 2000–2500 ккал в сутки на взрослого больного. Парентеральное питание осуществляют концентрированными растворами глюкозы (10–40%), смесями аминокислот и жировыми эмульсиями.Больным ботулизмом промывают желудок 2% раствором гидрокарбоната натрия, ставят сифонную клизму, назначают слабительное (30 г сульфата магния в 500 мл воды). Возможно раньше вводят противоботулиническиѐ сыворотки (А, В, Е). Сыворотку типа А вводят в количестве 10 000—15 000 ME, типа В — 5000—7500 ME и типа Е — 15 000 ME. Сыворотку предварительно нагревают до 37 °С и вводят в/в (после предварительной внутрикожной пробы с разведенной 1:100 сывороткой). При тяжелых формах болезни сыворотку в тех же дозах вводят в/м еще 1—2 раза с интервалом 6—8 ч. Назначают также 5% раствор глюкозы п/к или в/в, изотонический раствор хлорида натрия (до 1000 мл), мочегонные средства. При нарастании асфиксии вследствие паралитического закрытия верхних дыхательных путей производят трахеостомию. При параличе дыхания больного переводят на искусственную вентиляцию легких. Прогноз серьезный. Даже при современных методах терапии летальность составляет 15—30%. Срок пребывания в стационаре 1—2мес. Лечебная тактика предполагает следующие мероприятия: 1. Зондовое промывание желудка 5% раствором натрия гидрокарбоната (поскольку токсин инактивируется в щелочной среде) до чистых промывных вод. Показаны высокие сифонные клизмы с использованием того же раствора. В желудок вводятся энтеросорбенты. 2. С целью нейтрализации циркулирующего в крови токсина используют противоботулиническую антитоксическую сыворотку. В случаях, когда тип возбудителя неизвестен, вводят поливалентную сыворотку. Исходя из последних литературных данных, для лечения ботулизма необходимо и достаточно 1 терапевтической дозы сыворотки, введенной внутривенно. Однако в практической сфере все еще используется повторное введение сыворотки в течение 2-3 дней в общей сложности до 8-10 терапевтических доз при тяжелом течении. 3. Доказано, что в организме здорового взрослого человека условий для выработки токсина вегетативными формами нет. Тем не менее, гипотетически такую возможность исключить нельзя. Поэтому для уничтожения вегетативных форм, сохранившихся в кишечнике, традиционно используется антибиотикотерапия. С этой целью назначаются левомицетин, доксициклин, тетрациклин, цефалоспорины III поколения. 4. Проводится массивная дезинтоксикационная терапия. При прогрессировании дыхательных нарушений больные переводятся на искусственную вентиляцию легких.
Профилактика. Проверка консервов перед употреблением, изъятие «бомбажных» банок. Разъяснение населению правил домашнего консервирования продуктов. Прогревание до 100 °С (в течение 30 мин) закатанных в домашних условиях в банки грибов и овощных консервов перед употреблением (для разрушения ботулотоксина). Лицам, употреблявшим вместе с заболевшим инфицированный продукт, вводят профилактически сыворотки (в/м) А, В, Е по 1000—2000 М Е каждого типа и наблюдают за ними в течение 10—12 дней.
Профилактические мероприятия. Специфические. При выявлении случаев заболевания подозрительные продукты подлежат изъятию и лабораторному контролю, а употреблявшие их вместе с заболевшими лица — медицинскому наблюдению в течение 10–12 дней. Целесообразно внутримышечное введение им по 2000 ME антитоксических противоботулинических сывороток типов А, В и Е, назначение энтеросорбентов. Активная иммунизация показана только лицам, которые имеют или могут иметь контакт с ботулотоксинами. Прививки проводят полианатоксином трёхкратно с интервалами 45 сут между первой и второй и 60 сут между второй и третьей прививками. Неспецифические. Профилактика ботулизма заключается в строгом соблюдении правил приготовления и хранения рыбных и мясных полуфабрикатов, консервированных продуктов, копчёностей и др. Опасность представляют консервы домашнего приготовления, особенно грибные, так как кустарное их производство не обеспечивает термической обработки, губительно действующей на споры возбудителей ботулизма. Именно поэтому перед употреблением таких продуктов их целесообразно прокипятить на водяной бане в течение 10–15 мин, чем достигается полная нейтрализация ботулинического токсина. Однако необходимо помнить, что при этом гибнет токсин, а не споровые формы, поэтому при повторном использовании продукта кипячение необходимо повторить. В профилактике ботулизма существенное значение имеет санитарное просвещение населения в отношении приготовления продуктов питания, которые могут стать причиной отравления ботулотоксинами.
21. Вирусный гепатит А: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, специфическая и неспецифическая профилактика.
ВГА (инфекционный гепатит, эпидемический гепатит, болезнь Боткина) — острое вирусное заболевание человека с фекально-оральным механизмом передачи возбудителя. Характеризуется воспалением печени, циклическим доброкачественным течением, может сопровождаться желтухой.
Этиология. Возбудитель ВГА — вирус HAV (hepatitis A virus), относимый к роду Hepatovirus в составе семейства Picornaviridae. Мелкая безоболочечная сферическая РНК-содержащая частица. Сохранение при комнатной температуре в течение нескольких недель, при +4 °С — месяцами, при –20 °С остаётся жизнеспособным несколько лет. Выдерживает нагревание до 60 °С в течение 4–12 ч; устойчив к действию кислот и жирорастворителей, способен к длительному сохранению в воде, пищевых продуктах, сточных водах, на различных объектах внешней среды. При кипячении разрушается в течение 5 мин, при обработке хлорамином — через 15 мин. Вирус чувствителен к формалину, ультрафиолетовому облучению. Инактивируется также автоклавированием, перманганатом калия, йодистыми соединениями, 70% этанолом, дезинфектантами на основе четвертичных аммониевых соединений.
Эпидемиология. ВГA — классический антропоноз, единственный источник (резервуар) возбудителя инфекции — человек (с желтушной и безжелтушной формами). Механизм передачи: фекально-оральный. Пути передачи: водный, пищевой и бытовой. Факторы передачи — различные пищевые продукты (в том числе морепродукты, замороженные овощи и фрукты), не подвергшиеся термической обработке, а также вода и грязные руки. Крупные вспышки ВГA связаны с фекальным загрязнением водоёмов (источников водоснабжения) или с попаданием сточных вод в водопроводную сеть. В детских коллективах большое значение имеет контактно-бытовой путь передачи через грязные руки и различные предметы обихода: игрушки, посуду, бельё и т.д. Очень редко может происходить передача HAV половым путём при орально-анальных контактах, преимущественно у гомосексуалистов. Восприимчивость людей к HAV всеобщая. Среди детей болеют преимущественно школьники, среди взрослых — военнослужащие, студенты, пациенты закрытых учреждений (психиатрические больницы, специализированные интернаты и т.д.). Иммунитет после перенесённого ВГА прочный и длительный, практически пожизненный. Характерные эпидемиологические особенности ВГA — осенняя сезонность и периодичность. Подъём заболеваемости регистрируют обычно каждые 5–6– 10 лет.
Патогенез. Внедрение HAV в организм происходит через рот и далее в желудок. Будучи кислотоустойчивым, вирус легко преодолевает желудочный барьер, поступает в тонкую кишку, всасывается в кровь и по системе воротной вены достигает печени, в клетках которой происходит его репликация. На мембране гепатоцитов есть соответствующие вирусу рецепторы, к которым HAV прикрепляется и проникает внутрь печёночной клетки; в цитоплазме гепатоцита происходит его репликация. Часть вновь образованных вирусных частиц поступает с жёлчью в фекалии и выделяется из организма, другая инфицирует соседние гепатоциты. Установлено, что длительную репликацию HAV в культуре клеток не сопровождает цитолиз гепатоцитов. Поэтому в настоящее время полагают, что поражение печени при ВГA обусловлено не столько самим HAV, сколько клеточными иммунными реакциями человека. Цитотоксические Т-клетки распознают и лизируют инфицированные вирусом гепатоциты. Кроме того, эти же Т-лимфоциты продуцируют гамма-интерферон, запуская целый ряд иммунных реакций. Освобождение от вируса происходит в значительной степени благодаря иммунологически опосредствованному разрушению печёночных клеток. Вследствие распада подвергшихся некрозу гепатоцитов вирус и его «обломки» поступают в кровь, то есть возникает фаза вторичной вирусемии. HAV обладает высокой иммуногенной активностью. Одновременно с клеточным происходит активизация и гуморального компонента иммунной системы с накоплением вируснейтрализующих антител. Благодаря быстрому и интенсивному иммунному ответу возникает блокада репликации вируса, а его дальнейшее внедрение в неинфицированные гепатоциты ограничивается. В результате сочетанного действия всех звеньев иммунной системы, как правило, уже через несколько недель организм освобождается от HAV, поэтому при ВГA нет ни длительного вирусоносительства, ни хронических форм. Адекватностью защитной иммунной реакции при ВГA объясняют сравнительно лёгкое его течение, исключительную редкость фульминантных форм с летальным исходом, полное выздоровление в подавляющем большинстве случаев. Массивного некроза гепатоцитов при ВГA обычно не бывает. Основная масса гепатоцитов остаётся неповрежденными. Как и при других острых вирусных гепатитах, при ВГA возникает острое диффузное воспаление печени, которое можно выявить ещё до появления желтухи. При ВГA печень — единственный орган-мишень, в котором происходит репликация вируса, поэтому внепечёночные проявления ВГА не свойственны. В лизисе поражённых HAV гепатоцитов принимают участие молекулы HLA, вследствие чего в течение болезни «запускаются» аутоиммунные механизмы с образованием антител к собственным гепатоцитам.
Клиника. Классическим, хотя и не самым частым, считают протекающий циклически желтушный вариант ВГA, при котором вслед за инкубационным следует прежелтушный период. Начало болезни обычно острое, с повышением температуры тела до 38–39 °С, симптомами интоксикации (головная боль, головокружение, необъяснимая слабость, разбитость, ломота в мышцах, костях, суставах и др.) и диспепсическим синдромом (снижение аппетита, тошнота, горечь во рту, отрыжка, рвота, тяжесть в эпигастральной области и правом подреберье, задержка или послабление стула). Одновременно, а иногда раньше диспепсических, могут возникнуть незначительно выраженные катаральные явления со стороны верхних дыхательных путей (першение в горле, небольшая боль при глотании и др.), что нередко приводит к ошибочной диагностике ОРВИ. У детей возможны интенсивные боли в животе, имитирующие острый аппендицит, желчную колику; для взрослых это нехарактерно. В конце преджелтушного периода (3-7 дней с колебаниями от 2 до 14 дней), моча становится тёмно-жёлтой, а кал — осветлённым. В отдельных случаях возможен зуд. У детей уже в преджелтушном периоде может быть выявлено увеличение печени. В сыворотке крови заболевших ВГA в преджелтушном периоде значительно (в 10 и более раз) повышена активность аминотрансфераз — АЛТ и АСТ, а в моче увеличено содержание уробилина. Через 3–5 дней от дебюта болезни температура тела обычно нормализуется, но возникает иктеричность — вначале склер, затем кожи, что знаменует начало желтушного периода. У 2–5% больных симптомы преджелтушного периода отсутствуют, ВГA сразу начинается с изменения окраски испражнений и желтушного окрашивания склер. Обычно с появлением желтухи самочувствие больных довольно быстро начинает улучшаться, нормализуется температура тела, через несколько дней исчезают все симптомы преджелтушного периода. Дольше сохраняются слабость и снижение аппетита. В последние годы нередко у больных ВГA на фоне возникшей желтухи продолжается лихорадка и нарастают симптомы интоксикации; чаще это бывает у пациентов с хронической алкогольной интоксикацией или наркотической зависимостью. Желтуха при ВГA нарастает быстро, достигая обычно максимума за 3–5 дней, в последующие 5–10 дней держится на одном уровне, а затем интенсивность её уменьшается. В среднем продолжительность желтушного периода около 2 нед. При осмотре больного в этом периоде обнаруживают увеличение и уплотнение печени, край её закруглён, чувствителен при пальпации; увеличение селезёнки отмечают в 10–20% случаев, чаще у детей. На высоте желтухи характерна брадикардия. По мере уменьшения интенсивности желтухи нормализуется окраска кала и мочи, постепенно уменьшается до нормальных размеров печень. В желтушном периоде сохраняется выраженная гиперферментемия (активность аминотрансфераз в 10–100 раз выше нормы) с преимущественным повышением активности АЛТ по сравнению с АСТ (коэффициент де Ритиса всегда менее 1). Гипербилирубинемия обычно умеренная и непродолжительная, в основном за счёт прямого билирубина. Характерно значительное повышение показателя тимоловой пробы, который может оставаться изменённым длительное время и в периоде реконвалесценции. В гемограмме отмечают нормоцитоз или лейкопению, относительный лимфоцитоз; СОЭ в норме. В моче присутствуют жёлчные пигменты (билирубин) с первых дней желтушного периода. Период реконвалесценции характеризует обычно быстрое исчезновение клинических и биохимических признаков болезни, в частности гипербилирубинемии. Позднее происходит нормализация показателей активности АЛТ и АСТ; повышение тимоловой пробы может сохраняться долго, в течение нескольких месяцев. Самочувствие переболевших ВГA, как правило, бывает удовлетворительным, возможны утомляемость после физической нагрузки, неприятные ощущения, тяжесть в животе после еды, иногда сохраняется незначительное увеличение печени. Продолжительность этого периода в большинстве случаев не превышает 3 мес. В некоторых случаях период реконвалесценции может затягиваться до 6–8 и более месяцев, возможны обострения (ферментативные или клинические), а также рецидивы. Последние возникают обычно у лиц 20–40 лет и протекают, как правило, легче, чем первая волна заболевания. Однако есть сообщения о рецидивах с острой печёночной недостаточностью, а также с летальным исходом. Описанный выше желтушный вариант ВГA чаще всего протекает в лёгкой или среднетяжёлой формах. Тяжёлую форму ВГA встречают не более чем у 1% больных, преимущественно у лиц старше 40 лет, у пациентов с хронической алкогольной интоксикацией или наркотической зависимостью, при сочетании ВГA с острым или хроническим вирусным гепатитом иной этиологии. У детей тяжёлую форму ВГA регистрируют в пубертатном периоде, а также на фоне ожирения и отягощённого аллергологического анамнеза. Как и при других острых вирусных гепатитах, основной критерий тяжести ВГA — выраженность синдрома интоксикации (общая слабость, адинамия, головокружение, диспепсические расстройства, вегетососудистые нарушения, а в отдельных случаях — нарушения сознания).
Диагностика. Диагноз ВГА устанавливают с учётом клинических, эпидемиологических и лабораторных данных. Основание для предположения о ВГA (неспецифическая диагностика): острое начало болезни с высокой температурой тела, диспепсическими и астеновегетативными явлениями; короткий преджелтушный период; увеличение печени; улучшение самочувствия, нормализация температуры тела при появлении желтухи; гиперферментемия (АЛТ, АСТ) с коэффициентом де Ритиса менее 1;гипербилирубинемия (преимущественно за счёт прямого); высокий показатель тимоловой пробы; указание на контакт с больным(и) желтухой за 7–50 дней до заболевания или употребление сырой воды из случайных источников, немытых овощей и фруктов и т.д.; случаи ВГA в коллективе, местности, где находился пациент в соответствующие инкубационному периоду сроки. Стандарт лабораторной диагностики ВГА (обязательный). • Клинический анализ крови. • Клинический анализ мочи и жёлчные пигменты (билирубин). • Биохимический анализ крови: билирубин, АЛТ, АСТ, протромбиновый индекс, тимоловая проба. • Иммунологическое исследование: анти-HAV IgM(ИФА-специфическая диагностика); HBs Ag; анти-HBс IgM; анти-HCV. Дополнительная лабораторно-инструментальная диагностика ВГA. • Холестерин, ЩФ, ГГТ, глюкоза, амилаза, общий белок и белковые фракции, ЦИК, криоглобулины, LE-клетки, РНК HAV, анти-HEV IgM, анти-ВИЧ. • УЗИ брюшной полости. • Рентгенография органов грудной клетки; ПЦР (используется редко)
Лечение. Стандарт лечения • Лёгкая форма: Базисная терапия: – режим полупостельный; – щадящая диета (стол № 5); – обильное питьё (до 2–3 л в сутки). • Среднетяжёлая форма: Базисная терапия. Инфузионная дезинтоксикационная терапия: внутривенно капельно 5–10% раствор глюкозы или раствор Рингера 800–1200 мл/сут. Поливитаминные препараты. • Тяжёлая и молниеносная формы (см. «Гепатит В»). Выписку из стационара производят при хорошем самочувствии, отсутствии желтухи, уменьшении печени до нормальных размеров (или явной тенденции к таковым), улучшении биохимических показателей по сравнению с периодом разгара (допускают остаточное повышение активности аминотрансфераз на уровне 3–4 норм).
Профилактика.Специфическая. Осуществляют инактивированными вакцинами. В национальный календарь профилактических прививок вакцинация против ВГA включена по эпидемическим показаниям. Прививкам подлежат: дети с трёх лет, проживающие на территориях с высоким уровнем заболеваемости ВГА; медицинские работники, воспитатели и персонал детских дошкольных учреждений; работники сферы общественного питания; рабочие, обслуживающие водопроводные и канализационные сооружения; лица, выезжающие в гиперэндемичные по ВГA регионы и страны, а также контактные в очагах ВГА. Вакцинация против ВГА показана также пациентам с хроническими заболеваниями печени (в том числе бессимптомным носителям HBS Ag, больным хроническими ВГВ и ВГС). Вакцинируют и воинские коллективы, дислоцированные в полевых условиях. Неспецифические. Включает санитарно-гигиенические мероприятия, обеспечение населения доброкачественной питьевой водой и продуктами питания. Ранняя диагностика ВГA и изоляция заболевших ещё до появления у них желтухи. В отделениях необходима раздельная госпитализация больных ВГA и другими гепатитами во избежание внутрибольничного заражения. Лица, контактировавшие с больными ВГА, должны находиться под наблюдением в течение 35 дней с момента последнего контакта (термометрия, опрос, определение размеров печени и селезёнки, осмотр кожи и слизистых оболочек и т.д.). При наличии у контактных лиц лихорадки, диспепсических явлений, потемнения мочи и т.д. проводят лабораторные исследования с определением активности АЛТ. По решению врача эпидемиолога в зависимости от конкретной ситуации в очаге ВГA может быть назначено также обследование контактных, не имеющих каких-либо явных признаков заболевания, с целью выявления безжелтушного, стёртого и инаппарантного вариантов ВГА.
22. Вирусный гепатит Е: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
Вирусный гепатит Е (ВГЕ) — острое вирусное заболевание с фекально-оральным механизмом передачи возбудителя, для которого характерны циклическое течение и частое развитие ОПЭ у беременных.
Этиология. Вирус гепатита Е (HEV) имеет сферическую форму и по своим свойствам близок калицивирусам (семейство Caliciviridae). Геном вируса представлен однонитчатой РНК. Вирус быстро разрушается под действием хлорсодержащих дезинфицирующих средств. Он менее устойчив в окружающей среде, чем HAV.
Эпидемиология. Источник инфекции — больные с острой формой ВГЕ. Хронического носительства вируса не зарегистрировано. Вирус выявляют в крови больного через 2 нед после заражения, а в фекалиях — за неделю до начала болезни и в течение первой недели болезни. Виремия продолжается около 2 нед. HEV также выделяют от животных и птиц, которые могут быть резервуарами HEV для человека. Есть данные о передаче HEV при переливании крови от донора с бессимптомной формой заболевания и виремией. Основной путь передачи инфекции — водный. Чаще всего болеют мужчины 15–40 лет. У детей заболевание возникает редко. ВГЕ распространён главным образом в развивающихся странах Азии и Африки, где вызывает значительные эпидемические вспышки преимущественно водного происхождения или спорадические случаи болезни. Характерна сезонность инфекции: подъём заболеваемости связан с началом или окончанием сезона дождей в Юго-Восточной Азии, а в странах Центральной Азии пик заболеваемости приходится на осень. Периодические подъёмы заболеваемости в эндемичных регионах регистрируют каждые 7–8 лет. Описаны повторные случаи заболевания ВГЕ, что, возможно, связано с антигенной неоднородностью вируса. HEV может передаваться плоду от матери в III триместре беременности. В странах Европы (в том числе и в России) и Северной Америки заболеваемость ВГЕ носит спорадический характер и регистрируется у лиц, вернувшихся из эндемичных регионов. Следует отметить, что у больных хроническими гепатитами (вирусными, аутоиммунными), у доноров, больных гемофилией и лиц, перенёсших трансплантацию почек, высока частота обнаружения анти-HEV IgG, что подтверждает гипотезу о риске парентеральной передачи вируса от доноров.
Патогенез. Изучен недостаточно. По-видимому, HEV обладает прямым цитопатическим действием. Для ВГЕ характерно тяжёлое течение болезни в III триместре беременности, однако причины этого феномена неизвестны. В основе тяжёлого течения болезни лежит массивный некроз гепатоцитов, развитие тромбогеморрагического синдрома вследствие резкого дефицита плазменных факторов гемостаза, а также гемолиз, приводящий к ОПН. В этих случаях отёк мозга и ДВС-синдром могут приводить к смерти.
Клиническая картина. Инкубационный период болезни составляет 15–40 дней, в среднем около 1 мес. Выделяют желтушные и безжелтушные формы болезни (соотношение 1:9). Для желтушных форм характерно острое циклическое, преимущественно лёгкое течение болезни (60% всех случаев). Различают острое и постепенное начало заболевания. Преджелтушный период чаще короткий и составляет 2–5 дней, преобладают проявления диспепсического синдрома. Кратковременная лихорадка (чаще субфебрильная) возникает у 10–20% больных. Примерно у 20% больных болезнь начинается с изменения цвета мочи и развития желтухи. Продолжительность желтушного периода составляет от нескольких дней до одного месяца (в среднем 2 нед), возможно развитие холестатической формы с длительной желтухой, кожным зудом. У 1% больных желтушными формами ВГЕ развивается фульминантный гепатит. Тяжёлое течение ВГЕ наблюдают у беременных (особенно в III триместре), а также у рожениц в течение первой недели после родов. Предвестниками такого течения ещё в преджелтушном периоде заболевания могут быть выраженные симптомы интоксикации, лихорадка, диспепсический синдром, боль в правом подреберье. После появления желтухи быстро нарастают симптомы печёночной энцефалопатии вплоть до развития комы. При этом отмечают выраженный гемолиз, гемоглобинурию, олигоанурию, а также резко выраженный геморрагический синдром, обусловленный снижением активности (до 2–7% нормальных показателей) факторов гемостаза, входящих в протромбиновый комплекс (II, VII, X). При развитии геморрагического синдрома возникают массивные желудочно-кишечные, маточные и другие кровотечения, которые нередко приводят к смерти. Беременность в большинстве случаев заканчивается внутриутробной смертью плода, выкидышем, преждевременными родами. Из родившихся живыми каждый второй погибает в течение месяца. В эндемичных регионах ВГЕ у беременных в 70% случаев протекает фульминантно. Летальность составляет более 50%, особенно в III триместре беременности. Диагностика на наличие ВГЕ могут указывать: предположение о водном пути передачи заболевания; посещение эндемичной по ВГЕ страны; клинические проявления, сходные с таковыми при ВГА; выявление тяжёлых форм с симптомами печёночной энцефалопатии, особенно у беременных во второй половине беременности, раннем послеродовом периоде или у кормящих матерей. Подтверждает диагноз выявление анти-HEV IgM в сыворотке крови, которые появляются в крови через 3–4 недели после инфицирования и исчезают через несколько месяцев.
Лечение. Госпитализация обязательна. Стол 5 и 5А, режим полупостельный. Этиотропная терапия отсутствует. При ВГЕ применяют такой же комплекс лечебных мероприятий, как при других острых вирусных гепатитах лёгкой и средней тяжести. В случае тяжёлого течения гепатита лечение проводится в отделениях (палатах) интенсивной терапии с использованием всех средств и методов, направленных на профилактику и лечение печёночной энцефалопатии, тромбогеморрагического синдрома, включая применение кортикостероидов, ингибиторов протеаз, оксигенотерапии, дезинтоксикационной терапии, криоплазмы, экстракорпоральных методов детоксикации. При развитии ВГЕ у беременных искусственное прерывание беременности не показано. Рекомендуется укорочение периода родов и их обезболивание. Больных выписывают из стационара после нормализации клинических и биохимических показателей с последующим диспансерным наблюдением через 1–3 мес после выписки.
23. Вирусные гепатиты В: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, исходы, диспансерное наблюдение, специфическая и неспецифическая профилактика.
Вирусный гепатит В (ВГВ), или гепатит В, — вирусная антропонозная инфекционная болезнь с контактным и вертикальным механизмами передачи возбудителя. Характеризуется циклически протекающим паренхиматозным гепатитом с наличием в части случаев желтухи и возможной хронизацией.
Этиология. Вирус гепатита В (HBV) относится к семейству гепаднавирусов (hepar —печень, DNA — ДНК, т.е. ДНК-содержащие вирусы, поражающие печень), роду Orthohepadnavirus. HBV, или частица Дейна, имеет сферическую форму. Оболочка состоит из фосфолипидного бислоя, в который погружены частицы поверхностного антигена, состоящие из нескольких сотен молекул белка, гликопротеидов и липопротеидов. Внутри HBV находится нуклеокапсид, или ядро (core), имеющее форму икосаэдра, содержащее геном HBV, концевой белок и фермент ДНК-полимеразу. Геном HBV представлен частично двухцепочечной молекулой ДНК, имеющей незамкнутую кольцевую форму и содержащей около 3200 пар нуклеотидных оснований (3020–3200). ДНК HBV включает четыре гена: S-ген, кодирующий поверхностный антиген оболочки — HBS Ag; С-ген, кодирующий HBCAg; P-ген, кодирующий информацию о ферменте ДНК-полимеразе, обладающей функцией обратной транскриптазы; X-ген, несущий информацию о X-белке. HBS Ag синтезируется в цитоплазме гепатоцита. Во время репликации вируса образуется значительный избыток HBS Ag, и, таким образом, в сыворотке крови больного преобладают частицы HBS Ag, а не полноценные вирусы — в среднем на одну вирусную частицу приходится от 1000 до 1 000 000 сферических частиц HBS Ag.
Эпидемиология. Основным резервуаром и источником HBV служат больные ОГВ, больные хронической HBV-инфекцией (вирусоносители и больные ХГВ). У больных HBV-инфекцией HBS Ag и ДНК HBV обнаруживают в крови, моче, слюне, жёлчи, слёзах, фекалиях, грудном молоке, вагинальном секрете, сперме, цереброспинальной жидкости, крови пуповины. Однако только кровь, сперма и, возможно, слюна представляют реальную эпидемиологическую опасность, так как в других жидкостях концентрация вируса очень мала. Основной фактор передачи — кровь. Инфицирующая доза вируса может содержаться в 0,0005 мл крови. ВГВ характеризуется множественностью путей передачи (естественных и искусственных): возможен контактный, вертикальный и артифициальный (парентеральные манипуляции, трансплантация органов) пути передачи. Чрезвычайно эффективен половой путь передачи HBV. Среди инфицированных вирусом гепатита В высок удельный вес наркоманов, практикующих внутривенное введение наркотиков. Заражение ВГВ возможно и при бытовом общении с больным или вирусоносителем при нарушении целостности слизистых оболочек и кожного покрова. В этих случаях HBV внедряется через повреждённую кожу (микротравмы), при прямом контакте с источником инфекции либо при совместном пользовании различными предметами обихода и личной гигиены (загрязнённое кровью белье, ножницы, пилочки для ногтей, зубные щётки, бритвы, мочалки и т.д.). Особое значение имеет передача HBV вертикальным путём от беременной (больная ОГВ или хронической HBV-инфекцией) плоду иди новорождённому. При этом возможна трансплацентарная передача вируса (около 8% случаев среди инфицированных детей) или, чаще, заражение в процессе родов при контакте новорождённого с инфицированными околоплодными водами, влагалищным секретом. Риск инфицирования значительно увеличивается, если ОГВ развивается у женщины в III триместре беременности и роды происходят в период HBEAg-емии или ребёнка рожает женщина, больная ХГВ с наличием HBEAg в крови. В настоящее время риск заражения при переливании крови резко снизился, так как всю донорскую кровь проверяют на наличие HBS Ag и анти-НВС IgG. Заражение ВГВ возможно при различных парентеральных медицинских и немедицинских вмешательствах, сопровождающихся нарушением целостности кожного покрова или слизистых оболочек (инъекции, стоматологические, эндоскопические, гинекологические обследования, косметические процедуры, пирсинг, татуаж и т.д.), если нарушаются правила стерилизации инструментов. Группами риска заражения ВГВ служат пациенты отделений гемодиализа, ожоговых центров, гематологических, туберкулёзных стационаров, центров сердечно-сосудистой хирургии, медицинские работники, имеющие контакт с кровью: процедурные и операционные сестры, анестезиологи-реаниматологи, акушеры-гинекологи, хирурги, стоматологи и др. Восприимчивость к ВГВ высокая. Возрастная восприимчивость к ВГВ имеет ряд особенностей, в основном касающихся вероятности хронизации инфекции. Риск развития хронической HBV-инфекции после инфицирования вирусом гепатита В колеблется от 90% у новорождённых, родившихся от HBEAg-позитивных матерей, до 25–30% у грудных детей и детей в возрасте до 5 лет и составляет менее 10% у взрослых. Иммунитет после перенесённого ВГВ длительный, возможно, пожизненный. Повторные случаи ВГВ наблюдают исключительно редко.
Патогенез. HBV попадает в кровь и затем в гепатоциты, где преимущественно происходит его репликация. Репликация возможна также в клетках костного мозга, поджелудочной железы, почек, лимфоцитах, но с меньшей интенсивностью. После адсорбции вируса на поверхности гепатоцита происходит разрушение его наружной оболочки и сore-частица (нуклеокапсид) проникает внутрь клетки, а затем в её ядро. В ядре гепатоцита синтезируется прегеномная РНК с помощью клеточной РНК-полимеразы. Прегеномная РНК переносится в цитоплазму и упаковывается вместе с белком P (HBV ДНК-полимераза) во вновь сформированные капсиды. Антигены вируса экспрессируются на клеточной оболочке, связываются с HLA 1-го и 2-го классов и распознаются цитотоксическими Т-клетками иммунной системы. Последние пролиферируют и образуют клоны антиген-специфических киллерных клеток, лизирующих поражённые клетки. Количество и функциональная активность антиген-специфических киллеров определяет адекватность (или неадекватность) иммунной реакции и исход болезни. Гуморальный ответ организма заключается в продукции специфических антител к антигенам HBV, их связывании с образованием иммунных комплексов и дальнейшей элиминацией из организма. Взаимодействие HBV с клеткой также может приводить к интеграции сегментов ДНК HBV в геном гепатоцита, что, в свою очередь, может играть роль в развитии гепатоцеллюлярной карциномы. Клеточная ДНК с интегрированной в неё вирусной ДНК может существовать пожизненно, при этом с интегрированной ДНК может считываться информация о HBS Ag и он может изолированно синтезироваться гепатоцитом. Таким образом, формируется так называемое «неактивное носительство» HBS Ag. В гепатоците возможно присутствие ДНК HBV как в интегративной, так и в репликативной формах (в основном при ХГВ). Возможна интеграция ДНК HBV в геном клеток почек, поджелудочной железы, кожи и др. В результате проникновения HBV в гепатоциты и его размножения запускается механизм комплексного патологического процесса в печени: усиливаются процессы перекисного окисления липидов, вследствие чего повышается проницаемость мембран печёночных клеток и лизосом, что приводит к высвобождению гидролитических ферментов лизосом и разрушению основных компонентов клетки. При этом высвобождаются белковые компоненты, которые могут выступать в роли аутоантигенов и наряду с перечисленными ранее причинами стимулировать выработку специфических противопечёночных антител, разрушающих гепатоциты, что ещё более усугубляет патологические изменения в печени. Гидролитический аутолиз гепатоцитов ведёт к повреждению капилляров ткани печени и инфильтрации её плазменными элементами с развитием фагоцитарнолимфоцитарной активности. Таким образом, развивается паренхиматозное воспаление органа с появлением у больного определённых клинических и лабораторных признаков (желтуха, увеличение печени, гипербилирубинемия, повышение активности аспарагиновой и аланиновой трансаминаз, ферментов холестаза). Цитолиз на фоне воспалительного некроза гепатоцитов и апоптотической гибели части вирусинфицированных гепатоцитов приводит к снижению синтеза белков, гормонов, витаминов и реализации детоксикации организма. Поступающие через воротную вену из кишечника в печень продукты расщепления белков, жиров и углеводов и их метаболиты не подвергаются в полной мере реакциям обменного синтеза вследствие частичного функционального блока органа. Вследствие нарушения нормальных обменных процессов и нарастающего количества продуктов аутолиза клеток печени развивается системная интоксикация организма и гипоксия тканей. Патологический процесс приобретает прогрессирующее течение, а обширный некроз печёночных клеток в короткие сроки может привести к печёночно-клеточной недостаточности, печёночной энцефалопатии и гибели больного (фульминантная форма гепатита). Таким образом, степень тяжести ОГВ соответствует интенсивности цитолиза гепатоцитов и степени воспалительных повреждений органа. При острой HBV-инфекции элиминация вируса достигается цитолитическим (некроз и апоптоз гепатоцитов) и нецитолитическим (без гибели гепатоцитов) механизмами. Важен факт наличия определённого баланса между апоптозом и лизисом гепатоцитов, так как литический некроз ведёт к диссеминации вируса, а апоптоз предотвращает высвобождение вирионов, так как мембраны апоптотических телец остаются неповреждёнными до момента фагоцитоза этих телец. Хронизация HBV-инфекции наступает при слабом Т-клеточном ответе и преобладании в цитокиновом профиле цитокинов Тх II типа (ИЛ-4, 5, 10, 13), обладающих способностью поддерживать хроническое воспаление. ВГВ — иммунологически опосредованная инфекция, так как в основном опосредована иммунологическими реакциями хозяина, направленными против вирусинфицированных клеток печени, а также действием воспалительных цитокинов. В патогенезе ВГВ имеют значение и аутоиммунные механизмы. Инфицированный HBV гепатоцит приобретает антигенные свойства, что приводит к образованию антител к собственным гепатоцитам. Иммунные комплексы с HBV обнаруживаются при ВГВ не только в печени, но и в эндотелии сосудов различных органов, что приводит к патологическим изменениям в них с развитием гломерулонефрита, узелкового периартериита и другим внепечёночным проявлениям. Течение и исход ВГВ зависят как от особенностей HBV, так и иммунногенетических особенностей пациентов. С учётом полученных данных была сформулирована вирусно-иммуногенетическая концепция патогенеза ВГВ. Для ОГВ характерно диффузное поражение ткани печени, различной выраженности дистрофические и некробиотические изменения гепатоцитов. Воспалительные и некротические изменения часто захватывают всю дольку или несколько долек. Наблюдают как фокальный некроз, затрагивающий единичные гепатоциты, так и массивный и субмассивный некроз паренхимы печени. Обычно отмечают соответствие между обширностью некроза и тяжестью гепатита. Фульминантная форма характеризуется массивным некрозом и отсутствием регенерации печёночной ткани. Для ОГВ типичны гидропическая и баллонная дистрофия печёночных клеток, наличие апоптозных телец, сходных с тельцами Каунсильмена, эндофлебит центральной вены и инфильтрация портального тракта мононуклеарами (цитотоксические клетки и NK-клетки) с сегментарным разрушением терминальной пластинки паренхимы долек. Можно видеть увеличенные клетки Купфера, содержащие липофусцин и клеточный детрит. Морфологическими маркёрами ХГВ служат так называемые «матово-стекловидные» гепатоциты (содержат HBS Ag) и «песочные» ядра в гепатоцитах (содержат НВСAg). При ХГВ в биоптатах печени помимо дистрофии и некроза гепатоцитов, клеточной инфильтрации обнаруживают фиброзные изменения в дольках и портальном тракте, перипортальный фиброз. Мостовидные некрозы (порто-центральные и порто-портальные) ведут к формированию порто-центральных и порто-портальных фиброзных септ, нарушающих цитоархитектонику печёночной ткани, что в дальнейшем может привести к развитию цирроза.
Клиника. Для ВГВ характерно циклическое течение. Инкубационный период длится от 45 до 180 дней (обычно 2–4 мес). В течении ОГВ выделяют преджелтушный, желтушный периоды и период реконвалесценции. Болезнь начинается мгновенно. Преджелтушный период длится 1–5 нед. Характерны астеновегетативный (слабость, утомляемость, разбитость) и диспепсический (ухудшение аппетита, снижение вкусовых ощущений, тошнота, иногда рвота, горечь во рту, тяжесть и тупые боли в правом подреберье) синдромы. Часты головная боль, нарушения сна. Примерно у 20–30% больных наблюдают боли в крупных суставах, уртикарную сыпь, повышение температуры тела, реже кожный зуд. Ещё до появления желтухи увеличивается печень (иногда и селезёнка), моча становится тёмной, в сыворотке крови повышается в 20–30 раз активность АЛТ и АСТ; в крови обнаруживают специфические маркёры HBV-инфекции (HBS Ag, HВE-антиген, анти-НВС IgM). Преджелтушный период может отсутствовать, тогда потемнение мочи и желтушность склер служат первыми симптомами болезни. С появлением желтухи самочувствие больных ухудшается: нарастает слабость, аппетит снижается вплоть до анорексии, отмечают постоянную тошноту, сухость и горечь во рту, нередко головную боль и головокружение и т.д., однако прекращается артралгия и нормализуется температура тела. В этот период печень обычно ещё более увеличивается: она мягкая, с гладкой поверхностью, чувствительна при пальпации. Желтуха нарастает постепенно, достигая своего максимума на 2–3-й неделе, интенсивность её может быть значительной. Моча становится тёмной, кал на высоте желтухи становится ахоличным. Продолжительность желтушного периода варьирует от нескольких дней до нескольких месяцев, чаще составляет 2–6 нед. Гиперферментемию (с преимущественным повышением активности АЛТ в 30–50 раз) регистрируют в течение всего желтушного периода, затем происходит постепенное снижение её уровня. Белково-синтетическая функция печени при ВГВ нарушается при тяжёлом течении болезни, что проявляется снижением показателя сулемовой пробы, содержания альбумина, протромбинового индекса, активности β-липопротеидов. Показатель тимоловой пробы обычно не повышается. В периферической крови каких-либо существенных отклонений от нормы нет, количество лейкоцитов нормальное или понижено. Период реконвалесценции может продолжаться до полугода. Клинико-биохимические изменения исчезают медленно. Относительно быстро нормализуется содержание билирубина в сыворотке крови (в течение 2–4 нед), а повышенная активность ферментов сохраняется от 1 до 3 мес. У ряда больных можно наблюдать волнообразный характер гиперферментемии в период реконвалесценции. Необходимо учитывать, что рецидив заболевания с ферментативным обострением и гипербилирубинемией требует исключения HDV-инфекции. Клинические варианты ВГВ могут быть самыми разнообразными: желтушный, безжелтушный, стёртый, инаппарантный (субклинический). Судить о частоте каждого из них сложно, так как диагностируют и соответственно регистрируют обычно только желтушный вариант. Между тем, по данным эпидемиологических исследований, безжелтушный вариант встречают в 20–40 раз чаще желтушного. Одна из особенностей желтушного варианта ВГВ — выраженность в ряде случаев холестатического синдрома. При этом интоксикация незначительная, основная жалоба пациентов — зуд кожи; желтуха интенсивная, с зеленоватым или серо-зелёным оттенком кожи, сохраняется длительно. Печень значительно увеличена, плотная. Кал ахоличный, моча тёмная в течение длительного времени. В сыворотке крови — высокая билирубинемия, повышенное содержание холестерина и активности ЩФ, а уровень гипералатемии относительно невысок (5–10 норм). Желтушный период может затягиваться до 2–4 мес, полная нормализация биохимических сдвигов происходит ещё позже. ВГВ может протекать в лёгкой, среднетяжёлой или тяжёлой форме. Наиболее информативным для оценки тяжести вирусного гепатита признают синдром печёночной интоксикации, который проявляется слабостью, адинамией, снижением аппетита, вегетососудистыми нарушениями, а в отдельных случаях и нарушением сознания. Именно выраженность интоксикации (в сочетании с результатами лабораторного исследования, прежде всего протромбиновой активностью) характеризует тяжесть гепатита. При лёгкой форме ВГВ интоксикацию не наблюдают или она незначительно выражена, интенсивность желтухи невелика, биохимические пробы выявляют лишь повышение билирубина в крови и гиперферментемию (при этом коэффициент де Ритиса менее 1). При среднетяжёлой форме ВГВ интоксикация проявляется умеренной слабостью, непостоянной головной болью, снижением аппетита, тошнотой; желтуха яркая и стойкая. Биохимически, кроме изменений, присущих лёгкой форме, может выявляться незначительное снижение протромбиновой активности. Тяжёлая форма ВГВ характеризуется нарастанием выраженности признаков интоксикации (слабость, аппетит отсутствует, постоянная тошнота, частая рвота). Появляются новые клинические признаки: адинамия, головокружение, мелькание мушек перед глазами, тахикардия, болезненность в области печени, сокращение размеров печени, геморрагический синдром (кровотечения из носа, кровоподтёки в местах инъекций и т.д.), лихорадка, желтуха обычно нарастает. Одновременно отмечают значительное снижение протромбиновой активности и показателя сулемовой пробы, возможно снижение активности трансфераз при нарастающей гипербилирубинемии. Наиболее неблагоприятным осложнением тяжёлой формы ВГВ служит ОПЭ как проявление острой или подострой дистрофии печени, которая, как и молниеносное (фульминантное) течение ВГВ, встречается редко (1–2% случаев). В случае развития указанных осложнений у 80–90% больных наступает летальный исход. Начальным проявлением ОПЭ становятся жалобы на головные боли. По мере нарастания тяжести заболевания могут появиться симптомы ОПЭ — инверсия сна, вялость и сонливость, заторможенность или возбуждение, негативизм, апатия или агрессия (I степень), «хлопающий» тремор, мелькание мушек перед глазами, чувство «провалов» (I–II степень), эхолалия, отсутствие продуктивного контакта с больным, сопор (III степень), полное отсутствие сознания, арефлексия (IV степень).
Диагностика. ОГВ диагностируют на основании эпидемиологического анамнеза (переливание крови, операция, внутривенное введение наркотиков, другие парентеральные вмешательства, случайные половые связи в течение последних 6 мес, тесный контакт с носителями HBS Ag) и клинико-лабораторных данных (постепенное начало, длительный преджелтушный период с диспепсическими расстройствами, артралгиями и экзантемой, выраженной слабостью; ухудшение самочувствия на фоне появления желтухи; гиперферментемия), однако эти данные не позволяют дифференцировать ВГВ от других вирусных гепатитов, поэтому необходима его верификация путём выявления специфических маркёров острой HBV-инфекции: HBS Ag, анти-НВС IgM, HBEAg.
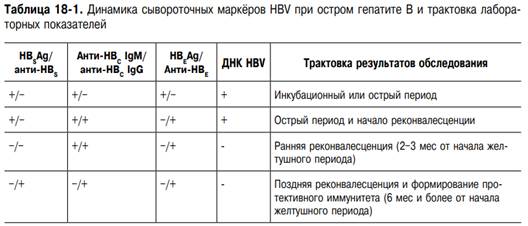
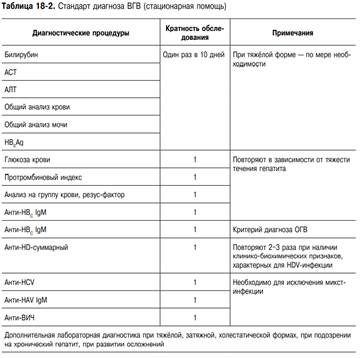
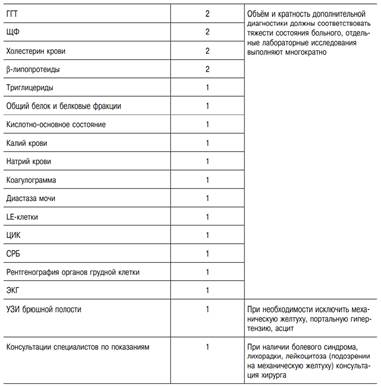
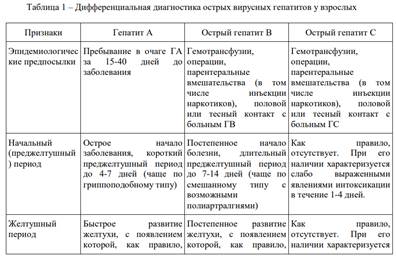
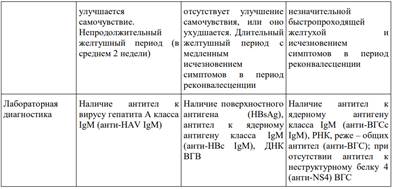
Лечение.
Базисная терапия включает в себя щадящий режим и диету. Из рациона исключают жареные, копченые, маринованные блюда, тугоплавкие жиры (свинина, баранина). Категорически запрещается алкоголь в любых видах
Этиотропная терапия. #Энтекавир (по 0,5 мг 1 раз в сутки), #Телбивудин (600 мг 1 раз в сутки), #Тенофовир (300 мг 1 раз в сутки). Терапия проводится до снижения сероконверсии до неопределяемого по HBsAg уровню и до снижения вирусологической нагрузки до неопределяемого уровня. Консолидирующая терапия проводится от 3 до 6 месяцев, далее поддерживающая терапия в течение 12 месяцев.
Патогенетическая и симптоматическая терапия.
1. Дезинтоксикация. Легкая степень тяжести – пероральная дезинтоксикация в объеме 2-3 литров жидкости в сутки (некрепко заваренного чая с молоком, медом, вареньем, а также отвара шиповника, свежеприготовленных фруктовых и ягодных соков, компотов, щелочных минеральных вод. Средняя степень тяжести – инфузионная терапия: 800-1200 мл 5% раствора декстрозы внутривенно капельно. Тяжелая степень тяжести – усиление дезинтоксикационной терапии путем введения декстрана, 10% раствора альбумина, плазмы крови.
2. ГКС (пациентам с любыми проявления фульминантной формы ГB (прекома, кома, признаки массивного некроза печени), с тяжелыми формами гепатита с признаками острой печеночной недостаточности, а также тяжелыми формами без признаков печеночной прекомы – комы, но с выраженными проявлениями интоксикации и их прогрессированием, несмотря на проводимую активную инфузионную терапию с целью подавления иммунопатологических, воспалительных реакций и предотвращения отека-набухания головного мозга. Преднизолон (по 75-100 мг в сутки в/в капельно в течение 7-10 дней).
3. Проведение экстракорпоральной детоксикации (плазмоферез, плазмоферез с частичным плазмообменом, гемосорбция, гемодиализ) тяжелым пациентам.
4. Аминокислоты для улучшения тканевого обмена и стабилизации клеточных мембран.
Адеметионин (5-12 мг/кг/сут в/в или в/м) и др + гепатопротекторы.
5. Витамины.
6. Ферменты ПЖЖ
7. АБТ пациентам с присоединением инфекционных бактериальных осложнений и сопутствующих заболеваний (холецистит, холангит, пневмония и др.)
Исходы. В большинстве случаев острый гепатит В заканчивается выздоровлением. У незначительной части заболевших (10%) болезнь может принять затяжное течение. Если заболевание длится более 6 месяцев, оно расценивается как хронический гепатит.
Диспансерное наблюдение. В кабинете инфекционных заболеваний поликлиники в течение 12 месяцев всем пациентам с ОГB в зависимости от самочувствия, скорости нормализации размеров печени и динамики результатов биохимических исследований с целью контроля эффективности терапии. Диспансерное наблюдение за переболевшим ГB (по месту жительства или лечения) проводится не позднее чем через месяц после выписки его из стационара, при условии нормализации лабораторных показателей. В случае если больной был выписан со значительным повышением активности аминотрансфераз, осмотр проводят через 14 дней после выписки. Сроки освобождения от тяжелой физической работы и спортивных занятий должны составлять 6-12 месяцев. Клинический осмотр, биохимические, иммунологические и вирусологические тесты проводят через 1, 3, 6 месяцев после выписки из стационара.
Профилактика. Специфическая профилактика. Проведение плановой вакцинации против вирусного гепатита B в рамках национального календаря профилактических прививок. Стандартная схема вакцинации от гепатита B: 0-1-6 месяцев. Детей из группы риска (мать болеет или является носителем гепатита B, мать не обследована во время беременности, в семье есть больной гепатитом, ребенок из неблагополучной семьи) прививают по другой схеме: 0-1-2-12 месяцев. - Экстренная профилактика. Вводится иммуноглобулин человека против гепатита B (рассчет дозировок одновременно с вакциной для профилактики вирусного гепатита B, но в разные участки тела. Неспецифическая профилактика. Активное выявление источников инфекции (обследование лиц, подверженных повышенному риску инфицирования и/или имеющие особую эпидемиологическую значимость, профилактика искусственного механизма передачи (переливание крови только по жизненным показаниям, обоснованность инвазивных методов обследования, использовании одноразового инструментария, строгое соблюдение режимов обработки медицинского инструментария и оборудования, использование защитных средств медработниками.
Хронический гепатит.
Хронический гепатит В (ХГВ) — это исход ОГВ, обусловленный персистированием в организме вируса . Принято разделять ХГВ на 2 основных варианта по принципу инфицированности «диким» (НВЕ-позитивный ХГВ) или мутантным вариантом HBV (НВЕ-негативный/анти-НВЕ-позитивный ВГВ —мутантные варианты).
Критериями бессимптомного носительства HBV служит сочетание ряда признаков: персистенция HBS Ag в течение 6 мес и более при отсутствии серологических маркёров репликации HBV (HBEAg, анти-НВС IgM), нормальные показатели печёночных трансаминаз, отсутствие гистологических изменений в печени или картина хронического гепатита с минимальной некрозо-воспалительной активностью [индекс гистологической активности (ИГА) 0–4] и уровень ДНК HBV.
Хроническая HBV-инфекция характеризуется широким спектром клинических вариантов течения и исходов заболевания. Выделяют 4 фазы естественного течения хронической HBV-инфекции в зависимости от присутствия в крови больного HBEAg, степени повышения АЛТ и уровня виремии: фазу иммунной толерантности, фазу иммунного клиренса, фазу иммунного контроля и фазу реактивации. Независимые факторы риска развития гепатоцеллюлярной карциномы — мужской пол пациента, курение, злоупотребление алкоголем, повышенный уровень АЛТ, присутствие HBEAg, постоянно высокий уровень ДНК HBV (>105 копий/мл, или 20 000 МЕ).
Хронический HBE -позитивный гепатит В. Хронический гепатит, вызванный HBV-инфекцией, обусловленной «диким» типом вируса HBV, распространён в основном в Европе и Северной Америке, но также встречается в регионах с высоким уровнем носительства HBS Ag. Характеризуется постоянно повышенной активностью печёночных трансфераз и высоким уровнем виремии. В зависимости от возраста на момент инфицирования этот вариант ВГВ протекает различно. У детей, инфицированных внутриутробно или перинатально до 18–20-летнего возраста, наблюдают фазу иммунной толерантности — нормальный уровень АЛТ, отсутствие клинических признаков болезни, минимальные гистологические изменения в печени, но наличие высокого уровня репликации ДНК HBV и HBEAg-емия. По достижении совершеннолетия у части этих больных происходит спонтанный клиренс HBEAg. Иммунный клиренс HBEAg может протекать бессимптомно или сопровождаться клиническими признаками ОГВ. В дальнейшем может наступить ремиссия заболевания и переход в фазу хронической HBV-инфекции с неопределяемым уровнем HBV ДНК на фоне стойкой HBS Ag-емии. Однако у значительной части лиц, инфицированных внутриутробно или перинатально, в дальнейшем развивается HBEAg-позитивный хронический ВГВ с повышенным уровнем АЛТ в сыворотке крови, так и не наступает сероконверсия HBEAg/анти-НВЕ и формируется прогрессирующее течение гепатита с возможным исходом в цирроз печени. Если инфицирование происходит в детском возрасте, то большинство HBEAg-позитивных детей имеют повышенный уровень АЛТ в сыворотке крови, а сероконверсия HBEAg в анти-НВЕ обычно происходит в возрасте 13–16 лет. У пациентов, инфицированных в зрелом возрасте (характерно для Европы и Северной Америки), заболевание характеризуется наличием клинической симптоматики, стойко повышенной активностью АЛТ, наличием HBEAg и ДНК HBV в крови, гистологической картиной хронического гепатита. Среди пациентов всех возрастных групп с HBV-инфекцией, приобретённой в детском возрасте или во взрослом состоянии, частота спонтанной элиминации HBEAg из организма составляет от 8 до 12% в год. Частота спонтанного клиренса HBS Ag составляет 0,5–2% в год. В целом из числа больных хронической HBV-инфекцией 70–80% становятся с течением времени бессимптомными носителями, а у 20–30% больных хронической HBV-инфекцией развивается прогрессирующее заболевание печени и в течение 10–50 лет может сформироваться цирроз печени и гепатоцеллюлярная карцинома. Хронический HBE Ag-негативный гепатит В. Хронический гепатит, вызванный мутантным вариантом HBV, характеризуется наличием в крови анти-НВЕ, отсутствием HBEAg и более низкой концентраций HBV по сравнению с HBEAg-позитивным ВГВ. Хронический HBEAg-негативный ВГВ — наиболее частая форма в Южной Европе и Азии, в Северной Европе и США он встречается у 10–40% лиц с хронической HBV-инфекцией. В средиземноморском регионе заражение этим вариантом ВГВ, как правило, происходит в детстве, протекает бессимптомно в течение 3–4 десятилетий, приводя к циррозу печени в среднем к 45-летнему возрасту. Течение HBEAg-негативного хронического ВГВ характеризуется или стойко повышенной активностью АСТ и АЛТ (3–4-кратное превышение нормы), что наблюдают у 3–40% пациентов, или флюктуирующей активностью АСТ и АЛТ (45–65%) и редко встречающимися длительными спонтанными ремиссиями (6–15%) случаев. Переход HBEAg-негативного ХГВ в неактивную нерепликативную фазу вирусоносительства или самопроизвольное выздоровление почти не встречают.
Лечение. Составляющие компоненты понятия «ответ на лечение» в настоящее время определены и стандартизированы. • Биохимический ответ (подразумевается, что до лечения у больного был повышенный уровень АЛТ) — нормализация показателей АЛТ на фоне терапии. • Гистологический ответ — улучшение показателей гистологической активности на 2 балла (по шкале ИГА — индекс гистологической активности — 0–18 баллов) без ухудшения показателей фиброза или с улучшением по этому показателю при сравнении результатов биопсии печени до и после окончания лечения. • Вирусологический ответ — снижение уровня вирусной нагрузки в крови до неопределяемого уровня (зависит от чувствительности применяемого метода и тест-системы) и исчезновение HBEAg у больного с наличием HBEAG в крови до начала лечения. • Полный ответ — наличие критериев биохимического и вирусологического ответа и исчезновение HBS Ag. Также выделяют следующие понятия: ответ на лечение на фоне терапии, постоянный ответ на фоне терапии (на протяжении всего курса), ответ по окончании терапии (в конце запланированного курса лечения), устойчивый ответ после окончания терапии на шестом месяце и устойчивый ответ после окончания терапии на 12-м месяце. Лечение стандартным интерфероном рекомендуют для больных ХГВ с невысокой вирусной нагрузкой и повышенным уровнем аминотрансфераз в сыворотке крови (более 2 норм), так как при высоком уровне вирусной нагрузки и нормальных показателях АЛТ лечение малоэффективно. Лечение ламивудином: существенный недостаток терапии ламивудином — высокая вероятность развития резистентности к препарату (17–30% через 2 года) вследствие мутации вируса. Лечение может быть закончено через 6 мес после достижения сероконверсии (6 мес консолидированной терапии). Лечение проводят в дозе 100 мг ежедневно per os. Ламивудин характеризуется хорошим профилем безопасности. Энтекавир наиболее эффективно и быстро подавляет репликацию HBV в течение 48 нед лечения. Телбивудин характеризуется эффективным подавлением репликации HBV в течение 48 нед лечения.
Исходы. Благоприятный: стадия активного процесса 1-4 года, сероконверсия HBeAg в анти-HBe, «здоровое» носительство HBsAg, спонтанная элиминация HBsAg. Неблагоприятный: цирроз печени и гепатоцеллюляррная карцинома. Развитие микст-инфекции. (н-р, ВЭБ,ЦМВ).
24. Вирусные гепатиты С: этиология, эпидемиология, патогенез, клиническая картина диагностика, лечение, исходы, диспансерное наблюдение, профилактика.
Гепатит C (вирусный гепатит C, ВГС, Hepatitis С) — антропонозная инфекционная болезнь с контактным механизмом передачи возбудителя, характеризуемая лёгким или субклиническим течением острого периода болезни, частым формированием хронического гепатита C, возможным развитием цирроза печени и гепатоцеллюлярной карциномы.
Этиология. Возбудитель — вирус гепатита C (HCV). Относят к семейству Flaviviridae, имеет липидную оболочку, сферическую форму, нуклеокапсид содержит однонитевую линейную РНК. В геноме HCV выделяют две области, одна из которых кодирует структурные белки, входящие в состав вириона (нуклеокапсид, белки оболочки), другая — неструктурные (функциональные) белки, не входящие в состав вириона, но обладающие ферментативной активностью и жизненно необходимые для репликации вируса (протеазу, хеликазу, РНК-зависимую РНК-полимеразу). Изучение функциональной роли белков, кодируемых в неструктурной области генома HCV и участвующих в репликации вируса, имеет исключительную важность для создания новых ЛС, которые могли бы блокировать репликацию вируса. Установлено, что HCV циркулирует в организме человека в виде смеси мутантных штаммов, генетически отличаемых друг от друга и получивших название «квазивидов». Особенность строения генома HCV — его высокая мутационная изменчивость, способность постоянно изменять свою антигенную структуру, что позволяет вирусу избегать иммунной элиминации и длительно персистировать в организме человека. Согласно наиболее распространённой классификации, выделяют шесть генотипов и свыше ста субтипов HCV. В различных регионах Земли циркулируют разные генотипы вируса.
Эпидемиология. ВГC — антропоноз; единственный источник (резервуар) возбудителя инфекции — человек, больной острым или хроническим гепатитом. ВГC относят к инфекциям с контактным (кровоконтактным) механизмом передачи возбудителя, реализация которого происходит естественным (вертикальным — при передаче вируса от матери к ребёнку, контактным — при использовании предметов быта и при половых контактах) и искусственным (артифициальным) путями. Естественные пути заражения ВГС реализуются реже, чем при ВГВ, что связано, вероятно, с более низкой концентрацией HCV в биологических субстратах. Заражение постоянных половых партнёров-носителей HCV редко происходит половым путём. Поэтому, рекомендуя носителям HCV ставить в известность об инфекции своих половых партнёров, следует подчеркнуть, что риск передачи при половом контакте настолько мал, что некоторые специалисты считают использование презервативов необязательным. При большом числе половых партнёров вероятность заражения возрастает. Особая опасность в распространении HCV — внутривенное введение наркотических средств без соблюдения правил безопасной инъекционной практики. Группой риска также выступают пациенты, которым проводят гемодиализ, больные с онкологической и гематологической патологией и другие, получающие длительное и многократное стационарное лечение, а также медицинские работники, имеющие контакт с кровью, и доноры. Возбудитель может передаваться не только при проведении парентеральных медицинских манипуляций (инъекции, стоматологические и гинекологические манипуляции, гастро-, колоноскопия и др.), но и при нанесении татуировок, ритуальных надрезов, при проведении пирсинга, маникюра, педикюра и т.д. в случае использования загрязнённых инфицированной кровью инструментов. Естественная восприимчивость людей к HCV высока. Вероятность заражения в большой степени определяет инфицирующая доза. Выявляемые в организме инфицированного человека антитела не обладают протективными свойствами, и их обнаружение не свидетельствует о формировании иммунитета (показана возможность повторного инфицирования HCV как иным, так и гомологичным штаммом).
Патогенез. ВГC изучен недостаточно. После инфицирования HCV гематогенно попадает в гепатоциты, где преимущественно и происходит его репликация. Поражение клеток печени обусловлено прямым цитопатическим действием компонентов вируса или вирусспецифических продуктов на клеточные мембраны и структуры гепатоцита и иммунологически опосредованным (в том числе аутоиммунным) повреждением, направленным на внутриклеточные антигены HCV. Течение и исход инфекции HCV (элиминация вируса или его персистенция), определяет прежде всего эффективность иммунного ответа макроорганизма. При острой фазе инфекции уровень РНК HCV достигает высоких концентраций в сыворотке крови в течение первой недели после инфицирования. При ОГС (как у людей, так и в эксперименте) специфический клеточный иммунный ответ запаздывает как минимум на один месяц, гуморальный — на два месяца, вирус «опережает» адаптивный иммунный ответ. Развитие желтухи (следствие Т-клеточного повреждения печени) редко наблюдают при ОГC. Примерно через 8–12 нед после инфицирования, когда возникает максимальное увеличение уровня АЛТ в крови, происходит снижение титра РНК HCV. Антитела к HCV определяются несколько позже и могут вообще отсутствовать, а их появление не означает окончания инфекции. У большинства больных развивается ХГC с относительно стабильной вирусной нагрузкой, которая на 2–3 порядка ниже, чем в острой фазе инфекции. Только небольшая часть больных (около 20%) выздоравливает, РНК HCV перестает определяться при использовании стандартных диагностических тестов. Исчезновение вируса из печени и, возможно, из других органов происходит позднее, чем из крови, поскольку возврат вирусемии обнаруживают у некоторых пациентов и подопытных шимпанзе даже через 4–5 мес после того, как РНК HCV перестала определяться в крови. До сих пор неизвестно, исчезает ли вирус из организма окончательно. Почти у всех спонтанно выздоровевших от ОГC пациентов можно наблюдать сильный поликлональный специфичный ответ Т-клеток, что убедительно доказывает зависимость между длительностью и силой специфического клеточного иммунного ответа и благоприятным исходом болезни. Напротив, клеточный иммунный ответ у пациентов с хронической HCV-инфекцией обычно слабый, узкофокусный и/или непродолжительный. Факторы вируса и хозяина, обусловливающие неспособность иммунного ответа контролировать HCV-инфекцию, изучены недостаточно. Известен феномен ускользания из-под контроля иммунного ответа хозяина, который обусловлен высокой мутационной изменчивостью генома HCV, результатом чего является способность вируса к длительной (возможно, пожизненной) персистенции в организме человека. При HCV-инфекции возможно появление разнообразных внепечёночных поражений, обусловленных иммунопатологическими реакциями иммунокомпетентных клеток, которые реализуются либо иммуноклеточными (гранулёматоз, лимфомакрофагальные инфильтраты), либо иммунокомплексными реакциями (васкулиты различной локализации). Морфологические изменения в печени при ВГC неспецифичны. Наблюдают преимущественно лимфоидную инфильтрацию портальных трактов с образованием лимфоидных фолликулов, лимфоидную инфильтрацию долек, ступенчатые некрозы, стеатоз, повреждение мелких жёлчных протоков, фиброз печени, которые встречают в различной комбинации и которые определяют степень гистологической активности и стадию гепатита. Воспалительная инфильтрация при хронической HCV-инфекции имеет свои особенности: в портальных трактах и вокруг очагов повреждения и гибели гепатоцитов преобладают лимфоциты, что отражает участие иммунной системы в патогенезе поражения печени. В гепатоцитах наблюдают жировую дистрофию, при этом стеатоз печени в большей степени выражен при инфицировании генотипом 3а, по сравнению с генотипом 1. ХГC даже с невысокой степенью гистологической активности может сопровождать развитие фиброза печени. Фиброзу подвергаются не только портальные и перипортальные зоны долек, часто выявляют и перивенулярный фиброз. Тяжёлый фиброз ведёт к развитию цирроза (диффузный фиброз с образованием ложных долек), на фоне которого возможно развитие гепатоцеллюлярной карциномы. Цирроз печени развивается у 15–20% больных с выраженными воспалительными изменениями в ткани печени. В настоящее время помимо морфологического описания полученных биоптатов разработано несколько систем числовой оценки, которые позволяют проводить полуколичественное (ранговое) определение ИГА — активности воспалительно-некротического процесса в печени, а также стадии болезни, определяемой по степени выраженности фиброза (индекса фиброза). На основании этих показателей определяют прогноз заболевания, стратегию и тактику противовирусной терапии.
Клиническая картина. Инфицирование HCV приводит к развитию ОГC, в 80% случаев протекающего в безжелтушной форме без клинических проявлений, в результате чего острую фазу заболевания диагностируют редко. Инкубационный период при ОГC колеблется от 2 до 26 нед (в среднем 6–8 нед). Клинические симптомы ОГC не имеют nпринципиальных отличий от таковых при других парентеральных гепатитах. Длительность преджелтушного периода составляет от нескольких дней до 2 нед, может отсутствовать у 20% больных. В преджелтушном периоде чаще всего преобладает астеновегетативный синдром, выражающийся слабостью, быстрой утомляемостью. Часто возникают диспепсические расстройства: снижение аппетита, дискомфорт в правом подреберье, тошнота и рвота. Существенно реже бывает артралгический синдром, возможен кожный зуд. Желтушный период протекает значительно легче, чем при других парентеральных гепатитах. Ведущие симптомы острого периода — слабость, снижение аппетита и чувство дискомфорта в животе. Тошноту и зуд встречают у трети больных, головокружение и головную боль — у каждого пятого, рвоту — у каждого десятого больного. Практически у всех больных увеличена печень, у 20% — селезёнка. Для ОГC характерны такие же изменения биохимических показателей как при других парентеральных гепатитах. Нередко отмечают волнообразный характер гиперферментемии, что не сопровождается ухудшением самочувствия. В большинстве случаев уровень билирубина нормализуется к тридцатому дню после появления желтухи. ОГC протекает преимущественно в среднетяжёлой форме, у 30% больных — в лёгкой. Возможно тяжёлое течение болезни (редко), а фульминантный ОГC, приводящий к летальному исходу, встречают очень редко. При естественном течении ВГC 20–25% больных ОГC спонтанно выздоравливают, у остальных 75–80% происходит развитие ХГC. Окончательные критерии выздоровления после перенесённого ОГC не разработаны, однако о спонтанном выздоровлении можно говорить в том случае, если у пациента, не получавшего специфическую противовирусную терапию, на фоне хорошего самочувствия и нормальных размеров печени и селезёнки определяют нормальные биохимические показатели крови, а в сыворотке крови не обнаруживают РНК HCV не менее чем в течение двух лет после ОГC. Факторы, связанные со спонтанной элиминацией вируса: молодой возраст, женский пол и определённое сочетание генов главного комплекса гистосовместимости. У 70–80% лиц, перенёсших острую форму болезни, происходит формирование хронического гепатита, который выступает наиболее распространённой патологией среди хронических вирусных поражений печени. Формирование ХГC может сопровождать нормализация клинико-биохимических показателей вслед за острым периодом, однако, в последующем вновь появляется гиперферментемия и РНК HCV в сыворотке крови. Большинство больных с биохимическими признаками ХГC (70%) имеет благоприятное течение (слабовыраженную или умеренную воспалительную активность в ткани печени и минимально выраженный фиброз). Отдалённый исход у этой группы пациентов пока неизвестен. У 30% больных ХГC болезнь имеет прогрессирующее течение, у части из них происходит формирование цирроза печени, который может быть причиной смерти. Декомпенсированный цирроз печени ассоциируется с повышенной смертностью и является показанием к трансплантации печени. У 70% больных причина смерти — гепатоцеллюлярная карцинома, печёночно-клеточная недостаточность и кровотечение. Для больных ХГC риск развития гепатоцеллюлярной карциномы через 20 лет после инфицирования составляет 1–5%. В большинстве случаев гепатоцеллюлярная карцинома возникает на фоне цирроза печени с частотой 1–4% в год, 5-летняя выживаемость больных с этой формой рака составляет менее 5%. Независимые факторы риска прогрессирования фиброза: мужской пол, возраст на момент инфицирования (прогрессирование происходит быстрее у пациентов, заражённых в возрасте старше 40 лет), инфицирование другими вирусами (HBV, ВИЧ), ежедневное употребление более 40 г чистого этанола. Ещё один неблагоприятный фактор — избыточный вес, вызывающий развитие стеатоза печени, который, в свою очередь, способствует более быстрому формированию фиброза. Вероятность прогрессирования болезни не имеет связи с генотипом HCV или вирусной нагрузкой. Особенность ХГC — латентное или малосимптомное течение в продолжение многих лет, обычно без желтухи. Повышение активности АЛТ и АСТ, выявление анти-HCV и РНК HCV в сыворотке крови в течение не менее 6 мес — основные признаки ХГC. Чаще всего эту категорию больных обнаруживают случайно, при обследовании перед оперативным вмешательством, при прохождении диспансеризации и т.д. Иногда пациенты попадают в поле зрения врача только при формировании цирроза печени и при появлении признаков его декомпенсации. Хроническую HCV-инфекцию может сопровождать нормальная активность АЛТ при повторных исследованиях в течение 6–12 мес, несмотря на продолжающуюся репликацию РНК HCV. Доля таких пациентов среди всех больных с хронической инфекцией составляет 20–40%. У части из этой категории больных (15–20%) при проведении биопсии печени можно выявить серьёзные фиброзные изменения. Пункционная биопсия печени — важный диагностический метод, позволяющий выявить пациентов с прогрессирующим серьёзным поражением печени, нуждающихся в безотлагательной противовирусной терапии. Скорость прогрессирования фиброза печени у больных с нормальной активностью АЛТ, по-видимому, ниже, чем у пациентов с повышением её активности. Внепечёночные проявления ВГC встречают, по данным разных авторов, у 30–75% больных. Они могут выходить на первый план в течении болезни и определять прогноз заболевания. Течение ХГC могут сопровождать такие иммуноопосредованные внепечёночные проявления, как смешанная криоглобулинемия, красный плоский лишай, мезангиокапиллярный гломерулонефрит, поздняя кожная порфирия, ревматоидные симптомы. Установлена роль HCV в развитии В-клеточной лимфомы, идиопатической тромбоцитопении, поражения эндокринных (тиреоидит) и экзокринных желёз (прежде всего, вовлечение в патологический процесс слюнных и слёзных желёз, в том числе в рамках синдрома Шёгрена), глаз, кожи, мышц, суставов, нервной системы и др.
Исходы. Выздоровление, ХГC, Цирроз печени, Гепатоцеллюлярная карцинома.
Диагностика.
• Стандарт диагностики ОГС.
G Обязательные лабораторные исследования:
– клинический анализ крови;
– биохимический анализ крови: билирубин, АЛТ, АСТ, тимоловая проба, протромбиновый индекс;
– иммунологическое исследование: анти-HCV, HBS Ag, анти-HBC IgM, анти-ВИЧ;
– определение группы крови, резус-фактора;
– клинический анализ мочи и жёлчные пигменты (билирубин).
G Дополнительные лабораторные исследования:
– иммунологическое исследование: РНК HCV (качественный анализ), анти-дельта суммарные, анти-HAV IgM, анти-HEV IgM, ЦИК, LE-клетки;
– биохимический анализ крови: холестерин, липопротеиды, триглицериды, общий белок и белковые фракции, глюкоза, калий, натрий, хлориды, СРБ, амилаза, ЩФ, ГГТ, церулоплазмин;
– кислотно-основное состояние крови;
– коагулограмма.
G Инструментальные исследования:
– УЗИ органов брюшной полости;
– ЭКГ;
– рентгенография органов грудной клетки.
• Стандарт диагностики ХГC.
G Обязательные лабораторные исследования:
– клинический анализ крови;
– биохимический анализ крови: билирубин, АЛТ, АСТ, тимоловая проба;
– иммунологическое исследование: Анти-HCV; HBS Ag;
– клинический анализ мочи и жёлчные пигменты (билирубин).
G Дополнительные лабораторные исследования:
– биохимический анализ крови: холестерин, липопротеиды, триглицериды, общий белок и белковые фракции, глюкоза, калий, натрий, хлориды, СРБ, амилаза, ЩФ, ГГТ, церулоплазмин, железо, гормоны щитовидной железы;
– коагулограмма;
– определение группы крови, резус-фактора;
– иммунологическое исследование: РНК HCV (качественный анализ), анти-дельта суммарные, анти-HAV IgM, анти-HEV IgM, ЦИК, LE-клетки, анти-HBC IgM; анти-дельта IgM; HBEAg; анти-HBE; ДНК HBV (качественный анализ), аутоантитела, анти-ВИЧ, α-фетопротеин;
– кал на скрытую кровь.
G Инструментальная диагностика(дополнительная):
– УЗИ органов брюшной полости;
– ЭКГ;
– рентгенография органов грудной клетки;
– чреcкожная пункционная биопсия печени;
– ЭГДС.
Лечение. Режим полупостельный при лёгком и среднетяжёлом ОГC. При тяжёлом течении ОГC строгий постельный режим. При ХГC — соблюдение режима труда и отдыха, не рекомендованы работа в ночную смену и на производствах, связанных с токсическими продуктами, командировки, поднятие тяжестей и др. Диета щадящая (по кулинарной обработке и исключению раздражающих веществ), стол № 5. Этиотропная терапия. Интерферон альфа-2 по 5 млн МЕ внутримышечно ежедневно в течение 4 нед, затем по 5 млн МЕ внутримышечно трижды в неделю в течение 20 нед; интерферон альфа-2 по 10 млн МЕ внутримышечно ежедневно до нормализации уровня трансаминаз (что происходит обычно на 3–6-й неделе от начала применения препарата). Эффективна монотерапия пегилированным интерфероном альфа-2 в течение 24 нед. Базисная терапия предполагает соблюдение диеты (стол № 5), курсовое применение средств, нормализующих деятельность ЖКТ, влияющих на функциональную активность гепатоцитов (панкреатические энзимы, гепатопротекторы, жёлчегонные, средства для восстановления микрофлоры кишечника и др.). Следует также ограничивать физическую нагрузку, оказывать пациентам психоэмоциональную и социальную поддержку, лечить сопутствующие заболевания. Стандарт лечения ХГC — стандартный интерферон альфа-2, комбинация стандартного интерферона альфа-2 и рибавирина, а также комбинация пегилированного интерферона альфа-2 и рибавирина. Стандартный интерферон альфа-2 назначают в дозе 3 млн МЕ 3 раза в неделю подкожно или внутримышечно, пегилированный интерферон альфа-2a назначают в дозе 180 мкг, пегилированный интерферон альфа-2b — из расчёта 1,5 мкг/кг — 1 раз в неделю под кожу в течение 48 нед при генотипе 1 и 4, в течение 24 нед при других генотипах. Рибавирин принимают ежедневно в дозе 800–1200 мг в два приёма в зависимости от генотипа HCV и массы тела. Фиксированные комбинированные ПППД(КР 2022г): · Велпатасвир + софосбувир** (ВЕЛ+СОФ**) · Глекапревир + пибрентасвир** (ГЛЕ+ПИБ**) · Гразопревир + элбасвир** (ГРА+ЭЛБ**) · Дасабувир; омбитасвир + паритапревир + ритонавирб ** (ДСВ; ОБВ+ПТВ/р**) · Ледипасвир + софосбувир (ЛЕД+СОФ)
Профилактика. Специфическая профилактика ХВГС в настоящее время не разработана. Пациентам с ХВГС рекомендуется вакцинация против гепатита А и В для предотвращения инфицирования этими вирусами. Неспецифическая профилактика. Рекомендуется активное выявление источников инфекции (обследование лиц, подверженных повышенному риску инфицирования и/или имеющих особую эпидемиологическую значимость) для своевременного проведения ПВТ, профилактика искусственного механизма передачи (переливание крови только по жизненным показаниям, обоснованность инвазивных методов обследования, использование одноразового инструментария, строгое соблюдение режимов обработки медицинского инструментария и оборудования, использование защитных средств медработниками), ПВТ больных, инфицированных ВГС, направленная на полную эрадикацию возбудителя, для профилактики распространения инфекции.
Диспансерное наблюдение. Пациентам с ХВГС, которым отложено проведение ПВТ, рекомендуется диспансерное наблюдение один раз в год с проведением комплексного клинико-лабораторного и инструментального обследования для динамического наблюдения (пациенты с anti-HCV, у которых отсутствует РНК ВГС после проведенной ПВТ ХВГС в течение 12 недель, считаются излечившимся от ХВГС и подлежат снятию с диспансерного наблюдения.)
Вирусный гепатит А:
· болеют преимущественно дети и люди молодого возраста;
· заболевание может возникать в виде вспышек;
· максимум заболеваемости приходится на конец лета осень; обычно заболевание начинается остро;
· у большинства больных в преджелтушном периоде наблюдается кратковременная (13 дня) лихорадка без катаральных явлений;
· с момента появления желтухи состояние обычно улучшается;
· в большинстве случаев заболевание протекает легко;
· хронизация, рецидивы не характерны.
Вирусный гепатит В:
· имеются указания на перенесенные в прошлом (за 1,56 мес до данного заболевания) операции, парентеральные манипуляции;
· заболевание обычно возникает в виде единичных случаев, но следует помнить о возможности групповых заболеваний среди наркоманов, у половых партнеров;
· заболевание развивается постепенно, медленно;
· преджелтушный период чаще протекает по типу артралгического, диспептического, выраженного астено-вегетативного синдромов без лихорадки;
· с момента появления желтухи самочувствие не только не улучшается, но часто ухудшается, интоксикация может сохраняться до мочевого криза;
· в преджелтушном и желтушном периодах возможны различные аллергические проявления;
· заболевание чаще протекает в среднетяжелой форме;
· возможны затяжное течение, переход в хроническую форму, носительство.
Вирусный гепатит С:
· заболевание чаще возникает у лиц, перенесших переливание крови или ее компонентов, реципиентов органов и тканей, наркоманов, ВИЧ-инфицированных;
· начинается очень постепенно, часто без четко выраженного преджелтушного периода;
· протекает преимущественно в виде легких форм, тем не менее, в большинстве случаев дает хронизацию (эта особенность послужила основанием для того, чтобы ВГС называть “ласковый убийца”);
· на фоне “легкого течения” у больных могут выявляться значительно увеличенные печень и селезенка, не соответствующие по своим размерам и плотности ни тяжести течения, ни остроте процесса;
· HCV-инфекция иногда распознается лишь тогда, когда у больного уже сформировался цирроз печени;
· заболевание нередко протекает с периодическими ферментативными обострениями, которые обычно не распознаются клинически.
Дельта гепатит:
· группы риска те же, что ВГВ, особое внимание имеющим маркеры ВГВ; у 60% больных еще в преджелтушном периоде возникает лихорадка, сохраняющаяся и в желтушном периоде;
· часто появляются боли в правом подреберье;
· если заболевание протекает по типу коинфекции, то протекает достаточно тяжело, но заканчивается чаще полным очищением организма от возбудителя; если по типу суперинфекции то характерны обострения, рецидивы, хронизация;
· применение кортикостероидов отягощает течение заболевания.
Вирусный гепатит Е:
· особую группу риска представляют лица, посещавшие страны Азии, Африки, Южной Америки. (В 1996 году были вспышки и в Украине!);
· типичен взрывной характер эпидемий, связанных с определенными источниками водоснабжения;
· заболевают преимущественно люди молодого возраста (1518 лет);
· заболевание начинается остро, как при ВГА, но самочувствие после снижения температуры и появления желтухи не улучшается;
· у большинства больных еще в преджелтушном периоде появляется выраженный болевой синдром (боль локализуется в правом подреберье и эпигастральной области), он сохраняется и при появлении желтухи;
· вирус поражает не только гепатоциты, но и почечную ткань, поэтому гепатит нередко сочетается с гломерулонефритом;
· у беременных очень тяжелое течение с высокой летальностью (от 30 до 60%);
· наблюдается двухфазное повышение активности трансфераз, что не имеет, как правило, клинического отображения;
· кортикостероиды отягощают течение ВГЕ
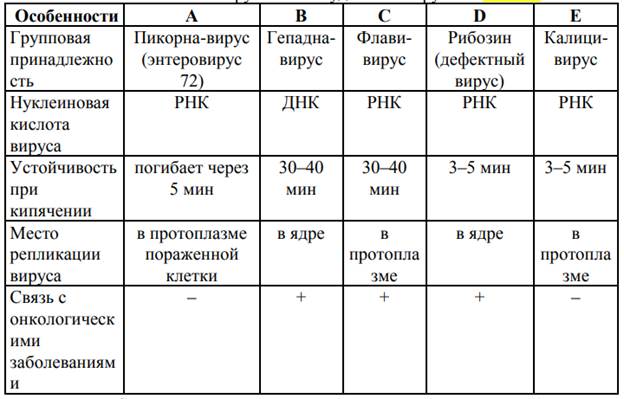
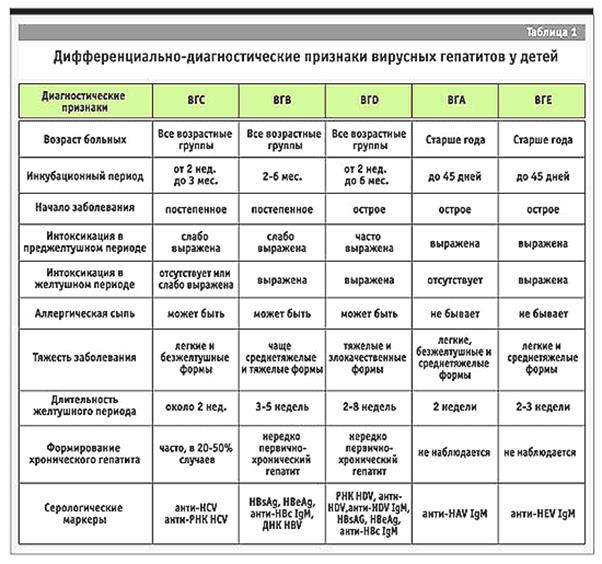
25. Вич – инфекция: этиология, эпидемиология, патогенез, клиническая картина, диагностика, лечение, профилактика.
ВИЧ-инфекция — инфекция, вызванная вирусом иммунодефицита человека (human immunodeficiency virus infection — HIV-infection). ВИЧ-инфекция — медленно прогрессирующее антропонозное заболевание с контактным путём передачи, характеризующееся поражением иммунной системы с развитием СПИДа. Клинические проявления СПИДа, приводящие к гибели инфицированного человека — оппортунистические (вторичные) инфекции, злокачественные новообразования и аутоиммунные процессы.
Этиология. Возбудитель — РНК-содержащий ретровирус (ВИЧ — вирус иммунодефицита человека). Ретровирусы содержат уникальный фермент — обратную транскриптазу (ревертазу). Обычно (например, при синтезе белка) информация считывается с ДНК на РНК. Благодаря обратной транскриптазе (ревертазе) у ВИЧ происходит считывание информации в обратном порядке (ретро) с вирусной РНК на вирусную ДНК, которая затем встраивается в хромосомную ДНК клетки-хозяина. Известно 2-а варианта ВИЧ — ВИЧ-1 (HIV-1) и ВИЧ-2 (HIV-2). Первый является более вирулентным и более распространенным на земном шаре вирусом. Второй встречается в основном в Западной Африке. Внутри вируса, кроме упомянутой ревертазы, содержатся еще 2-а важных фермента: интеграза (встраивает ДНК вируса в ДНК клетки-хозяина) и протеаза (принимает участие в синтезе вирусных протеинов и сборке вирионов). Собственная оболочка вируса образована белком р24. Наружная оболочка вируса содержит белки gp41 (трансмембранный гликопротеин) и gp120 (внешний гликопротеин). Выявление антител к указанным белкам широко используется при проведении специфической диагностики
Эпидемиология. Основной механизм передачи инфекции — контактный. Существуют естественные, способствующие сохранению ВИЧ-инфекции в природе, и искусственные пути передачи. К естественным путям передачи относят половой (при половых контактах) и вертикальный (от инфицированной матери к ребёнку в период беременности, родов или при грудном вскармливании). Искусственный (артифициальный) путь передачи — парентеральный — реализуется при проникновении вируса в кровь при различных манипуляциях, связанных с нарушением целостности слизистых оболочек и кожных покровов. К числу факторов, влияющих на вероятность инфицирования полового партнёра ВИЧ, относят титр вируса у источника инфекции; наличие у реципиента различных заболеваний; интенсивность контакта. Современная эпидемиология ВИЧ-инфекции исключает существование аэрозольного, фекально-орального и трансмиссивного механизмов передачи возбудителя. Восприимчивость человека к ВИЧ практически стопроцентная. Фактором невосприимчивости к заражению ВИЧ может быть отсутствие определённых специфических рецепторов. В настоящее время выделяют гены (CCR5, CCR2 и SDF1), контролирующие синтез молекул, участвующих в проникновении ВИЧ в клетки хозяина. Таким образом, люди, имеющие гомозиготный генотип по этим генам, устойчивы к заражению ВИЧ половым путём; лица с гетерозиготным генотипом — менее устойчивы. Было установлено, что длительно контактирующие с ВИЧ-инфицированными и не заразившиеся люди имеют мутацию в гене, отвечающем за экспрессию корецептора CCR5 на поверхности лимфоцитов (её обнаруживают только у 1% европейцев). Однако этот признак не ассоциируют с невосприимчивостью к ВИЧ при переливании крови или при внутривенном введении психоактивных веществ. ВИЧ-инфекция распространена повсеместно. В настоящее время её официально регистрируют почти во всех странах мира. Вместе с тем распространённость ВИЧ-инфекции крайне неравномерна в различных районах, разных возрастных, социальных и профессиональных группах. Наибольшее количество ВИЧ-инфицированных проживает в Центральной Африке (к югу от пустыни Сахары) и на Карибских островах. Важным показателем считают прирост числа новых случаев. В начале 80-х годов ХХ века максимальное количество случаев ВИЧ-инфекции регистрировали в Центральной Африке и в США, а к концу 2000 г. в эпидемию были вовлечены уже все континенты. В России ВИЧ-инфекцию регистрируют с 1985 г., первоначально среди иностранцев, преимущественно выходцев Вирусные инфекции из Африки, а с 1987 г. — среди граждан СССР. С 2006 г. ВИЧ-инфекцию обнаруживают и регистрируют во всех субъектах РФ. До середины 90-х годов в РФ основным путём передачи ВИЧ считали половой. Это определяло своеобразие эпидемического процесса инфекции. Со второй половины 1996 г. произошла смена ведущего пути передачи инфекции. Первое место заняло «инъекционное» заражение, как правило, среди наркоманов, практикующих парентеральное введение психоактивных веществ. В последние годы увеличивается значимость гетеросексуального пути передачи ВИЧ-инфекции. Об этом свидетельствует не только увеличение количества инфицированных (основной фактор риска для которых — гетеросексуальные контакты), но и рост доли инфицированных женщин. Вследствие этого повышается вероятность передачи ВИЧ-инфекции от матери к ребёнку.
Патогенез. Вирус попадает в организм человека парентеральным, половым или вертикальным путями. Клетками-мишенями чаще являются структуры, содержащие на своей поверхности молекулы CD4 — рецепторы для вирусной детерминанты gp120. К этим структурам прежде всего относятся Т-лимфоциты-хелперы (Т4- лимфоциты), а также моноциты/макрофаги, эпидермальные клетки Лангерганса, дендритные клетки лимфатических узлов и некоторые клетки ЦНС. Наиболее принципиальным звеном в патогенезе ВИЧ-инфекции является массовая гибель Т4- лимфоцитов, приводящая к иммуннодефицитным состояниям и, как следствие, к развитию оппортунистических инфекций, обусловленных условно-патогенной микрофлорой, и злокачественных новообразований. При ВИЧ-инфекции поражается также и гуморальное звено иммунитета. Антитела начинают появляться (так называемая сероконверсия) в пределах 1-3 месяцев после инфицирования. Но они неполноценные и не могут освободить организм человека от вирусов, хотя способны значительно снизить его концентрацию в организме. Наиболее высокие концентрации вируса в организме человека регистрируются в первые 3 месяца после инфицирования (пока еще не произошла сероконверсия) и в терминальном периоде ВИЧ-инфекции.
Клиника. Продолжительность инкубационного периода ВИЧ-инфекции составляет от 2 нед до 6 мес и более. Стадия первичных клинических проявлений начинается с периода сероконверсии (иногда в самом начале диагностируют острую лихорадочную фазу). Следует отметить, что стадия II нередко предшествует наступлению сероконверсии. Клинические признаки острой фазы (часто имеют неспецифический характер) — выраженная интоксикация, слабость, лихорадка, боли в мышцах и суставах, катаральные явления (иногда в сочетании с сыпью на коже) со стороны верхних дыхательных путей, тонзиллит, полиаденит. Возможны преходящие нарушения деятельности ЦНС (от головных болей до острой обратимой энцефалопатии с потерей ориентации, памяти и нарушениями сознания). В сыворотке крови обнаруживают антитела к ВИЧ (не постоянно). Нередко антитела к вирусу выявляют в конце острой фазы. Острая фаза развивается не у всех ВИЧ-инфицированных пациентов, а вследствие трудности её диагностики число таких случаев оценить сложно. Манифестное течение острой сероконверсии при ВИЧ-инфекции — неблагоприятный признак быстрого прогрессирования заболевания. Продолжительность данного лихорадочного состояния — от 1–2 нед до 1 мес. Субклиническая стадия III наступает либо сразу после острой лихорадочной фазы, либо начинает стадию первичных проявлений. Данный период характеризуют положительные серологические реакции на ВИЧ-инфекцию при проведении ИФА и ИБ при отсутствии клинических признаков заболевания. Длительность субклинической фазы варьирует от 2–3 мес до нескольких лет (чаще всего — до 1,5–2 лет). В бессимптомную стадию возможно развитие персистирующей генерализованной лимфаденопатии (в среднем, продолжительность инфекционного процесса составляет от 6 мес до 5 лет). В данный период единственный клинический симптом заболевания — генерализованная лимфаденопатия — увеличение лимфатических узлов (не менее 1 см в диаметре) в двух или более несоприкасающихся внепаховых локусах, сохраняющее свой объём в течение по меньшей мере 3 мес при отсутствии какого-либо текущего заболевания. Помимо генерализованной лимфаденопатии наблюдают увеличение печени, селезёнки; астенический синдром. Стадию вторичных заболеваний характеризуют развивающиеся на фоне иммунодефицита бактериальные, вирусные, грибковые, протозойные инфекии или опухолевые процессы. Стадию IVА рассматривают как переходный период от персистирующей генерализованной лимфаденопатии к СПИД-ассоциированному комплексу. При этом длительность инфекционного процесса составляет 3–7 лет и более. Отмечают более выраженный астенический синдром, снижение умственной и физической работоспособности, ночную потливость, периодические подъёмы температуры до субфебрильных цифр, неустойчивый стул, потерю массы тела менее 10%. Данная стадия заболевания протекает без выраженных оппортунистических инфекций и инвазий, а также без развития саркомы Капоши и других злокачественных опухолей. Возможны различные заболевания кожи (иногда это обострившиеся прежние, но чаще — приобретённые), обусловленные грибковым, вирусным, бактериальным или другим поражением — себорейный или аллергический дерматит, псориаз, папулёзная сыпь. Грибковое поражение кожи приводит к развитию онихомикоза, дерматомикоза стоп (кистей, голеней и других участков тела). Вирусные поражения — простой герпес, опоясывающий лишай, остроконечные кондиломы, контагиозный моллюск, бородавки. Стафилококковые и стрептококковые фолликулиты, импетиго и эктима — признаки бактериальных инфекций. На слизистых оболочках обнаруживают афтозные изъязвления; развивается ангулярный хейлит, гингивит. Нередко развиваются рецидивирующие инфекции верхних дыхательных путей (включая бактериальные синуситы). Признаки прогрессирования заболевания (стадия IVБ) — общие симптомы СПИДа без генерализации оппортунистических инфекций или опухолей, возникающие в более поздние стадии заболевания. Характерны необъяснимые длительная лихорадка перемежающегося или постоянного типа и хроническая диарея (длительность симптомов — всегда больше месяца), потеря более 10% массы тела. Могут иметь место поражения кожи и слизистых оболочек грибковой (орофарингеальный кандидоз, реже — генитальной и перианальной областей), вирусной (волосатая лейкоплакия, повторное или диссеминированное инфицирование вирусом простого герпеса (ВПГ) 3-го типа — Varicella Zoster), сосудистой (телеангиэктазии, геморрагические высыпания, лейкопластический васкулит, гиперальгезивный псевдотромбофлебитический синдром) и опухолевой (локализованная форма саркомы Капоши) этиологии. При бактериальных поражениях кожи и слизистых оболочек возможно развитие вегетирующей, шанкриформной и диффузной форм хронического пиодермита; целлюлита; пиомиозита; пиогенных гранулём; фурункулов и абсцессов. Выявляют бактериальные (в том числе лёгочный туберкулёз), вирусные, грибковые и протозойные поражения внутренних органов (без диссеминации). У пациентов наблюдают тенденцию к анемии, тромбоцитопении и лейкопении, обусловленную, главным образом, лимфопенией и, лишь в незначительной степени, нейтропенией. Вирус активно размножается и оказывает супрессорное воздействие на иммунную систему; нарастают признаки иммунодефицита. Определяют уменьшение количества CD4+-лимфоцитов до 200–300 клеток в 1 мкл, CD8+- лимфоцитов — до 1300 клеток в 1 мкл; при этом отношение количества CD4+- к числу CD8+-лимфоцитов снижается до 0,5. При уменьшении количества CD4+- лимфоцитов у взрослых, страдающих ВИЧ-инфекцией, до 200 клеток в 1 мкл, рекомендуют начинать интенсивную лекарственную профилактику оппортунистических инфекций. Стадия IVВ соответствует развёрнутому СПИДу. Как правило, симптомы данной фазы обнаруживают при длительно текущем инфекционном процессе (более 5 лет). Нарастающий иммунодефицит приводит к развитию двух основных клинических проявлений СПИДа (оппортунистические инфекции, вызванные условно-патогенной флорой, и новообразования). Любые патогенные микроорганизмы могут вызывать необычно тяжёлые клинические состояния. Этиологию вторичных заболеваний, осложняющих IV стадию ВИЧ-инфекции, во многом определяют бытовые, климатические и природные условия проживания ВИЧ-инфицированного пациента. Диагноз развёрнутого СПИДа может быть поставлен на основании выраженных признаков энцефалопатии или кахексии — результата непосредственного действия вируса на ЦНС и органы пищеварительной системы. К таким признакам относят значительную непроизвольную потерю массы тела (более 10% от первоначальной); наличие хронической диареи и лихорадки (интермиттирующей или постоянной) на протяжении месяца и более; а также хроническую слабость. При этом оппортунистические инфекции или новообразования нередко отсутствуют. В период развёрнутого СПИДа развивается тромбоцитопения и глубокая иммуносупрессия. Количество Т-лимфоцитов составляет менее 700–800 клеток в 1 мкл, CD4+-лимфоцитов — менее 200 клеток в 1 мкл; происходит резкое уменьшение числа CD8+-лимфоцитов до 400–500 клеток в 1 мкл. Отношение количества CD4+- к числу CD8+-лимфоцитов не превышает 0,3. При уменьшении количества CD4+-лимфоцитов до 50 клеток в 1 мкл возрастает вероятность летального исхода. Развивается несостоятельность системы гуморального иммунитета. Болезнь прогрессирует, наступает терминальная V стадия, заканчивающаяся смертью больного.
Диагностика. Чаще всего антитела к ВИЧ обнаруживают с помощью иммуноферментных методов (ИФА). Однако при использовании этого метода нередко встречаются ложноположительные реакции. В связи с этим предложен и используется ряд методов для проверки специфичности результатов обнаружения антител. Для этого наиболее часто применяют реакцию “иммунный блотинг” в модификации Western Blot. Этот метод выявляет не комплексные антитела к ВИЧ, а антитела к отдельным его структурным белкам (p24, gp120, gp41 и др.). Естественно, что обнаружение антител сразу к двум или нескольким структурным белкам вируса делает диагноз ВИЧ-инфекции практически безапелляционным. Однако использование иммунного блотинга лимитирует его высокая стоимость. Значительно реже с целью диагностики используют методы выявления вируса и его антигенов. К таким реакциям относится полимеразная цепная реакция (ПЦР) и реакция обнаружения белка р24. С помощью этих реакции возможна постановка диагноза еще до сероконверсии (в первые 3-и недели после инфицирования).
Лечение. В настоящее время широко используются следующие группы антиретровирусных препаратов: · ингибиторы обратной транскриптазы (ревертазы) — азидотимидин, зидовудин, диданозин, зальцитабин, ставудин, ламивудин · ингибиторы протеазы — саквинавир, ритонавир, индинавир (криксиван) Большинство исследователей отмечают, что эра монотерапии ВИЧ-инфекции в связи с развитием резистентности вирусов вследствие их мутации закончилась. Рекомендовано проводить комплексную терапию различными комбинациями препаратов. Наиболее эффективной считается комбинация азитотимидина, ламивудина и индинавира. Значительная роль в терапии ВИЧ-инфицированных принадлежит лечению оппортунистических инфекций, которое проводится с учетом возбудителя антибактериальными, антигрибковыми, антипротозойными и антивирусными препаратами.
Профилактика. Неспецифическая профилактика заключается в предотвращении половой и перинатальной передачи ВИЧ; в контроле переливаемых компонентов крови и её препаратов, а также в предупреждении передачи инфекции при проведении медицинских манипуляций. Большое значение имеет также оказание специфической специализированной медицинской помощи.
26. Чума: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
ЧУМА (pestis) — острая зоонозная (антропозоонозная ?) природно-очаговая инфекционная болезнь с преимущественно трансмиссивным механизмом передачи возбудителя, которая характеризуется интоксикацией, поражением лимфатических узлов, кожи и лёгких. Её относят к особо опасным, конвенционным болезням. На земном шаре сохраняется ряд природных очагов, где чума постоянно встречается у небольшого процента обитающих там грызунов. Эпидемии чумы среди людей часто были обусловлены миграцией крыс, заражающихся в природных очагах. От грызунов к человеку микробы передаются через блох, которые при массовой гибели животных меняют хозяина. Кроме того, возможен путь заражения при обработке охотниками шкур убитых зараженных животных. Принципиально иным является заражение от человека к человеку, осуществляемое воздушно-капельным путем.
Этиология. Возбудитель — грамотрицательная мелкая полиморфная неподвижная палочка Yersinia pestis семейства Enterobacteriaceae рода Yersinia. Имеет слизистую капсулу, спор не образует. Факультативный анаэроб. Окрашивается биполярно анилиновыми красителями (более интенсивно по краям). Выделяют крысиную, сурчиную, сусликовую, полёвочную и песчаночную разновидности чумной бактерии. Yersinia pestis имеет более 20 антигенов, в том числе термолабильный капсульный, который защищает возбудителя от фагоцитоза полиморфно-ядерными лейкоцитами, термостабильный соматический, к которому относятся V- и W-антигены, которые предохраняют микроб от лизиса в цитоплазме мононуклеаров, обеспечивая внутриклеточное размножение, ЛПС и т.д. Факторы патогенности возбудителя — экзо- и эндотоксин, а также ферменты агрессии: коагулаза, фибринолизин и пестицины. Микроб отличается устойчивостью в окружающей среде: в почве сохраняется до 7 мес; в трупах, погребённых в земле, до года; в гное бубона — до 20–40 дней; на предметах бытовой обстановки, в воде — до 30–90 дней; хорошо переносит замораживание, хорошо сохраняется в мокроте, но при температуре 55 "С погибает в течение 10—15 мин, а при кипячении — практически немедленно.
Эпидемиология. Основным резервуаром инфекции являются грызуны (суслики, сурки, песчанки, хомяки, полевки, крысы), больной человек также является источником инфекции. Заражение чумой происходит несколькими путями: трансмиссивным — через укусы инфицированных блох, контактным — при снятии шкурок инфицированных промысловых грызунов и разделке мяса зараженных животных; алиментарным — при употреблении в пищу продуктов, обсемененных бактериями; аэрогенным — от больных легочной формой чумы. Восприимчивость людей к чуме высокая. Индекс контагиозности приближается к единице. Иммунитет после перенесенного заболевания стойкий. Заболеваемости людей предшествуют эпизоотии среди грызунов. Сезонность заболевания зависит от климатической зоны и в странах с умеренным климатом регистрируется с мая по сентябрь.
Патогенез. В организм человека возбудитель чумы проникает через кожу, дыхательные пути, желудочно-кишечный тракт. Входные ворота в большой степени определяют развитие той или иной клинической формы чумы. При проникновении через кожу первичный аффект в месте внедрения, как правило, отсутствует. С током лимфы чумные бактерии заносятся в ближайшие регионарные лимфатические узлы, где происходит их размножение. Возбудители фагоцитируются нейтрофилами и мононуклеарными клетками. Но фагоцитоз оказывается незавершенным, что затрудняет запуск иммунного процесса. В лимфатических узлах развивается серозно-геморрагическое воспаление с образованием бубона. Утрата лимфатическим узлом барьерной функции приводит к генерализации процесса. Бактерии гематогенно разносятся в другие лимфатические узлы, внутренние органы, вызывая воспаление (вторичные бубоны и гематогенные очаги). Размножение иерсиний во вторичных очагах инфекции приводит к развитию септических форм чумы, для которых характерно развитие инфекционно-токсического шока и образование септикопиемических очагов в различных внутренних органах. Гематогенный занос чумных бактерий в легочную ткань приводит к развитию вторичной чумной пневмонии с образованием обильного серозно-геморрагического экссудата, содержащего огромное количество иерсиний. Септическая форма чумы сопровождается экхимозами и кровоизлияниями в кожу, слизистые и серозные оболочки, стенки крупных и средних сосудов. Типичны тяжелые дистрофические изменения сердца, печени, селезенки, почек и других внутренних органов.
Клиника. Инкубационный период длится от нескольких часов до 9 дней и более (в среднем 2–4 дня), сокращаясь при первичной лёгочной форме и удлиняясь у привитых или получавших профилактические препараты. Различают локализованные (кожную, бубонную, кожно-бубонную) и генерализованные формы чумы: первично-септическую, первично-лёгочную, вторично-септическую, вторично-лёгочную и кишечную. Основные симптомы и динамика их развития Независимо от формы болезни чума обычно начинается внезапно, и клиническая картина с первых дней болезни характеризуется выраженным синдромом интоксикации: ознобом, высокой лихорадкой (≥39 °С), резкой слабостью, головной болью, ломотой в теле, жаждой, тошнотой, иногда рвотой. Кожа горячая, сухая, лицо красное одутловатое, склеры инъецированы, конъюнктивы и слизистые оболочки ротоглотки гиперемированы, нередко с точечными кровоизлияниями, язык сухой, утолщённый, покрыт толстым белым налётом («меловой»). В дальнейшем в тяжёлых случаях лицо становится осунувшимся, с цианотичным оттенком, тёмными кругами под глазами. Черты лица заостряются, появляется выражение страдания и ужаса («маска чумы»). По мере развития болезни нарушается сознание, могут развиться галлюцинации, бред, возбуждение. Речь становится невнятной; нарушается координация движений. Внешний вид и поведение больных напоминают состояние алкогольного опьянения. Характерны артериальная гипотензия, тахикардия, одышка, цианоз. При тяжёлом течении болезни возможны кровотечение, рвота с примесью крови. Печень и селезёнка увеличены. Отмечают олигурию. Температура остаётся постоянно высокой течение 3–10 дней. В периферической крови — нейтрофильный лейкоцитоз со сдвигом формулы влево. Помимо описанных общих проявлений чумы, развиваются поражения, характерные для отдельных клинических форм болезни. Кожная форма встречается редко (3–5%). На месте входных ворот инфекции появляется пятно, затем папула, везикула (фликтена), заполненная серозно-геморрагическим содержимым, окружённая инфильтрированной зоной с гиперемией и отёком. Фликтена отличается резкой болезненностью. При вскрытии её образуется язва с тёмным струпом на дне. Чумная язва отличается длительным течением, заживает медленно, образуя рубец. Если эта форма осложняется септицемией, возникают вторичные пустулы и язвы. Возможно развитие регионарного бубона (кожно-бубонная форма). Бубонная форма встречается чаще всего (около 80%) и отличается относительной доброкачественностью течения. С первых дней болезни в области регионарных лимфатических узлов появляется резкая болезненность, что затрудняет движения и заставляет больного принимать вынужденное положение. Первичный бубон, как правило, бывает одиночным, реже наблюдаются множественные бубоны. В большинстве случаев поражаются паховые и бедренные, несколько реже подмышечные и шейные лимфатические узлы. Размеры бубона варьируют от грецкого ореха до яблока средних размеров. Яркие особенности — резкая болезненность, плотная консистенция, спаянность с подлежащими тканями, сглаженность контуров из-за развития периаденита. Бубон начинает формироваться на второй день болезни. По мере развития кожа над ним краснеет, блестит, часто имеет цианотичный оттенок. В начале он плотный, затем происходит его размягчение, появляется флюктуация, контуры становятся нечёткими. На 10–12-й день болезни он вскрывается — образуется свищ, изъязвление. При доброкачественном течении болезни и современной антибиотикотерапии наблюдают его рассасывание или склерозирование. В результате гематогенного заноса возбудителя могут формироваться вторичные бубоны, которые появляются позже и отличаются незначительными размерами, меньшей болезненностью и, как правило, не нагнаиваются. Грозным осложнением этой формы может быть развитие вторичной лёгочной или вторичной септической формы, что резко ухудшает состояние больного, вплоть до летального исхода. Первично-лёгочная форма встречается редко, в периоды эпидемий в 5–10% случаев и представляет собой наиболее опасную в эпидемиологическом отношении и тяжёлую клиническую форму болезни. Начинается она остро, бурно. На фоне резко выраженного интоксикационного синдрома с первых дней появляются сухой кашель, сильная одышка, режущие боли в груди. Кашель затем становится продуктивным, с выделением мокроты, количество которой может варьировать от нескольких плевков до огромных количеств, она редко отсутствует вообще. Мокрота, вначале пенистая, стекловидная, прозрачная, затем приобретает кровянистый вид, позже становится чисто кровавой, содержит огромное количество чумных бактерий. Обычно она бывает жидкой консистенции — один из диагностических признаков. Физикальные данные скудные: небольшое укорочение перкуторного звука над поражённой долей, при аускультации необильные мелкопузырчатые хрипы, что явно не соответствует общему тяжёлому состоянию больного. Терминальный период характеризуется нарастанием одышки, цианоза, развитием сопора, отёка лёгких и ИТШ. АД падает, пульс учащается и становится нитевидным, тоны сердца глухими, гипертермия сменяется гипотермией. В отсутствие лечения заболевание в течение 2–6 сут заканчивается летально. При раннем применении антибиотиков течение болезни доброкачественное, мало отличается от пневмонии другой этиологии, вследствие чего возможны позднее распознавание лёгочной формы чумы и случаи заболевания в окружении больного. Первично-септическая форма бывает редко — при попадании в организм массивной дозы возбудителя, чаще воздушно-капельным путём. Начинается она внезапно, с выраженных явлений интоксикации и последующего быстрого развития клинических симптомов: множественных кровоизлияний на коже и слизистых оболочках, кровотечений из внутренних органов («чёрная чума», «чёрная смерть»), психических нарушений. Прогрессируют признаки сердечно-сосудистой недостаточности. Смерть больного наступает через несколько часов от ИТШ. Изменения в месте внедрения возбудителя и в регионарных лимфатических узлах отсутствуют. Вторично-септическая форма осложняет другие клинические формы инфекции, обычно бубонную. Генерализация процесса значительно ухудшает общее состояние больного и увеличивает его эпидемиологическую опасность для окружающих. Симптомы аналогичны вышеописанной клинической картине, но отличаются наличием вторичных бубонов и более длительным течением. При этой форме болезни нередко развивается вторичный чумной менингит. Вторично-лёгочная форма как осложнение встречается при локализованных формах чумы в 5–10% случаев и резко ухудшает общую картину заболевания. Объективно это выражается нарастанием симптомов интоксикации, появлением болей в груди, кашля с последующим выделением кровавой мокроты. Физикальные данные позволяют диагностировать лобулярную, реже псевдолобарную пневмонию. Течение болезни при лечении может быть доброкачественным, с медленным выздоровлением. Присоединение пневмонии к малозаразным формам чумы делает больных наиболее опасными в эпидемиологическом отношении, поэтому каждый такой пациент должен быть выявлен и изолирован. Некоторые авторы выделяют отдельно кишечную форму, но большинство клиницистов склонны рассматривать кишечную симптоматику (резкие боли в животе, обильный слизисто-кровянистый стул, кровавую рвоту) как проявления первично- или вторично-септической формы. При повторных случаях заболевания, а также при чуме у привитых или получивших химиопрофилактику людей все симптомы начинаются и развиваются постепенно и переносятся легче. В практике такие состояния получили названия «малой», или «амбулаторной», чумы.
Осложнения. Выделяют специфические осложнения: ИТШ, сердечно-лёгочную недостаточность, менингит, тромбогеморрагический синдром, которые и приводят к смерти больных, и неспецифические, вызванные эндогенной флорой (флегмона, рожа, фарингит и др.), что нередко наблюдают на фоне улучшения состояния.
Диагностика. Важнейшую роль в диагностике в современных условиях играет эпидемиологический анамнез. Приезд из зон, эндемичных по чуме (Вьетнам, Бирма, Боливия, Эквадор, Туркмения, Каракалпакская АССР и др.), или с противочумных станций больного с описанными выше признаками бубонной формы или с признаками тяжелейшей — с геморрагиями и кровавой мокротой — пневмонии при выраженной лимфаденопатии является серьезным аргументом для принятия всех мер локализации предполагаемой чумы и точной ее диагностики. В условиях современной медикаментозной профилактики вероятность заболевания персонала, который какое-то время контактировал с кашляющим больным чумой, весьма мала. В настоящее время случаев первичной легочной чумы (т. е. случаев заражения от человека к человеку) среди медицинского персонала не наблюдается. Установление точного диагноза необходимо осуществить с помощью бактериологических исследований. Материалом для них является пунктат нагноившегося лимфатического узла, мокрота, кровь больного, отделяемое свищей и язв. Лабораторная диагностика осуществляется с помощью флюоресцентной специфической антисыворотки, которой окрашивают мазки отделяемого язв, пунктата лимфатических узлов, культуры, полученной на кровяном агаре. Диагноз можно подтвердить серологическими исследованиями парных сывороток в РПГА, однако этот метод имеет второстепенное диагностическое значение. Изучают патологоанатомические изменения у заражённых внутрибрюшинно мышей, морских свинок через 3–7 дней, с посевом биологического материала. Аналогичные методы лабораторного выделения и идентификации возбудителя применяют для выявления эпизоотий чумы в природе. Для исследования берут материалы от грызунов и их трупов, а также блох.
Лечение. Режим постельный в течение лихорадочного периода. Специальная диета не предусмотрена. Целесообразно щадящее питание (стол А). Этиотропную терапию необходимо начинать при подозрении на чуму, не дожидаясь бактериологического подтверждения диагноза. Она включает в себя применение антибактериальных препаратов. При изучении природных штаммов чумной бактерии на территории России не обнаружено резистентности к распространённым антимикробным  препаратам. Этиотропное лечение проводят по утверждённым схемам
препаратам. Этиотропное лечение проводят по утверждённым схемам
 При интоксикации в/в вводят солевые растворы, гемодез. Падение артериального давления при бубонной форме само по себе должно расцениваться как признак генерализации процесса, признак сепсиса; при этом возникает необходимость проведения реанимационных мероприятий, введения допамина, установления постоянного катетера. С большим успехом используется в лечении чумы и бисептол. При легочной, септической форме, развитии геморрагии немедленно приступают к купированию синдрома диссеминированного внутрисосудистого свертывания: проводят плазмаферез (прерывистый плазмаферез в пластикатных мешках может быть осуществлен на любой центрифуге со специальным или воздушным охлаждением при емкости ее стаканов 0,5 л и более) в объеме удаляемой плазмы 1—1,5 л при замещении таким же количеством свежезамороженной плазмы. При наличии геморрагического синдрома ежесуточные введения свежезамороженной плазмы не должны быть менее 2 л. До купированая острейших проявлений сепсиса плазмаферез проводят ежедневно. Исчезновение признаков геморрагического синдрома, стабилизация артериального давления обычно при сепсисе являются основаниями для прекращения сеансов плазмафереза. Вместе с тем эффект плазмафереза в остром периоде болезни наблюдается практически немедленно, уменьшаются признаки интоксикации, снижается потребность в допамине для стабилизации артериального давления, стихают мышечные боли, уменьшается одышка.
При интоксикации в/в вводят солевые растворы, гемодез. Падение артериального давления при бубонной форме само по себе должно расцениваться как признак генерализации процесса, признак сепсиса; при этом возникает необходимость проведения реанимационных мероприятий, введения допамина, установления постоянного катетера. С большим успехом используется в лечении чумы и бисептол. При легочной, септической форме, развитии геморрагии немедленно приступают к купированию синдрома диссеминированного внутрисосудистого свертывания: проводят плазмаферез (прерывистый плазмаферез в пластикатных мешках может быть осуществлен на любой центрифуге со специальным или воздушным охлаждением при емкости ее стаканов 0,5 л и более) в объеме удаляемой плазмы 1—1,5 л при замещении таким же количеством свежезамороженной плазмы. При наличии геморрагического синдрома ежесуточные введения свежезамороженной плазмы не должны быть менее 2 л. До купированая острейших проявлений сепсиса плазмаферез проводят ежедневно. Исчезновение признаков геморрагического синдрома, стабилизация артериального давления обычно при сепсисе являются основаниями для прекращения сеансов плазмафереза. Вместе с тем эффект плазмафереза в остром периоде болезни наблюдается практически немедленно, уменьшаются признаки интоксикации, снижается потребность в допамине для стабилизации артериального давления, стихают мышечные боли, уменьшается одышка.
Профилактика. Неспецифические • Эпидемиологический надзор за природными очагами чумы. • Сокращение численности грызунов, проведение дератизации и дезинсекции. • Постоянное наблюдение за населением, находящимся в зоне риска заражения. • Подготовка медицинских учреждений и медицинского персонала к работе с больными чумой, проведение информационно-разъяснительной работы среди населения. • Предупреждение завоза возбудителя из других стран. Меры, которые необходимо принять, изложены в «Международных медико-санитарных правилах» и «Правилах по санитарной охране территории». Специфические. Специфическая профилактика заключается в ежегодной иммунизации живой противочумной вакциной лиц, проживающих в эпизоотологических очагах или выезжающих туда. Людям, соприкасающимся с больными чумой, их вещами, трупами животных, проводят экстренную химиопрофилактику.
27. Сибирская язва: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Сибирская язва (злокачественный карбункул, Anthrax, Pustula Maligna, болезнь тряпичников, болезнь сортировщиков шерсти) — острая сапрозоонозная инфекционная болезнь с преимущественно контактным механизмом передачи возбудителя. Чаще всего протекает в доброкачественной кожной форме, реже — в генерализованной. Относят к опасным инфекциям. Возбудитель сибирской язвы рассматривают в качестве биологического оружия массового поражения (биотерроризм). У человека протекает в виде кожной, легочной, кишечной и септической форм.
Этиология. Возбудитель — крупная грамположительная неподвижная палочка Bacillus anthracis рода Bacillus семейства Bacillaceae, аэроб или факультативный анаэроб. Растёт на простых питательных средах, при доступе свободного кислорода образует споры. При благоприятных условиях (попадание в живой организм) образует вегетативную форму. Возбудитель содержит два капсульных полипептидных и один соматический полисахаридный антигены. Вырабатывает экзотоксин, состоящий из белка и липопротеида, включает протективный антиген. Он взаимодействует с мембранами клеток и опосредует действие других компонентов: летального фактора, обладающего цитотоксическим действием и вызывающего отёк лёгких, и отёчного фактора, вызывающего повышение концентрации цАМФ и развитие тканевого отёка. Компоненты токсина вызывают токсический эффект только при совместном действии. Патогенность B. anthracis зависит от наличия капсулы и токсинообразования. Штаммы, не обладающие этими способностями, авирулентны. Капсула играет важную роль в начале инфекционного процесса, препятствуя фагоцитозу возбудителя. Токсин опосредует основные клинические проявления болезни. Вегетативные формы микроба малоустойчивы, при кипячении гибнут мгновенно, дезинфицирующие растворы убивают их через несколько минут. В невскрытых трупах возбудитель сохраняется в течение 7 сут. Споры образуются после гибели хозяина, они чрезвычайно устойчивы, выдерживают кипячение до 30 мин, сохраняются при быстром высушивании, замораживании. Дезинфицирующие средства (1% раствор формалина, 10% раствор едкого натрия) убивают их за 2 ч. В почве они способны сохраняться на протяжении нескольких десятилетий (до 60 лет) и прорастать как при попадании в живой организм, так и в почве при наличии благоприятных условий.
Эпидемиология. Резервуар инфекции — почва, в которой вследствие повторения биологических циклов (спора–вегетативная клетка) возбудитель длительно сохраняется и накапливается. Такая особенность B. anthracis способствует созданию долговременно активных почвенных очагов («проклятые» поля) и потенциально опасных территорий. Это приводит к периодическим эпизоотиям и случаям сибирской язвы у людей. Болезнь развивается при попадании в организм вегетативных клеток или спор возбудителя. Источники B. anthracis для человека — крупный (буйволы, коровы) и мелкий (козы, овцы) рогатый скот, лошади, верблюды, а также (в редких случаях) дикие животные (зайцы, волки, медведи, песцы и др.). Больные животные выделяют возбудитель с мочой, калом и другими выделениями. Заболеваемость людей зависит от степени распространения этой инфекции среди животных. Механизмы передачи возбудителя к человеку — контактный (при нарушении правил личной гигиены при уходе за больными животными, забое и разделке туш, снятии шкур, контакте с шерстью, шкурой и другими продуктами животноводства, контаминированными B. anthracis), аспирационный (воздушно-пылевым путём при вдыхании инфицированной пыли, костной муки), фекально-оральный (пищевой путь при употреблении мяса заражённого животного) и трансмиссивный (через укусы слепней, мух-жигалок, комаров). Факторы передачи — почва, вода, воздух, пища, предметы быта, животные и продукты их жизнедеятельности, эктопаразиты. Различают три типа заболеваемости сибирской язвой: профессионально-сельскохозяйственный, профессионально-индустриальный и бытовой. Профессионально-сельскохозяйственную заболеваемость в странах с умеренным климатом регистрируют преимущественно в животноводческих регионах в период с мая по октябрь. Вероятность возникновения заболевания зависит от дозы возбудителя, способа заражения и факторов резистентности макроорганизма. При контактном механизме передачи человек маловосприимчив к возбудителю и заражение возможно только при нарушении целостности кожи и слизистых оболочек. При воздушно-пылевом и алиментарном путях заражения восприимчивость составляет практически 100%. Больные люди не представляют опасности для окружающих. Иммунитет у переболевших нестойкий, известны случаи повторных заболеваний.
Патогенез. Заражение происходит при попадании как вегетативной формы, так и спор возбудителя в организм человека, где они благодаря капсуле защищены от фагоцитоза и продуцируют экзотоксин, вызывающий повреждение эндотелия сосудов. Микроциркуляторные нарушения и повышение проницаемости сосудов — важное звено патогенеза сибирской язвы. В результате этих изменений в местах размножения возбудителя (кожа, лимфатические узлы, лёгкие, кишечная стенка) развиваются серозно-геморрагическое воспаление, периваскулярные кровоизлияния, геморрагические инфильтраты, резкий отёк. При заражении аэрозольным и алиментарным путями возбудитель легко преодолевает лимфатический барьер, распространяется гематогенно. Инфекция принимает генерализованный характер с массивным обсеменением органов (септицемия), сопровождаясь развитием ИТШ, тромбогеморрагического синдрома и полиорганной недостаточности. При перкутанном заражении генерализацию инфекции наблюдают редко. Воспаление ограничивается кожей, носит локальный характер, однако токсины вызывают повышенную проницаемость сосудов с развитием обширного отёка и местной анестезией.
Клиника. Инкубационный период зависит от пути проникновения и инфицирующей дозы возбудителя. Выделяют кожную (наружную, локализованную) и генерализованную (внутреннюю, висцеральную, септическую) формы сибирской язвы. Генерализованные формы могут быть первичными (карбункул отсутствует) и вторичными (при наличии карбункула). Кожная форма подразделяется на карбункулёзный, эдематозный, буллёзный, рожистоподобный и глазной варианты, а генерализованная форма — на лёгочный, кишечный и септический варианты. Наиболее часто (95–98% всех случаев сибирской язвы) встречается кожная форма. Инкубационный период при кожной форме болезни составляет от 2 до 14 сут. При своевременной антибактериальной терапии заболевание протекает относительно доброкачественно и заканчивается выздоровлением. Чаще наблюдается карбункулёзный вариант. В месте внедрения возбудителя (обычно на руках или голове) появляется красноватое или синеватое пятнышко, похожее на укус насекомого. Через несколько часов оно трансформируется в папулу медно-красного цвета, затем (в течение суток) в пузырёк, заполненный серозно-геморрагическим содержимым. Больных беспокоят жжение и зуд. При расчёсывании или спонтанно пузырёк вскрывается с образованием язвочки, покрытой тёмно-коричневым струпом, формируется сибиреязвенный карбункул. Он расположен на плотном инфильтрированном основании, окружён венчиком яркой гиперемии. Образующиеся вокруг дочерние пузырьки также вскрываются, поэтому размеры струпа увеличиваются до 0,5–3,0 см в диаметре и более. Вокруг карбункула развивается резкий распространённый отёк мягких тканей, имеющий желеобразную консистенцию. Болевая чувствительность в области карбункула и отёка из-за воздействия токсина на нервные окончания резко снижена или полностью отсутствует. Кожа в зоне отёка бледная. Регионарные лимфатические узлы плотные, подвижные, умеренно увеличены, слегка чувствительны при пальпации. При локализации карбункула в области кисти или предплечья возможен лимфангит. После уменьшения отёка (8–10-й день болезни) струп возвышается над поверхностью кожи, под ним идут процессы рубцевания и эпителизации язвы. Через 10–30 дней струп отторгается, язва полностью рубцуется. Карбункулы могут быть единичными и множественными (до десяти и более). При локализации карбункула на лице или на шее иногда развивается тяжело протекающий эдематозный вариант кожной формы болезни. Обширный отёк распространяется на клетчатку грудной клетки и даже живота. При распространении отёка на мягкие ткани глотки возможна асфиксия. В зоне отёка образуются пузырьки, после вскрытия которых формируются обширные участки некроза. Возможен также буллёзный вариант (вместо типичного карбункула образуются пузыри, заполненные серозно-геморрагическим экссудатом) и рожистоподобный вариант с наличием гиперемии кожи в области отёка. При кожной форме болезни общее состояние больного в первый день болезни остаётся удовлетворительным, на 2–3-й день появляются озноб, слабость, головная боль, температура тела поднимается до 38–40 °С, отмечают тахикардию, артериальную гипотензию. Температура тела остаётся повышенной в течение 3–7 дней, затем критически падает до нормы, общее состояние пациента быстро улучшается, уменьшается отёк в области карбункула, а потом струп отторгается и наступает полное выздоровление. Значительно реже после кратковременного улучшения внезапно появляется озноб, резко ухудшается общее состояние и развивается генерализованная инфекция. В настоящее время при современной антибиотикотерапии заболевание протекает относительно доброкачественно и заканчивается выздоровлением. Летальность при кожной форме болезни не превышает 2–3% при лечении, без антибиотикотерапии достигает 20%. Первичная генерализованная форма сибирской язвы развивается при аэрогенном или алиментарном пути заражения и крайне редко — при внедрении возбудителя через кожу или слизистую оболочку (например, губ). При этом в месте внедрения возбудителя карбункул не формируется. Генерализованная форма характеризуется бурным началом, потрясающим ознобом, гипертермией, резко выраженными симптомами интоксикации, головной болью, рвотой, тахикардией, прогрессирующей гипотензией, глухостью тонов сердца. Часто увеличиваются печень и селезёнка, появляются геморрагическая сыпь на коже, цианоз, симптомы поражения ЦНС. При лёгочном варианте в первый день болезни возможны головная боль, боли в мышцах, катаральные явления, поэтому часто диагностируют ОРЗ или грипп, но уже через несколько часов развивается интоксикационный синдром, температура достигает 39–41 °С и на первый план выступают такие симптомы, как чувство удушья, боли в грудной клетке при дыхании, одышка, кашель с пенистой кровянистой мокротой, которая быстро сворачивается в виде желе. Кожа становится бледной, возникают тахикардия, глухость тонов сердца, быстро прогрессирует падение АД. Стремительно нарастают симптомы ДН. При перкуссии грудной клетки выявляют укорочение перкуторного звука и ослабление дыхания в нижних отделах лёгких в связи с развитием плеврита. Выслушиваются разнокалиберные влажные хрипы. Смерть наступает на 2–3-й день болезни от ИТШ и ДН. Летальность составляет 80–100%. Положительный прогноз возможен при начале комплексной терапии до развития картины шока. Для кишечного варианта болезни, помимо общих симптомов, с первого дня болезни характерны режущие боли, преимущественно в нижней части живота, кровавая рвота, частый жидкий стул с примесью крови, быстро развивающиеся парез кишечника и перитонит. Исход также неблагоприятный.
Осложнения. ИТШ, сепсис, менингит, ОДН.
Диагностика. Диагноз кожной формы болезни устанавливают на основании характерных местных изменений: наличия чёрного струпа с венчиком гиперемии («чёрный уголёк на красном фоне»), студенистого безболезненного отёка и регионарного лимфаденита, появления общих симптомов после формирования карбункула. Особое значение для диагностики имеют эпидемиологические данные (профессия, уход за скотом, забой, разделка туш, работа с кожами, шкурами и т.д., ношение изделий из кожи и меха нефабричной выделки, употребление мяса, не прошедшего ветеринарно-санитарного контроля, особенно при вынужденном забое больных животных). При генерализованной форме болезни установить диагноз без эпидемиологических и лабораторных данных сложно. Основу этиологической лабораторной диагностики составляют: · бактериологические исследования, проходящие в три этапа: микроскопия мазков из патологического материала, выделение на питательных средах чистой культуры возбудителя и изучение его свойств, биологическая проба на лабораторных животных; · выявление генетического материала возбудителя методом ПЦР; · серологические исследования; · иммуногистохимические исследования; · кожно-аллергическая проба с антраксином. При подозрении на кожную форму для бактериологического исследования берут содержимое пузырьков или карбункулов, отделяемое язвы, отторгнутый струп и кровь. Если предполагают генерализованную форму, для лабораторного исследования берут кровь из локтевой вены, мочу, рвотные массы, испражнения, СМЖ (при наличии симптомов менингита), мокроту. При бактериологическом исследовании возбудитель обнаруживают методом бактериоскопии и люминесцентной микроскопии. В материале бактерии располагаются парами или в виде цепочек, окружённых общей капсулой. Споры, как правило, расположены по центру. Эти же субстраты используют для посева на питательные среды, чтобы выделить чистую культуру возбудителя, а также для постановки биопробы на лабораторных животных. Из серологических методов для подтверждения диагноза используют метод флюоресцирующих антител, РНГА (РПГА), ИФА. При подозрении на кожную форму сибирской язвы можно выполнить пункционную биопсию кожи в центре первичного аффекта с последующим иммуногистохимическим исследованием полученного материала или окраской серебром. Разработаны тест-системы для определения генетического материала возбудителя сибирской язвы методом ПЦР. Применяют кожно-аллергическую пробу с антраксином, которая с 3-го дня болезни становится положительной в 82% случаев. При исследовании животноводческого сырья (шкуры, шерсть) применяют реакцию термопреципитации по Асколи и другие методы. При генерализованном варианте необходимо рентгенологическое исследование лёгких. При подозрении на кишечный вариант показано УЗИ органов брюшной полости, при клинических признаках менингита — ЛП. В крови обнаруживают умеренно выраженные воспалительные изменения, тромбоцитопению, при исследовании мочи — признаки токсического нефроза.
Лечение. Больные подлежат экстренной госпитализации с соблюдением всех правил транспортировки и санитарно-эпидемиологического режима и изоляции в боксах или отдельных палатах. Режим — постельный до нормализации температуры. Диета — стол № 13, в тяжёлых случаях — энтерально-парентеральное питание. Лечение сибирской язвы включает этиотропную и патогенетическую терапию, проводимую в зависимости от формы болезни и имеющихся клинико-лабораторных синдромов. Этиотропная терапия представлена в схемах лечения разных форм болезни. 
*При тяжелой кожной форме препараты те же, но сроки лечения увеличиваются до 2 недель, введение препарата преимущественно в/в, в/м.
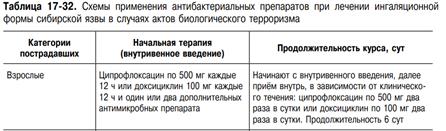
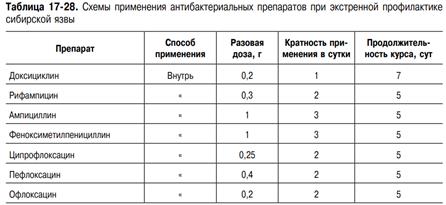
Одновременно с этиотропной терапией однократно вводят специфический противосибиреязвенный иммуноглобулин в дозе 20–100 мл внутримышечно (доза зависит от тяжести состояния). Местная терапия заключается только в обработке поражённых участков кожи растворами антисептиков. Повязки не накладывают. Хирургическое вмешательство противопоказано, поскольку оно способствует генерализации инфекции. При развитии ИТШ, распространённых отёков лица и шеи рекомендуется вводить преднизолон в дозе 90–240 мг. По индивидуальным показаниям проводят дезинтоксикационную терапию. При генерализованной форме болезни антибиотикотерапию сочетают с интенсивной дезинтоксикацией, мероприятиями, направленными на борьбу с гемодинамическими нарушениями. Применяют внутривенные перфузии полиионных растворов в объёме, необходимом для восстановления объёма циркулирующей крови, микроциркуляции, водно-электролитного баланса (2–5 л), ежедневно с добавлением 100 мл полиглюкина, реополиглюкина или гемодеза. Используют оксигенотерапию, гипербарическую оксигенацию, методы экстракорпоральной детоксикации.
Профилактика. Профилактические мероприятия подразделяются на ветеринарные и медико-санитарные. Ветеринарная служба осуществляет выявление, своевременную диагностику, забой больных животных, эпизоотологическое обследование очага, обеззараживание трупов, уничтожение мяса, шкур, шерсти павших животных, текущую и заключительную дезинфекцию в очаге, разрабатывает мероприятия, направленные на оздоровление скотомогильников, пастбищ, неблагополучных по сибирской язве территорий, а также плановую иммунизацию живой сибиреязвенной вакциной сельскохозяйственных животных в неблагополучных пунктах. Комплекс медико-санитарных мероприятий включает: · контроль за соблюдением общесанитарных норм при заготовке, хранении, транспортировке и переработке сырья животного происхождения; · вакцинопрофилактику живой споровой сухой бескапсульной вакциной — двукратно планово (на неблагополучных по сибирской язве территориях) и внеплановую (по эпидемическим показаниям с последующей ревакцинацией ежегодно); · своевременную диагностику, госпитализацию и лечение больных; · эпидемиологические обследования очага, текущую и заключительную дезинфекцию (4% хлорамином); · запрещено проводить посмертное вскрытие больных из-за возможности заражения спорами. Лицам, соприкасающимся с больными людьми или животными, в целях профилактики вводят противосибиреязвенный иммуноглобулин и антибактериальные препараты в течение 5 дней. Наблюдение за контактными ведётся в течение 14 дней. Санитарно-просветительная работа среди населения.
28. Геморрагическая лихорадка с почечным синдромом: этиология, эпидемиология, патогенез, клинические проявления, осложнения, диагностика, лечение, профилактика.
Геморрагическая лихорадка с почечным синдромом (ГЛПС) - Острая вирусная зоонозная природно-очаговая болезнь, характеризующаяся системным поражением мелких кровеносных сосудов, геморрагическим диатезом, гемодинамическими расстройствами и поражением почек с развитием ОПН.
Этиология. Возбудитель — арбовирус семейства Bunyaviridae, рода Hantavirus, включающий около 30 серотипов, 4 из которых (Hantaan, Puumala, Seul и Dobrava/Belgrad) вызывают заболевание, известное под названием ГЛПС. Вирус ГЛПС имеет сферическую форму; диаметром 85–120 нм, содержит четыре полипептида: нуклеокапсид (N), РНК-полимеразу и гликопротеины мембраны — G1 и G2. Геном вируса включает три сегмента (L-, M-, S-) одноцепочечной «минус»-РНК; реплицируется в цитоплазме инфицированных клеток (моноцитах, клетках лёгких, почек, печени, слюнных желёз). Антигенные свойства обусловлены наличием антигенов нуклеокапсида и поверхностных гликопротеинов. Поверхностные гликопротеины стимулируют образование вируснейтрализующих антител, в то время как антитела к нуклеокапсидному белку не способны нейтрализовать вирус. Исследования последних лет показывают, что хантавирусы не вызывают цитолиза эндотелиальных клеток, их поражение обусловлено, в первую очередь, иммунными механизмами. Вирус чувствителен к хлороформу, ацетону, эфиру, бензолу, ультрафиолетовому облучению; инактивируется при 50 °С в течение 30 мин, кислотолабилен (полностью инактивируется при pH ниже 5,0). Относительно устойчив во внешней среде при 4–20 °С, хорошо сохраняется при температуре ниже –20 °С. В сыворотке крови, взятой у больных, сохраняется до 4 сут при 4 °С.
Эпидемиология. ГЛПС – строгий природно-очаговый зооноз. Основным резервуаром возбудителя в природе служат дикие мышевидные грызуны. В Европейской части России источником инфекции является рыжая полевка. На Дальнем Востоке основными резервуарами инфекции являются: полевая мышь, красно-серая полевка и азиатская лесная мышь. В городах резервуаром инфекции, вероятно, могут быть домовые крысы и мыши. Грызуны переносят эту инфекцию в виде латентного вирусоносительства. У полевых мышей, отловленных в природных очагах, вирусный антиген обнаружен в тканях легких, почек, печени, в лимфатических узлах, селезенке, прямой кишке. Возбудитель выделяется во внешнюю среду с калом, мочой, слюной. Передача между грызунами осуществляется в основном через дыхательные пути. Данные литературы свидетельствуют, что не исключается роль других млекопитающих и птиц, поддерживающих эпизоотию хантавирусной инфекции в дикой природе. Заражение человека происходит преимущественно воздушно-пылевым путем, при вдыхании высохших испражнений инфицированных грызунов. Передача вируса возможна также контактным путем, через поврежденные кожные и слизистые покровы, при соприкосновении с грызунами или инфицированными объектами внешней среды (хворост, солома, сено и т.п.). Допускается возможность заражения человека алиментарным путем, например, при употреблении продуктов, которые не подвергались термической обработке (капуста, морковь и др.), загрязненных инфицированными грызунами. Передачи инфекции от человека к человеку не происходит. Восприимчивость всеобщая. Заболевают чаще мужчины наиболее активного возраста (от 16 до 50 лет). Заболеваемость регистрируется реже у детей, женщин и лиц пожилого возраста. Среди заболевших преобладают городские жители, что связано как с большим их количеством, так и уровнем иммунной прослойки. Заболеваемость ГЛПС характеризуется выраженной летне-осенней сезонностью, что обусловлено активизацией связи человека с дикой природой (освоение дачных участков, туристические походы, отдых, заготовка ягод, грибов). Перенесенная инфекция оставляет стойкий пожизненный типоспецифический иммунитет. Известны единичные случаи повторного заболевания. ГЛПС характеризуется развитием универсального капилляротоксикоза с преимущественным поражением микрососудов почек, легких, печени, головного мозга. Вирусемия и развитие синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдрома) обусловливают вовлечение в патологический процесс различных органов и тканей.
Патогенез. В инкубационном периоде вирус ГЛПС внедряется в организм через эпителий дыхательных путей, желудочно-кишечного тракта, а также через поврежденные кожные покровы. Далее репродуцируется в клетках макрофагальной системы, вызывает активацию факторов специфической и неспецифической защиты, от адекватности которой, а также инфицирующей дозы, патогенности и вирулентности возбудителя зависит как судьба самого вируса, так и выраженность патологических изменений в организме больного. Патогенетической основой начального (лихорадочного) периода ГЛПС являются вирусемия, интоксикация, активация гормональной и иммунной систем, продукция провоспалительных цитокинов, массивная вазопатия (связана с тропностью хантавируса к эндотелию сосудов микроциркуляции), коагулопатия, нарушение микроциркуляции, тканевая деструкция, образование аутоантигенов с формированием аутоантител (при тяжелой форме ГЛПС). В олигоурический период ГЛПС (разгар болезни) продолжаются расстройство системного кровообращения, гиповолемия и гемоконцентрация, гипоперфузия и гипоксия органов, тканевой ацидоз и повреждение жизненно важных систем организма. Преобладает фаза гипокоагуляции ДВС. В гипофизе, надпочечниках, почках, миокарде и других паренхиматозных органах возникают отеки, геморрагии, дистрофические и некробиотические изменения. Наибольшие изменения наблюдаются в почках, что сопровождается снижением клубочковой фильтрации, нарушением канальцевой реабсорбции. ОПН при ГЛПС вызвана поражением почечной паренхимы, острым интерстициальным нефритом. С одной стороны, нарушение микроциркуляции, повышение проницаемости сосудистой стенки способствуют плазморее и серозно-геморрагическому отеку интерстиция почек, в основном пирамидок, с последующим сдавлением канальцев и собирательных трубочек, приводящим к дистрофии, слущиванию канальцевого эпителия, пропотеванию белка и фибрина с обтурацией канальцев и собирательных трубок фибриновыми сгустками и нарушением обратной реабсорбции мочи. С другой стороны, иммунопатологический фактор - фиксация иммунных комплексов на базальной мембране клубочков, что снижает клубочковую фильтрацию. Интерстициальный отек усиливает нарушение микроциркуляции почек, вплоть до ишемии, в отдельных случаях до некроза почечных канальцев, способствует дальнейшему снижению клубочковой фильтрации и канальцевой реабсорбции. Тубулярные клетки особо чувствительны к гипоксии, недостатку энергетического материала, возникающему при ишемии. В патологическом процессе возможно участие и аутоантител к поврежденным тканевым структурам. Расстройства в центральной гемодинамике (гиповолемия, снижение сердечного выброса, артериального давления) усугубляют нарушения почечного кровотока. Период полиурии наступает с 9-13-го и продолжается до 21-24 дня болезни. В результате формирования специфического иммунитета, элиминации возбудителя, иммунных комплексов патологические изменения в почках и в других органах регрессируют, прослеживаются тенденции к нормализации их функций. В стадии полиурии раньше всего повышается клубочковая фильтрация. В условиях поврежденного тубулярного аппарата даже небольшое повышение фильтрации способствует увеличению диуреза. Полиурия обусловливается осмотическим диурезом. Медленное восстановление реабсорбционной функции канальцев приводит к потере калия, натрия, хлора. Период выздоровления патогенетически характеризуется формированием стабильного постинфекционного иммунитета с высоким уровнем специфических IgG, восстановлением гемостаза, микроциркуляции, клубочковой фильтрации мочи, но с длительным сохранением канальцевых нарушений (тубулярной недостаточности).
Клиника. Начальный период (1–3-й дни болезни) длительностью от 3 до 10 сут характеризуется острым началом, повышением температуры тела до 38–40 °С и более, сильной головной болью, сухостью во рту, тошнотой, снижением аппетита, слабостью, миалгиями. Отмечают запоры, хотя возможна и диарея до 3–5 раз в сутки. Характерны жалобы на снижение остроты зрения («мушки» перед глазами), боли в глазных яблоках, которые исчезают в течение 1–5 дней. Отмечают гиперемию лица, шеи, верхней части груди, инъекцию склер и конъюнктивы, гиперемию зева, геморрагическую энантему на слизистой оболочке мягкого нёба, умеренную брадикардию. Возможны кровянистые выделения из носа, рвота, боли в пояснице, животе; с 3–5-го дня появляется петехиальная сыпь в области ключиц, подмышечных впадин, груди. При тяжёлых формах отмечают симптомы менингизма. На 4–6-й день болезни возрастает риск развития ИТШ, особенно при нарушении лечебно-охранительного режима (физический труд, посещение бани, употребление алкоголя). Олигурический период (с 3–6-го по 8–14-й день болезни) — при нормализации температуры тела состояние больного не улучшается, чаще оно даже ухудшается; усугубляются симптомы интоксикации (усиливается головная боль, появляется рвота, не связанная с приёмом пищи, икота, сухость во рту, анорексия), и суточный диурез снижается, степень выраженности олигурии коррелирует с тяжестью заболевания. Характерна выраженная адинамия, боли в поясничной области различной интенсивности, геморрагический синдром (кровоизлияния в склеры, в местах инъекций; носовые, желудочно-кишечные, маточные кровотечения). Кровоизлияния в жизненно важные органы (ЦНС, надпочечники, гипофиз) могут стать причиной летального исхода. Объективно у больных отмечают бледность лица, пастозность век, одутловатость лица; брадикардию, гипотензию, сменяемую к концу периода гипертензией; проявляются симптомы бронхита (у курильщиков). При пальпации живота определяется болезненность в проекции почек, гепатомегалия, положительный симптом поколачивания по поясничной области. При выявлении последнего симптома следует проявлять особую осторожность из-за возможности разрыва капсулы почки. Полиурический период (с 9–13-го дня болезни) отличается развитием полиурии (до 5 л/сут и более), никтурии с гипоизостенурией; прекращением рвоты, исчезновением болей в пояснице, восстановлением сна и аппетита. В то же время сохраняется слабость, сухость во рту, усиливается жажда. Иногда в первые дни полиурии ещё нарастает азотемия, возможно развитие дегидратации, гипонатриемии, гипокалиемии. В период реконвалесценции восстанавливается суточный диурез, приходят к норме показатели мочевины и креатинина, улучшается общее состояние больного. Длительность выздоровления зависит от скорости восстановления почечных функций и продолжается от 3 нед до 2–3 лет. Оценка тяжести заболевания соответствует степени выраженности основных клинических синдромов, прежде всего ОПН, и развитию осложнений.
Осложнения. Специфические – инфекционно-токсический шок (одна из основных причин летальных исходов, чаще развивается на 4-6 день болезни), ДВС-синдром, азотемическая уремия, отек легких, отек головного мозга, кровоизлияния в мозг, гипофиз, надпочечники, миокард, профузные кровотечения, эклампсия, острая сердечно-сосудистая недостаточность, инфекционный миокардит, надрыв или разрыв капсулы почек, серозный менингоэнцефалит; Неспецифические – пиелонефрит, пневмонии, гнойные отиты, абсцессы, флегмоны, паротит, сепсис и др.
Диагностика. Неспецифическая лабораторная диагностика. Клинический анализ крови: в начальном периоде — лейкопения, увеличение числа эритроцитов, гемоглобина, снижение СОЭ, тромбоцитопения; в разгар болезни — лейкоцитоз со сдвигом формулы влево, увеличение СОЭ до 40 мм/ч. Общий анализ мочи: протеинурия (от 0,3 до 30,0 г/л и выше), микро- и макрогематурия, цилиндрурия, клетки Дунаевского. Проба Зимницкого: гипоизостенурия. Биохимический анализ крови: повышение концентрации мочевины, креатинина, гиперкалиемия, гипонатриемия, гипохлоремия. Коагулограмма: в зависимости от периода заболевания признаки гиперкоагуляции (укорочение тромбинового времени до 10–15 с, времени свёртывания крови, повышение концентрации фибриногена до 4,5–8 г/л, протромбинового индекса до 100–120%) либо гипокоагуляции (удлинение тромбинового времени до 25–50 с, удлинение времени свёртывания, снижение концентрации фибриногена до 1–2 г/л, протромбинового индекса до 30–60%). Специфическая лабораторная диагностика РНИФ: исследования проводят в парных сыворотках, взятых с интервалом 5–7 сут. Диагностически значимым считают нарастание титра антител в 4 раза и более. Метод высокоэффективен, подтверждаемость диагноза достигает 96–98%. Для повышения эффективности серодиагностики ГЛПС рекомендуют проводить забор первой сыворотки до 4–7-го дня болезни, а второй — не позже 15-го дня заболевания. Также используют твёрдофазный ИФА, который позволяет определить концентрацию IgM-антител. С целью ранней диагностики применяют ПЦР для обнаружения фрагментов вирусной РНК в крови. Инструментальные методы: УЗИ почек, ЭКГ, рентгенография органов грудной клетки.
Лечение. Немедикаментозные методы: Ранняя госпитализация - до 3-4 дня болезни. Щадящая транспортировка. Строгий постельный режим до конца периода полиурии. Учет водного баланса (в дневниках). Щадящая диета без ограничения соли. В период олигоанурии исключаются продукты, богатые белком (мясо, рыба, бобовые) и калием (овощи, фрукты). В стадии полиурии эти продукты необходимы. Контроль гемодинамики, общего анализа крови (ОАК), общего анализа мочи (ОАМ), коагулограммы, азотистых шлаков. Медикаментозное лечение: Этиотропная терапия. проводят в начальном периоде, в первые 3–5 дней: рибавирин по 0,2 г 4 раза в сутки 5–7 дней, йодофеназон — по схеме: по 0,3 г 3 раза в сутки в течение первых 2 дней, по 0,2 г 3 раза в сутки следующие 2 дня и по 0,1 г 3 раза в сутки в течение последующих 5 дней, тилорон — 0,25 мг 2 раза в сутки в 1-й день, далее по 0,125 мг 2 дня; донорский специфический иммуноглобулин против ГЛПС по 6 мл 2 раза в сутки внутримышечно (курсовая доза 12 мл), комплексный иммуноглобулиновый препарат, препараты интерферонов в свечах (виферон) и парентерально (реаферон, лейкинферон). Патогенетическая терапия • Дезинтоксикационная терапия. Внутривенно вводят 5–10% растворы глюкозы, полионные растворы, кокарбоксилазу. • Профилактика ДВС-синдрома. Используют дезагреганты, в начальном периоде показан гепарин до 5000 ЕД/сут внутривенно капельно или подкожно, надропарин кальция по 0,3 мл/сут, эноксапарин натрия по 0,2 мл/сут. G Ангиопротекторы. Кальция глюконат, этамзилат, рутин. G Свежезамороженная плазма. G Ингибиторы протеаз (апротинин). G Антиоксидантная терапия. Витамин Е, убихинон. В олигурический период для борьбы с уремической интоксикацией проводят промывание желудка и кишечника 2% раствором пищевой соды, внутривенные инфузии 4% раствора натрия гидрокарбоната, объём введения рассчитывают в миллилитрах по формуле: 0,6×масса тела больного (кг) × ВЕ (ммоль/л). Назначают энтеросорбенты (полифепан, энтеросорб); стимулируют диурез фуросемидом в режиме ударных доз (по 100–200 мг одномоментно). При анурии (менее 50 мл мочи в сутки) использование фуросемида противопоказано. При неэффективности проводимой терапии рекомендуют проведение экстракорпорального гемодиализа. В полиурическом периоде проводят восполнение воды и солей приёмом внутрь растворов регидрон, цитраглюкосолан, минеральной воды, внутривенное введение солевых растворов (ацесоль, хлосоль), приём препаратов калия (панангин, аспаркам, 4% раствор калия хлорида по 20–60 мл/сут). Для лечения воспалительных заболеваний органов мочевыводящей системы (восходящие пиелиты, пиелонефриты) назначают уросептики нитроксолин, налидиксовую кислоту, норфлоксацин, нитрофураны (нитрофурантоин, фуразидин). Общеукрепляющая терапия включает поливитамины, рибоксин, кокарбоксилазу, аденозинтрифосфат натрия. Важный компонент терапии — купирование болевого синдрома анальгетиками после исключения хирургической патологии (метамизол, спазмалгон, баралгин, спазган, трамадол, тримеперидин) и десенсибилизирующими препаратами (дифенгидрамин, прометазин, хлоропирамин); купирование судорожного синдрома — диазепам, хлорпромазин, дроперидол, натрия оксибат; артериальной гипертензии — аминофиллин, дибазол, блокаторы медленных кальциевых каналов (нифедипин, верапамил); гиперпирексии (39–41 °С) — парацетамол; упорной рвоты и икоты — прокаин внутрь, метоклопрамид внутримышечно. В случае развития ИТШ (чаще всего на 4–6-й день болезни) необходима интенсивная противошоковая терапия в условиях ОРИТ, которая включает введение коллоидных (реополиглюкин, альбумин, свежезамороженная плазма) и кристаллоидных растворов (дисоль, ацесоль) в соотношении 2:1, глюкокортикоидов (в расчёте на преднизолон) — при ИТШ I стадии — 3–5 мг/кг в сутки, II стадии — 5–10 мг/кг в сутки, III стадии — 10–20 мг/кг в сутки. При отсутствии вазопрессивного эффекта от глюкокортикоидов показано введение допамина.
Профилактика. Специфическая вакцинопрофилактика ГЛПС находится в фазе клинических исследований. Корейская вакцина, изготовленная на основе штамма Hantaan, в России не сертифицирована. Неспецифическая. Включает уничтожение грызунов в очагах, использование респираторов при работе в запылённых помещениях, хранение продуктов на складах, защищённых от грызунов.
| Болезнь | Этиология | Резервуар инфекции | Пути передачи | География | Смертность |
| ГЛСП | Гантавирус | Мышевидные грызуны | Фекально-оральный | Северная Азия, Северная Европа | 30% |
| Желтая лихорадка | Тогавирус | Обезьяны, больной человек | Трансмиссивный (комары) | Тропическая Африка, Южная и Центральная Америка | 10-60% |
| Лихорадка Ласса Западная | Аренавирус | Многососковая крыса (Mastomys natalensis), больной человек | Фекально-оральный, От человека к человеку передается воздушно-капельным и бытовым путями | Африка | до 50% |
| Лихорадки Марбург/ Эбола | Филовирус | Возможно приматы, больной человек | От человека к человеку передается воздушно-капельным и бытовым путями | Центральная Африка | 25-90% |
| Лихорадка Денге | Тогавирус | Человек | Трансмиссивный (комары рода Aedes) | Тропическ ие и субтропич еские страны | 0-10% |
| Лихорадка Крым-Конго | Буньянвирус | Зайцы, коровы, овцы, козы, иксодовые клещи | Трансмиссивный (клещи), контактный (при работе со шкурами животных) | Африка, Азия, Восточная Европа | 15-70% |








