Дикатионные молекулы как инструмент исследования ацетилхолиновых и глутаматных рецепторов. Обзор.
В.Е. Гмиро
ДИКАТИОННЫЕ МОЛЕКУЛЫ КАК ИНСТРУМЕНТ ИССЛЕДОВАНИЯ АЦЕТИЛХОЛИНОВЫХ И ГЛУТАМАТНЫХ РЕЦЕПТОРОВ. Обзор.
ФГБНУ «Институт экспериментальной медицины», Россия, 197375, Санкт-Петербург, ул. Академика Павлова, 12. e-mail: gmiro2119@gmail.com
Обзор посвящен фармакохимическому исследованию двух типов рецепторов – нейронального никотинового рецептора и глутаматного рецептора. Для оценки размеров пор в поперечном сечении канала были изучены взаимосвязи между структурой и активностью дикатионных блокаторов нейронального ионного канала никотинового ацетилхолинового рецептора (nAChR). Предложена топографическая модель места связывания блокаторов. Она включает в себя два сужения, большое и малое. Малое сужение располагается между большим сужением и цитоплазматическим концом поры. Размеры поперечного сечения большого и малого сужений, оцененные по размерам блокаторов, составляют 6,1 × 8,3 Å и 5,5 × 6,4 Å, соответственно, расстояние между сужениями вдоль поры составляет приблизительно 7 Å. Сравнение топографической модели с моделью молекулярного пучка пяти спиралей поры nAChR предсказывает, что сериновые и треониновые кольца являются наиболее вероятными кандидатами на большие и малые сужения, соответственно. Замена в дикатионах алифатических радикалов при атомах азота на циклические радикалы привела к созданию нового класса веществ, способных блокировать открытые ионные каналы GluA1 АМРА-рецепторов (Са-проницаемых). Обнаружено, что NMDA-каналы блокируются как моно-, так и дикатионными соединениями, в то время как АМРА-каналы можно эффективно блокировать только дикатионными соединениями определённой длины. Обсуждаются перспективы использования комбинированных (NMDA+AMPA) блокаторов в качестве нейрозащитных, противораковых и противовирусных агентов.
Ключевые слова: нейрональный н-холинорецептор, глутамат, AMPA, NMDA.
ВСТУПЛЕНИЕ
Химико-фармакологический метод изучения биологических структур и их функций вначале возник как вспомогательный метод фармакологии, используемый при изыскании новых лекарственных средств. Основной подход молекулярной фармакологии при изучении рецепторов и их лигандов - это химико-фармакологическое исследование, которое на основании изучения ответных реакций целостной структуры на воздействие естественных и синтетических лигандов известного строения дает возможность судить о химической природе активных центров и эффекторной части изучаемой структуры. Именно этим путем были получены первые сведения о структуре и свойствах никотиновых холинорецепторов [1–7] и других рецепторов, являющихся лиганд-управляемыми ионными каналами [8–12].
Важно соблюдать основной принцип химико-фармакологического исследования - строгость сравнения. Корректным является сравнение активности веществ, молекулы которых различаются не по нескольким, а по одному структурному или физико-химическому параметру. В наибольшей мере этому требованию отвечают гомологические ряды соединений. Так, с помощью разных гомологических рядов дикатионных соединений, члены которых различались длиной полиметиленовой цепи между двумя положительно заряженными атомами азота, удалось уточнить строение участка их связывания в ионных каналах никотинового холинорецептора [2, 3, 6, 7] и глутаматных ионотропных рецепторов [8–12].
1. Ганглиоблокаторы как первые дикатионные антагонисты нейрональных ацетилхолиновых рецепторов.
Ещё в середине прошлого века было обнаружено, что в полиметиленовом ряду диметониевых ганглиоблокаторов общей формулы [Me3  -(CH2)n-
-(CH2)n-  Me3] 2Br- наиболее выраженными ганглиоблокирующими свойствами обладают пентаметоний (n=5) и гексаметоний (n-6), содержащие 5 и 6 метиленовых групп между четвертичными азотами [13]. Был сделан вывод, что две катионные группы молекулы лиганда связываются с двумя анионными участками рецептора, находящимися на соответствующем расстоянии. Этот момент послужил отправной точкой большого числа исследований в последующие годы в области ацетилхолиновой и глутаматной рецепции.
Me3] 2Br- наиболее выраженными ганглиоблокирующими свойствами обладают пентаметоний (n=5) и гексаметоний (n-6), содержащие 5 и 6 метиленовых групп между четвертичными азотами [13]. Был сделан вывод, что две катионные группы молекулы лиганда связываются с двумя анионными участками рецептора, находящимися на соответствующем расстоянии. Этот момент послужил отправной точкой большого числа исследований в последующие годы в области ацетилхолиновой и глутаматной рецепции.
Нами был разработан синтез дикатионных соединений со всевозможными катионными группами, разделенными полиметиленовой цепочкой [14]. Их ганглиоблокирующую активность исследовали на шейном симпатическом ганглии наркотизированных кошек [3]. Определяли величину ЭД50 (мкМ) - дозу, вызывающую расслабление мигательной перепонки кошки на 50%.
Было синтезировано несколько серий производных бута-, пента- и гексаметония (таблица I). Каждая серия содержала один асимметричный и два соответствующих симметричных аналога. Видно, что все асимметричные соединения были активнее соответствующих симметричных соединений. Разница в активности была особенно заметна в бутаметониевом ряду: бис-триметиламмониевый (ИЭМ-860) и бис-триэтиламмониевый (ИЭМ-868) дикатионы были слабо активны, в то время как асимметричное соединение ИЭМ-848 было в 3 раза активнее гексаметония и превышало по активности наиболее активный симметричный аналог (ИЭМ-868) в 64 раза [3].
Таблица 1. Сравнение ганглиоблокирующей активности симметричных и несимметричных дикатионов.
| Шифр (ИЭМ №) | Формула | Относительная активность (гексаметоний = 1) |
| 848 | Me3  -(CH2)4- -(CH2)4-  Et3 Et3
| 3.2 |
| 860 | Me3  -(CH2)4- -(CH2)4-  Me3 Me3
| 0.01 |
| 868 | Et3  -(CH2)4- -(CH2)4-  Et3 Et3
| 0.05 |
| 850 | Me3  -(CH2)5- -(CH2)5-  Et3 Et3
| 5.6 |
| 861 | Me3  -(CH2)5- -(CH2)5-  Me3 Me3
| 1.4 |
| 869 | Et3  -(CH2)5- -(CH2)5-  Et3 Et3
| 0.1 |
| 900 | Me3  -(CH2)5- -(CH2)5-  MePr2-i MePr2-i
| 5.0 |
| 901 | i-Pr2Me  -(CH2)5- -(CH2)5-  MePr2-i MePr2-i
| 0.17 |
| 1115 | Me3  -(CH2)5- -(CH2)5-  Me2Hex-c** Me2Hex-c**
| 3.3 |
| 895 | c-HexMe2  -(CH2)5- -(CH2)5-  Me2Hex-c Me2Hex-c
| 0.03 |
| 852 | Me3  -(CH2)6- -(CH2)6-  Et3 Et3
| 1.7 |
| 862 | Me3  -(CH2)6- -(CH2)6-  Me3 Me3
| 1.0 |
| 870 | Et3  -(CH2)6- -(CH2)6-  Et3 Et3
| 0.1 |
*ЭД50 гексаметония 0.035 мкМ (доза, вызывающая расслабление мигательной перепонки на 50%). **Hex-c – циклогексил.
Разница между активностью симметричных и асимметричных аналогов свидетельствовала в пользу того, что два анионных сайта, с которыми связываются дикатионные ганглиолитики, не идентичны. Один из них, как предположили авторы, является анионным сайтом холинорецептора, связывающим триметиламмониевую группу ацетилхолина или дикатионных ганглиолитиков. Этот сайт условно назвали основным анионным центром; другой - вторым анионным сайтом, который лучше связывает большую катионную группу.
Было синтезировано и исследовано несколько групп соединений по следующему принципу. Если в молекуле дикатионного ганглиолитика оставлять неизменной одну триметиламмониевую группу, а положение и структуру второй катионной группы варьировать, то активность соединений, предположительно, будет определяться взаимодействием со вторым анионным пунктом. Таким образом, можно исследовать не только структурную организацию соответствующего участка холинорецептивной мембраны нейронов ганглия, но и определить требования к молекуле активного ганглиолитика. Было обнаружено, что несимметричные дикатионы, содержащие наряду с триметиламмониевой группой третичную или вторичную аммониевую группу, не только не уступали, но даже превосходили по активности четвертичные аналоги (табл. 2) [3, 15].
Таблица 2. Ганглиоблокирующая активность дикатионов, содержащих третичную или вторичную аминогруппу.
[Me3  -(CH2)5-
-(CH2)5-  R1R2R3] 2Br-
R1R2R3] 2Br-
| Шифр (ИЭМ №) |  R1R2R3 R1R2R3
| Относительная активность (гексаметоний = 1)* |
| 1034 |  Me2Pr-i Me2Pr-i
| 3.9 |
| 1033 |  HMePr-i HMePr-i
| 8.0 |
| 946 |  H2Pr-i H2Pr-i
| 7.7 |
| 900 |  MePr2-i MePr2-i
| 5.0 |
| 903 |  HPr2-i HPr2-i
| 9.4 |
| 959 |  H3 H3
| 0.03 |
| 960 |  H2Me H2Me
| 0.2 |
| 1035 |  H2Et H2Et
| 2.5 |
| 988 |  H2Pr-n H2Pr-n
| 3.9 |
| 989 |  H2Bu-n H2Bu-n
| 1.4 |
| 962 |  H2Bu-t H2Bu-t
| 4.2 |
| 1144 | 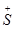 MePr-i MePr-i
| 4.1 |
*ЭД50 гексаметония 0.035 мкМ (доза, вызывающая расслабление мигательной перепонки на 50%).
Как видно из таблицы, при переходе от четвертичной катионной группы к третичной и вторичной происходит уменьшение общей массы катионной группы, однако активность не уменьшается, а увеличивается (табл. 1, ИЭМ-1034 и ИЭМ-946). Это может быть связано с тем, что у соединений, содержащих третичную или вторичную катионную группу, появляется возможность дополнительной фиксации молекулы в области второго анионного пункта с помощью водородной связи. В пользу этого предположения говорит сопоставление активности молекул, в которых катионные группы имеют одинаковые радикалы, но при этом одни способны к образованию водородной связи (ИЭМ-1033), а другие – нет (ИЭМ-1144, табл. 1). Соединение ИЭМ-1144, неспособное к образованию водородной связи, в 2 раза менее активно. В то же время соединение, имеющее катионную группу  H3, способную к образованию водородных связей, но лишенную гидрофобных радикалов, обладает очень низкой активностью (ИЭМ-959). В линейном алкильном ряду (Me, Et, n-Pr, n-Bu) н-пропильный заместитель обеспечивает максимальную активность (ИЭМ-988). Дальнейшее удлинение до н-бутила привело к снижению ганглиоблокирующей активности. Соответствующие разветвленные радикалы (изопропил и трет-бутил) вносят больший вклад в активность, чем линейные радикалы. Гидрофобная область второго анионного сайта, по-видимому, соответствует длине пропила. Наибольший скачок активности (в 250 раз) наблюдается при замене водорода аминогруппы (ИЭМ-959) на изопропил (ИЭМ-946).
H3, способную к образованию водородных связей, но лишенную гидрофобных радикалов, обладает очень низкой активностью (ИЭМ-959). В линейном алкильном ряду (Me, Et, n-Pr, n-Bu) н-пропильный заместитель обеспечивает максимальную активность (ИЭМ-988). Дальнейшее удлинение до н-бутила привело к снижению ганглиоблокирующей активности. Соответствующие разветвленные радикалы (изопропил и трет-бутил) вносят больший вклад в активность, чем линейные радикалы. Гидрофобная область второго анионного сайта, по-видимому, соответствует длине пропила. Наибольший скачок активности (в 250 раз) наблюдается при замене водорода аминогруппы (ИЭМ-959) на изопропил (ИЭМ-946).
Итак, варьируя одну из двух катионных групп, разделенных пентаметиленовой цепью, удалось показать, что, во-первых, вторая катионная группа может быть не четвертичной, а вторичной и третичной с дополнительной возможностью образования водородной связи, а во вторых, для проявления ганглиоблокирующей активности необходимо наличие в ней хотя бы одного алкильного радикала при азоте аминогруппы.
Оставалось выяснить два принципиальных вопроса. Первый – действительно ли необходим второй (+)-заряд для успешного связывания молекулы лиганда с рецептором, и если необходим, то каково оптимальное расстояние между зарядами в молекуле дикатионного блокатора?
Влияние расстояния между катионными группами на активность дикатионных блокаторов было исследовано с помощью модельной серии дикатионов, в которых проводилось последовательное смещение (+)-заряда по алифатической цепи при неизменной общей длине молекулы (табл. 3) [3]:
Таблица 3. Влияние расстояния между катионными группами на ганглиоблокирующую активность дикатионов.
| Шифр ИЭМ № | Формула | Относительная активность (гексаметоний = 1)* |
| 1035 | Me3  -С-С-С-С-С-С- -С-С-С-С-С-С-  H2-С-С H2-С-С
| 2.3 |
| 988 | Me3  -С-С-С-С-С- -С-С-С-С-С-  H2-С-С-C H2-С-С-C
| 3.9 |
| 1200 | Me3  -С-С-С-С- -С-С-С-С-  H2-С-С-C-C H2-С-С-C-C
| 4.2 |
| 1124 | Me3  -С-С-С- -С-С-С-  H2-С-С-C-C-C H2-С-С-C-C-C
| 0.38 |
| 1104 | Me3  -С-С-С-С-С-C-C-C-C -С-С-С-С-С-C-C-C-C
| 0.53 |
*ЭД50 гексаметония 0.035 мкМ (доза, вызывающая расслабление мигательной перепонки на 50%).
Высокая активность обнаруживается на расстоянии 4-6 метиленовых групп между заряженными атомами азота. Следовательно, второй положительный заряд на таком расстоянии вносит существенный вклад в активность соединений. Этот вклад почти исчезает при переходе от тетра- к триметиленовой цепи. Соединение с триметиленовой цепью практически не отличается по активности от соответствующего монокатионного аналога (табл. 3, ИЭМ-1124 и ИЭМ-1104).
Полученные данные укладываются в гипотетическую схему (табл. 4).
Таблица 4. Гипотетическая схема участка холинорецептивной мембраны, с которым взаимодействуют дикатионные ганглиоблокаторы [3].
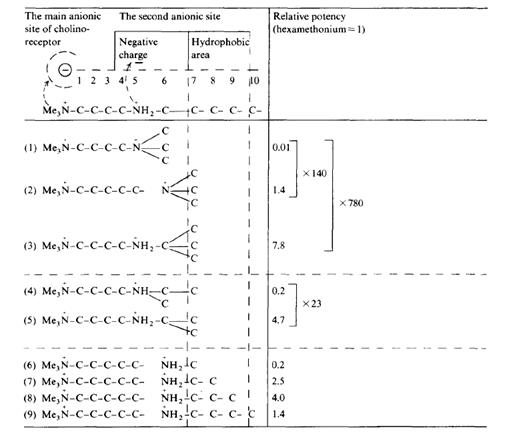
Дикатионные ганглиолитики взаимодействуют с участком холинорецептивной мембраны, которая включает: а) главный анионный пункт, комплементарный триметиламмониевой группе ганглиолитика и возможно ацетилхолина; б) вторую зону фиксации (дополнительный, второй анионный пункт), которая структурно отличается от главного анионного пункта и содержит анионную группу на расстоянии, соответствующем длине цепи из четырёх CH2-звеньев, и гидрофобную область на расстоянии, соответствующим шести CH2-звеньям.
Все полученные результаты хорошо согласуются с этой схемой. Бутаметоний обладает очень слабой ганглиоблокирующей активностью, так как метильные радикалы второй катионной группы не попадают в область гидрофобного взаимодействия, хотя положительно заряженный атом азота находится в оптимальном положении. При переходе от дикатиона (1) к дикатиону (2), то есть при удлинении молекулы на одно CH2-звено, метилы Me3  -группы попадают в гидрофобную область, что ведет к увеличению активности в 140 раз. Соответствующий сдвиг метилов в гидрофобную область при переходе от соединения (1) к соединению (3), где не меняется расстояние между двумя
-группы попадают в гидрофобную область, что ведет к увеличению активности в 140 раз. Соответствующий сдвиг метилов в гидрофобную область при переходе от соединения (1) к соединению (3), где не меняется расстояние между двумя  -атомами, ведет к возрастанию активности в 780 раз. В другом примере заместители азота во второй катионной группе двух производных бутаметония очень похожи (таблица 4; соединения 4, 5). Единственное отличие - положение одного метила. Если он достигает гидрофобной зоны, активность возрастает в 23 раза. Размер гидрофобной области, по-видимому, не превышает длины цепочки из трех атомов углерода (соединения 6-9). Представленная схема объясняет полученные данные и дает возможность предсказать активность новых соединений.
-атомами, ведет к возрастанию активности в 780 раз. В другом примере заместители азота во второй катионной группе двух производных бутаметония очень похожи (таблица 4; соединения 4, 5). Единственное отличие - положение одного метила. Если он достигает гидрофобной зоны, активность возрастает в 23 раза. Размер гидрофобной области, по-видимому, не превышает длины цепочки из трех атомов углерода (соединения 6-9). Представленная схема объясняет полученные данные и дает возможность предсказать активность новых соединений.
2. Обнаружение корреляции между ганглиоблокирующими и каналоблокирующими свойствами дикатионов.
Дальнейшее исследование действия полиметиленовых диаммониевых соединений на каналы, активируемые ацетилхолином, было проведено при помощи метода фиксации мембранного потенциала в нейронах изолированного верхнего шейного ганглия кролика. Обнаружено, что в ряду дикатионов общей формулы Me3  -(CH2)n-
-(CH2)n-  Me3 по мере роста длины цепи от n=4 до n=6 ганглиоблокирующая активность, определенная на верхнем шейном ганглии кошки in situ, коррелирует с константой скорости присоединения к открытому каналу, определенной в опытах на нейронах изолированного верхнего шейного ганглия кролика. Был сделан вывод, что ганглиоблокирующее действие диаммониевых соединений определяется их каналоблокирующей активностью [16, 17, 18, 19].
Me3 по мере роста длины цепи от n=4 до n=6 ганглиоблокирующая активность, определенная на верхнем шейном ганглии кошки in situ, коррелирует с константой скорости присоединения к открытому каналу, определенной в опытах на нейронах изолированного верхнего шейного ганглия кролика. Был сделан вывод, что ганглиоблокирующее действие диаммониевых соединений определяется их каналоблокирующей активностью [16, 17, 18, 19].
В работе [18] были определены величины IC50 для ряда дикатионов (IC50 ‑ концентрации, вызывающие 50%-ный ингибирующий эффект на ионных каналах нейронов верхнего шейного ганглия крысы). В таблице 5 приводится сравнение величин IC50 с данными опытов на верхнем симпатическом ганглии кошки в опытах in situ (ED50 – доза, вызывающая расслабление на 50% мигательной перепонки) [18]. Видно, что ганглиоблокирующий эффект тем больше, чем больше связывание дикатиона с ионным каналом (большее связывание с каналом соответствует меньшему значению IC50).
Таблица 5. Структуры и блокирующая активность дикатионных ганглиоблокаторов.
| Шифр ИЭМ № | Me3  -(CH2)5-R
R -(CH2)5-R
R
| IC50* µM | ED50 Относительная активность (гексаметоний = 1)** |
| 861 |  Me3 Me3
| 5.9±2.6 | 1.4 |
| 1206 |  Me2Et Me2Et
| 3.2±0.7 | 1.9 |
| 1034 |  Me2Pr-i Me2Pr-i
| 1.6±0.2 | 3.9 |
| 1322 | 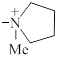
| 0.6±0.1 | 4.0 |
| 900 |  MePr2-i MePr2-i
| 0.12±0.02 | 5.0 |
| 850 |  Et3 Et3
| 1.7±0.4 | 5.6 |
| 903 |  HPr2-i HPr2-i
| 0.8±0.2 | 9.4 |
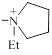
| 1.7±0.3 | ||
Et3  -(CH2)5-R
R -(CH2)5-R
R
| |||
| 850 |  Me3 Me3
| 1.7±0.4 | 5.6 |
| 991 |  MeEt2 MeEt2
| 2.1±0.3 | 3.1 |
| 1305 | 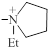
| 2.5±0.2 | 1.5 |
| 1098 |  Me2Pr-i Me2Pr-i
| 2.0±0.5 | 0.7 |
| 1125 |  Me2Pr-n Me2Pr-n
| 16.5±4.4 | 0.2 |
| 1307 | 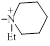
| 36.0±1.4 | 0.17 |
| 1304 | 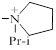
| 74.0±16.0 | 0.16 |
| 869 |  Et3 Et3
| 79.0±7.0 | 0.1 |
*IC50 - IC50 ‑ концентрации, вызывающие 50%-ный ингибирующий эффект на ионных каналах нейронов верхнего шейного ганглия крысы.
**ЭД50 гексаметония 0.035 мкМ (доза, вызывающая расслабление мигательной перепонки на 50% в опытах на кошке in situ).
В данной таблице особый интерес вызывают данные для дикатионов ИЭМ-869 и ИЭМ-1305. В дикатионе ИЭМ-1305 две этильные группы дикатиона ИЭМ-869 замкнуты в пирролидиновое кольцо, то есть гидрофобная масса двух дикатионов практически одинакова. Единственное отличие – ограничение конформационной подвижности двух этилов в ИЭМ-1305, которые замкнулись в кольцо. Но самое интересное, что эта деталь сильнейшим образом повлияла на обе константы (IC50 и ED50), а именно, резко возросла как ганглиоблокирующая (1.5/0.1=15), так и каналоблокирующая (79/2.5=32) активность дикатиона с пирролидиновым кольцом (ИЭМ-1305). Это наблюдение имеет прямое отношение к вопросу о способности дикатионов проходить или не проходить в ионный канал нейронального никотинового рецептора в зависимости от структуры варьируемой катионной группы. Этот вопрос был детально рассмотрен в последующем исследовании.
В качестве объекта исследования нейронального холинорецептора были выбраны симпатический и парасимпатический ганглии [20]. Известно одно из образных определений ганглиев как мозга, вынесенного на периферию. Ганглионарные нервные клетки содержат полный набор рецепторов, имеющихся в клетках мозга, но значительно более доступны для изучения. Как отмечалось выше, в отношении ганглиоблокаторов общей формулы [Me3  -(CH2)5-
-(CH2)5-  R1R2R3] 2Br- (1) было установлено, что имеется тесная корреляция между их ганглиоблокирующим действием и каналоблокирующей активностью [16, 17, 18]. Следовательно, ганглиоблокирующая активность веществ может быть использована для оценки их каналоблокирующей активности. Такой подход был успешно использован для исследования некоторых особенностей строения канала нейронального никотинового холинорецептора с помощью соединений общей формулы (1) [Et3
R1R2R3] 2Br- (1) было установлено, что имеется тесная корреляция между их ганглиоблокирующим действием и каналоблокирующей активностью [16, 17, 18]. Следовательно, ганглиоблокирующая активность веществ может быть использована для оценки их каналоблокирующей активности. Такой подход был успешно использован для исследования некоторых особенностей строения канала нейронального никотинового холинорецептора с помощью соединений общей формулы (1) [Et3  -(CH2)5-
-(CH2)5-  R1R2R3] 2Br-, причем выводы, полученные из анализа данных по ганглиоблокирующей активности [21] оказались в хорошем соответствии с данными о каналоблокирующей активности этого же ряда веществ [7].
R1R2R3] 2Br-, причем выводы, полученные из анализа данных по ганглиоблокирующей активности [21] оказались в хорошем соответствии с данными о каналоблокирующей активности этого же ряда веществ [7].
3. Методы конформационного анализа при расчете параметров канала нейронального никотинового холинорецептора.
При анализе связи структуры и активности в ряду дикатионов была замечена одна необычная особенность. Если в ряду соединений (2) [Me3  -(CH2)5-
-(CH2)5-  R1R2R3] 2Br- ганглиоблокирующая активность меняется монотонно при переходе от одного гомолога к другому [16], то в ряду соединений (1) [Et3
R1R2R3] 2Br- ганглиоблокирующая активность меняется монотонно при переходе от одного гомолога к другому [16], то в ряду соединений (1) [Et3  -(CH2)5-
-(CH2)5-  R1R2R3] 2Br минимальное изменение структуры R1R2R3
R1R2R3] 2Br минимальное изменение структуры R1R2R3  -группы при переходе от Et2Me
-группы при переходе от Et2Me  - к Et3
- к Et3  -группе ведёт к скачкообразному падению блокирующей активности [7]. Авторы предположили, что в данном случае более объёмная Et3
-группе ведёт к скачкообразному падению блокирующей активности [7]. Авторы предположили, что в данном случае более объёмная Et3  -группа, в отличие от Et2Me
-группа, в отличие от Et2Me  -группы, не способна проходить внутрь канала, и следовательно, блокирующая активность веществ формулы (1) определяется стерическими параметрами варьируемой R1R2R3
-группы, не способна проходить внутрь канала, и следовательно, блокирующая активность веществ формулы (1) определяется стерическими параметрами варьируемой R1R2R3  -группы. В случае, если она способна проходить в канал, создается возможность более прочной двухточечной фиксации дикатионной молекулы и блокирующая активность вещества резко увеличивается.
-группы. В случае, если она способна проходить в канал, создается возможность более прочной двухточечной фиксации дикатионной молекулы и блокирующая активность вещества резко увеличивается.
Таким образом, появилась реальная возможность использовать изучение связи структуры и активности в ряду ганглиоблокаторов для выявления особенностей строения биологической мишени, на которую они воздействуют – нейрональный ионный канал ацетилхолинового холинорецептора.
Фармакологическая активность веществ общей формулы (1) и параметры заселенности продуктивных конформаций представлены в табл. 6. Активность всех исследованных соединений выражена в относительных единицах; ЕD50 гексаметония, общепринятого эталонного ганглиоблокатора, принята за 1.0.
Таблица 6. Свойства и активность соединений общей формулы (1) [Et3  -(CH2)5-
-(CH2)5-  R1R2R3]×2Br-
R1R2R3]×2Br-
| Номер | - | Шифр ИЭМ № | Засе-ленность, åР1 %* | Активность** | |
| на симпати-ческом ганглии | на парасим-патическом ганглии | ||||
| (I) | -  Me2Et Me2Et
| 1117 | 100 | 7.70 | 25.80 |
| (II) | -  Me3 Me3
| 850 | 100 | 5.60 | 16.60 |
| (III) | 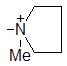
| 1231 | 95.5 | 3.70 | 11.0 |
| (IV) | 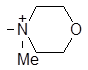
| 1309 | 92.4 | 3.20 | 16.20 |
| (V) | -  MeEt2 MeEt2
| 991 | 54 | 3.10 | 16.90 |
| (VI) | 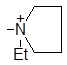
| 1742 1305 | 49.4 | 1.50 | 23.20 |
| (VII) | 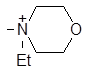
| 1308 | 47.3 | 1.30 | 6.90 |
| (VIII) | 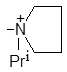
| 1304 | 8.1 | 0.16 | 0.42 |
| (IX) | -  Me2Pr-n Me2Pr-n
| 1125 | 6.0 | 0.20 | 0.39 |
| (X) | 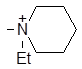
| 1307 | 0.00 | 0.17 | 1.24 |
| (XI) | -  Et3 Et3
| 869 | 0.00 | 0.12 | 0.22 |
| (XII) | 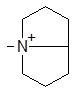
| 1318 | 0.00 | 0.08 | 0.32 |
| (XIII) | 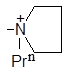
| 1351 | 0.00 | 0.07 | 0.18 |
| (XIV) | - 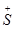 Me2 Me2
| 100 | 1.60 | 7.30 | |
| (XV) | -  H3 H3
| 1419 | 100 | 0.70 | 1.80 |
| (XVI) | -  HMe2 HMe2
| 1126 | 100 | 1.80 | 6.20 |
| (XVII) | -  HEt2 HEt2
| 990 | 79.6 | 1.10 | 4.40 |
| (XVIII) | 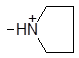
| 1232 | 100 | 1.10 | 4.00 |
| (XIX) | -  H2Bu-t H2Bu-t
| 1058 | 100 | 1.10 | 1.27 |
| (XX) | -  HMePr-i HMePr-i
| 1097 | 98.5 | 1.00 | 2.90 |
| (XXI) | -  H2Pr-i H2Pr-i
| 1096 | 100 | 0.60 | 0.97 |
| (XXII) | -  HPr2-i HPr2-i
| 987 | 41.6 | 0.18 | 1.05 |
| (XXIII) | -  HMeBu-t HMeBu-t
| 1079 | 87.2 | 0.11 | 0.38 |
| (XXIV) | 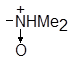
| 1600 | - | 0.01 | 0.03 |
*Суммарная заселённость продуктивных конформаций (для сечения 6.1х8.3 Å).
**Относительная активность (по отношению к активности гексаметония, которая принята за 1). Активность гексаметония на верхнем шейном симпатическом ганглии кошки соответствует величине ЕD50=0.035 мкМ, а на парасимпатическом ганглии тонкой кишки морской свинки соответствует величине Кd=4.5×мкМ.
Поскольку соединения формулы (1) и (2) имеют гибкую молекулярную структуру и способны существовать в виде множества конформаций, были проведены конформационные расчеты, методика которых изложена в работе [22]. Для анализа связи структуры и активности отбирались конформеры с энергией устойчивых конформаций, составляющей не более 3 ккал/моль. Оценку параметров сужения в русле ионного канала проводили на основании корреляции между заселенностью продуктивных конформаций (т.е. способностью молекул проходить через данное сечение канала, аппроксимированное прямоугольником), и активностью данного вещества. Расчеты показали, что максимальная величина коэффициента корреляции (0.97 для симпатического и 0.80 для парасимпатического ганглиев) соответствует прямоугольному профилю сужения со сторонами прямоугольника 8.3х6.1 Å [23]. Аналогичные параметры были получены и в том случае, когда при расчетах использовали результаты опытов на изолированных нейронах, где каналоблокирующую активность веществ оценивали по подавлению ими трансмембранного тока, вызванного ионофоретической аппликацией ацетилхолина [7].
На рис. 1 по оси абсцисс отложены через равные промежутки варьируемые R1R2R3  -группы в порядке уменьшения заселённости продуктивных конформаций, то есть способности данной группы, входящей в состав бис-катионной молекулы, проходить через сужение·с размерами 8.3х6.1 Å. По оси ординат отложены относительные величины ганглиоблокирующей активности [за 100% принята активность соединения (I)] [20].
-группы в порядке уменьшения заселённости продуктивных конформаций, то есть способности данной группы, входящей в состав бис-катионной молекулы, проходить через сужение·с размерами 8.3х6.1 Å. По оси ординат отложены относительные величины ганглиоблокирующей активности [за 100% принята активность соединения (I)] [20].
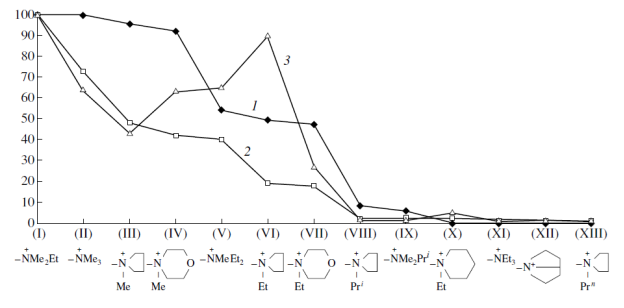
Рис.1. Корреляция между относительной заселённостью (кривая 1) и относительной блокирующей активностью на симпатических (кривая 2) и парасимпатических (кривая 3) ганглиях соединений общей формулы (1) [Et3  -(CH2)5-
-(CH2)5-  R1R2R3] 2Br-. За 100% принята заселённость и активность соединения (I). Внизу под графиком приводится строение группы
R1R2R3] 2Br-. За 100% принята заселённость и активность соединения (I). Внизу под графиком приводится строение группы  R1R2R3.
R1R2R3.
Из рис. 1 видно, что в общем случае падение заселённости (т.е. способности проходить через сужение с указанными размерами) сопровождается падением активности. Например, соединение (XI) (R1R2R3  = Et3
= Et3  ) практически неактивно в полном соответствии с тем, что оно не проходит через сужение (заселённость 0%). Если в этом же соединении ограничить конформационную подвижность двух этильных радикалов Et3
) практически неактивно в полном соответствии с тем, что оно не проходит через сужение (заселённость 0%). Если в этом же соединении ограничить конформационную подвижность двух этильных радикалов Et3  -группы, замкнув их в кольцо (соединение VI), то заселённость увеличивается от 0 до 49,4%, и вместе с тем в 13 раз увеличивается активность на симпатическом, и в 100 раз - на парасимпатическом ганглии. Если же N-этилпирролидиновую группу в молекуле (VI) увеличить на одно СН2-звено путём замены этила на i-Pr (VIII), либо на n-Pr (XIII), либо расширив цикл от пяти до шестичленного (X), то во всех этих случаях мы наблюдаем падение как заселённости (от 49,4% до 8.1, 0%, 0%, соответственно), так и активности (в 9, 21, 10 раз на симпатическом и в 56, 60, 18 раз на парасимпатическом ганглии). Минимально возможное уменьшение Et3
-группы, замкнув их в кольцо (соединение VI), то заселённость увеличивается от 0 до 49,4%, и вместе с тем в 13 раз увеличивается активность на симпатическом, и в 100 раз - на парасимпатическом ганглии. Если же N-этилпирролидиновую группу в молекуле (VI) увеличить на одно СН2-звено путём замены этила на i-Pr (VIII), либо на n-Pr (XIII), либо расширив цикл от пяти до шестичленного (X), то во всех этих случаях мы наблюдаем падение как заселённости (от 49,4% до 8.1, 0%, 0%, соответственно), так и активности (в 9, 21, 10 раз на симпатическом и в 56, 60, 18 раз на парасимпатическом ганглии). Минимально возможное уменьшение Et3  -группы (на одно СН2-звено) в соединении (XI), т.е. переход к аналогу с Et2Me
-группы (на одно СН2-звено) в соединении (XI), т.е. переход к аналогу с Et2Me  -группой (V), ведёт к росту заселённости от 0 до 54% и росту активности в 26 раз на симпатическом и в 82.5 раза на парасимпатическом ганглии.
-группой (V), ведёт к росту заселённости от 0 до 54% и росту активности в 26 раз на симпатическом и в 82.5 раза на парасимпатическом ганглии.
"Непроходящая" N-этилпиперидиновая группа (соединение X) становится "проходящей", если одно метиленовое звено в цикле заменить на кислород (соединение VII), т.е. при переходе от пиперидинового к морфолиновому циклу. Кислород способен влиять на связывание (например, путём образования водородной связи), но конформационные расчёты ясно указывают на стерический фактор: заселённость увеличивается от 0% в (X) до 47.3% в(VII), что сопровождается ростом активности на обоих типах ганглиев в 5-8 раз.
Из данных, представленных в табл. 6 и на рис. 1 следует, что общим фактором, определяющим активность соединений формулы (2), являются стерические параметры их молекул, которые количественно оцениваются заселённостью продуктивных конформаций.
Кривая активности для парасимпатических ганглиев (рис. 1) коррелирует с кривой заселённости в меньшей мере, чем для симпатических ганглиев, демонстрируя подъём для трёх веществ (IV, V, VI) вместо ожидаемого падения, причём пик активности приходится на соединение (VI). Полагают, что эта особенность связана с эффектом "ловушки", показанным для соединения (VI) (ИЭМ-1305) [24].
Все дикатионы общей формулы [Et3  -(CH2)5-
-(CH2)5-  R1R2R3]×2Br- содержат в себе Et3
R1R2R3]×2Br- содержат в себе Et3  -группу, которая не проходит через сужение 6,1хּ8,З Å и блокирующая активность дикатионов данного ряда зависит от способности варьируемой катионной группы проходить через сужение 6.1х8.3 Å. Дикатионы общей формулы [Me3
-группу, которая не проходит через сужение 6,1хּ8,З Å и блокирующая активность дикатионов данного ряда зависит от способности варьируемой катионной группы проходить через сужение 6.1х8.3 Å. Дикатионы общей формулы [Me3  -(CH2)5-
-(CH2)5-  R1R2R3]×2Br все проходят через сужение 6.1х8.3 Å (заселенность 100%), но их активность сильно варьирует в зависимости от структуры R1R2R3
R1R2R3]×2Br все проходят через сужение 6.1х8.3 Å (заселенность 100%), но их активность сильно варьирует в зависимости от структуры R1R2R3  - группы. Чтобы объяснить эту особенность, предположили, что в ионном канале имеется второе сужение, более узкое, чем первое, создающее стерические препятствия для прохождения через сужение данных бис-катионов [23, 25]. В этом случае блокирующая активность данной группы соединений должна быть тем выше, чем труднее переменная катионная группа проходит через это второе сужение.
- группы. Чтобы объяснить эту особенность, предположили, что в ионном канале имеется второе сужение, более узкое, чем первое, создающее стерические препятствия для прохождения через сужение данных бис-катионов [23, 25]. В этом случае блокирующая активность данной группы соединений должна быть тем выше, чем труднее переменная катионная группа проходит через это второе сужение.
Были рассчитаны параметры сужения канала, для которых имеет место наивысший коэффициент корреляции между заселённостью проходящих конформаций и величиной, обратной величинам активностей. Наибольший коэффициент корреляции, 0.91 для симпатического и 0.96 для парасимпатического ганглия, соответствовал сужению прямоугольного профиля с параметрами 6.4х5.5 Å [2].
Таким образом, анализ связи структуры и активности соединений общей формулы (1) и (2), основанный на расчётах коэффициента корреляции между заселённостью продуктивных конформаций и ганглиоблокирующей активностью, приводит к заключению о том, что ионный канал нейронального никотинового холинорецептора имеет воронкообразную форму с двумя сужениями в месте связывания ганглиоблокаторов, которые аппроксимируются прямоугольниками с размерами 8.3х6.1 Å и 6.4х5.5 Å (рис. 2) [20, 23].
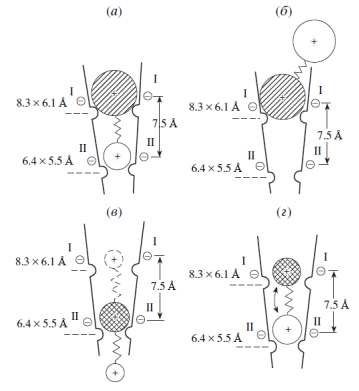
Рис 2. Модели различных вариантов (а, б, в, г) связывания бис-аммониевых блокаторов общей формулы [Me3  -(CH2)5-
-(CH2)5-  R1R2R3]×2Br- (1) и [Et3
R1R2R3]×2Br- (1) и [Et3  -(CH2)5-
-(CH2)5-  R1R2R3]×2Br- (2) с нуклеофильными участками в русле ионного канала нейронального никотинового холинорецептора. (а) - Ориентация в русле канала молекулы блокатора (2) с постоянной Et3
R1R2R3]×2Br- (2) с нуклеофильными участками в русле ионного канала нейронального никотинового холинорецептора. (а) - Ориентация в русле канала молекулы блокатора (2) с постоянной Et3  -группой, варьируемая катионная группа которого способна пройти ко второму сужению ионного канала, в то время как Et3
-группой, варьируемая катионная группа которого способна пройти ко второму сужению ионного канала, в то время как Et3  -группа остаётся в области первого сужения. (б) - Ориентация молекулы блокатора (2) с постоянной Et3
-группа остаётся в области первого сужения. (б) - Ориентация молекулы блокатора (2) с постоянной Et3  -группой в русле канала в том случае, когда вторая катионная группа либо равна Et3
-группой в русле канала в том случае, когда вторая катионная группа либо равна Et3  -группе, либо превышает её размеры. (в) - Два типа возможной ориентации в русле ионного канала молекулы (1) с постоянной Me3
-группе, либо превышает её размеры. (в) - Два типа возможной ориентации в русле ионного канала молекулы (1) с постоянной Me3  -группой, которая расположена в области второго сужения, в то время как варьируемая катионная группа, меньшая, чем Me3
-группой, которая расположена в области второго сужения, в то время как варьируемая катионная группа, меньшая, чем Me3  , способна либо пройти через второе сужение, либо располагаться в области первого сужения. (г) - Два типа возможной ориентации в русле ионного канала молекулы (1) с постоянной Ме3
, способна либо пройти через второе сужение, либо располагаться в области первого сужения. (г) - Два типа возможной ориентации в русле ионного канала молекулы (1) с постоянной Ме3  -группой, обе катионные группы которой превышают размеры второго сужения.
-группой, обе катионные группы которой превышают размеры второго сужения.
Авторы провели сопоставление своих данных с результатами, полученными другими исследователями и другими методами [20, 23]. Выявилось близкое согласие между ними. При этом большее (8.3 х 6.1 Ǻ) сужение, как оказалось, соответствует «сериновому кольцу» холинорецептора, состоящему из остатков серина, а меньшее сужение (5.5 х 6.3 Ǻ) – «треониновому кольцу», которое, как полагают, является селективным фильтром. Расстояние между ними составляет около 7.5 Ǻ.
Предлагаемая топографическая модель участка связывания бис-катионных блокаторов определяет следующие требования для эффективного неконкурентного блока нейрональных никотиновых холинорецепторов: 1) блокатор должен встречать стерические препятствия на уровне серинового или треонинового колец, которые препятствуют его прохождению далее по каналу; 2) блокатор должен обладать достаточной комплементарностью к связующим сайтам, чтобы обеспечить эффективное гидрофобное и ион-дипольное взаимодействие обеих аммониевых групп с соответствующими нуклеофильными областями канала.
Подход, использованный в данной работе, открывает возможности для прицельного конструирования новых блокаторов нейрональных никотиновых холинорецепторов. Рассчитанные размеры сужений ионного канала могут быть полезными для дальнейших экспериментальных и теоретических исследований нейрональных никотиновых холинорецепторов. Важное преимущество изложенного подхода состоит в том, что полученные данные характеризуют рецептор в естественном функционирующем состоянии, тогда как при биохимических методах выделения и изоляции рецептора неизбежно нарушается нормальное физиологическое окружение рецептора и искажаются те или иные стороны его работы.
В целом, применение фармакохимического подхода представляет интерес в двух основных направлениях. Во-первых, в процессе исследования связи химической структуры с биологической активностью неизбежно познается строение биологической мишени, выявляется её топография. Полученные соединения могут послужить ценными инструментами исследования нейрональных холинорецепторов. Во-вторых, ускоряется поиск новых высокоэффективных лекарственных веществ.
4. Практически значимые катионные блокаторы нейронального никотинового рецептора.
Из всех исследованных дикатионов наибольшую блокирующую активность на симпатических ганглиях проявил ИЭМ-903, который превосходит по активности эталонный ганглиоблокатор гексаметоний в 9.4 раза на симпатическом и в 31 раз – на парасимпатическом ганглии (Табл. 7). В опытах на парасимпатическом ганглии наибольшую активность проявил дикатион ИЭМ-1316, в 56 раз более активный, чем гексаметоний [26]. ИЭМ-1460 из всех дикатионов оказался самым избирательным ганглиоблокатором в отношении парасимпатических ганглиев (19.8/0.3=66, табл. 7) [26].
Таблица 7. Активность наиболее эффективных и избирательных дикатионных и монокатионных ганглиоблокаторов.
| ИЭМ № | Формула | Относительная активность* (гексаметоний=1) | Литера-тура | |
| На симпати-ческом ганглии | На парасимпа-тическом ганглии | |||
| ИЭМ-903 | Me3  -(CH2)5-NPr2-i
Br HBr -(CH2)5-NPr2-i
Br HBr
| 9.4 | 31 | [3, 14, 15, 18, 32] |
| ИЭМ-1316 | 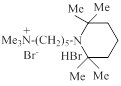
| 3.5 | 56.7 | [26, 32] |
| ИЭМ-1460 | 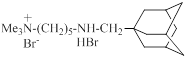
| 0.3 | 19.8 | [8, 11, 26, 32, 33, 34, 35, 36, 37] |
| ИЭМ-1678 | Decyl-NHBu-t HBr | 0.08 | 45 | [30, 35, 38] |
| ИЭМ-1194 | Decyl-NHPr2-i HBr | 0.2 | 70.2 | [26,32, 39, 40, 41] |
| ИЭМ-1559 | 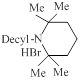
| 0.13 | 150.3 | [26, 32] |
| ИЭМ-1556 | 
| 0.17 | 72.6 | [27, 31, 38, 42, 43] |
*Активность гексаметония на верхнем шейном симпатическом ганглии кошки соответствует величине ЕD50=0.035 мкМ, а на парасимпатическом ганглии тонкой кишки морской свинки соответствует величине Кd=4.5×мкМ.
Поскольку наибольшую активность на парасимпатическом ганглии проявили дикатионы с высокогидрофобной катионной группой, были получены их монокатионные аналоги с децильным радикалом. Эти вещества неожиданно проявили очень высокую и избирательную блокирующую активность на парасимпатических ганглиях, в частности, ИЭМ-1194 оказался в 70 раз активнее гексаметония, а ИЭМ-1559 -в 150 раз (табл. 7), при этом ганглиоблокирующая активность ИЭМ-1194 на парасимпатическом ганглии превышает таковую на симпатическом ганглии более чем на два порядка (70.2/0.2=350), а в случае ИЭМ-1559 – на три порядка (150.3/0.13=1156) [26]. ИЭМ-1556 проявил очень высокую и избирательную активность на парасимпатических ганглиях сердца. В опытах на крысах in situ величина ED50 (4.2 мкг/кг), характеризующая блокирование дикатионом ИЭМ-1556 вагусного торможения сердца, была почти в 2000 раз ниже, чем при блокировании синаптической передачи через симпатический ганглий (7.3 мг/кг) [27].
Весьма необычным оказался механизм блокады децил-содержащих монокатионов. ИЭМ-1194 и ИЭМ-1559 сильно ингибируют ток в нейронах симпатических ганглиев, индуцированный ацетилхолином, при этом блокада сохранялась в течение нескольких часов после вымывания лекарств. Было обнаружено, что они блокируют никотиновый ацетилхолиновый рецептор исключительно с внешней стороны мембраны. Длинная гидрофобная цепь позволяет блокатору необратимо связываться с рецептором, а блокировка открытого канала осуществляется высокогидрофобной аммониевой группой блокатора [28]. ИЭМ-1194 и ИЭМ-1559 проявляют свой необычно длительный ганглиоблокирующий эффект при тестировании на целых животных, а также в изолированных органах [29]. Эта уникальная особенность длинноцепочечных моноаммониевых ганглиоблокаторов позволяет рассматривать их как очень эффективные и селективные агенты, блокирующие ганглии, что было зафиксировано в двух патентах. ИЭМ-1678 был предложен для лечения заболеваний, связанных с гипертонусом парасимпатического нерва, таких, как язвенная болезнь, бронхиальная астма, аритмия [30], а ИЭМ-1556 ‑ как средство с н-холинолитической, противопаркинсонической, противоэпилептической, анальгезирующей и антидепрессивной активностью [31]. В табл. 7 приводятся литературные ссылки о ганглиоблокирующих свойствах наиболее активных дикатионов [32-43].
Таким образом, использование дикатионов для изучения нейронального никотинового холинорецептора позволило выяснить некоторые элементы его структуры, но в практическом плане более интересными оказались монокатионные молекулы с высокогидрофобной аммониевой группой.
5. Дикатионы как инструменты исследования глутаматной рецепции.
Дикатионы как инструменты исследования, помимо холинорецепции, были также использованы в области глутаматной рецепции, но для этого пришлось существенно модифицировать их структуру. Дикатионы, имеющие простые алифатические радикалы при атомах азота, не обладали способностью блокировать ионные каналы глутаматных рецепторов. И только при введении в качестве заместителей более объёмных циклических радикалов возникли признаки антиглутаматной активности [33].
Интерес к проблеме продиктован тем, что аминокислота глутамат является основным возбуждающим медиатором в центральной нервной системе. Нарушения функции нейронов, вызванные патологическими процессами в глутаматергической синаптической передаче, обнаружены при многих неврологических заболеваниях. Они могут быть следствием избыточной активности глутаматных рецепторов при нарушениях мозгового кровообращения, травмах мозга, судорожном синдроме разного происхождения. Некоторые хронические нейродегенеративные заболевания, такие как болезнь Хантингтона, болезнь Альцгеймера, амиотрофический боковой склероз, деменция при СПИДе, наркомании, хронический алкоголизм, также сопровождаются отклонениями в деятельности глутаматных рецепторов. Повышенная активация ионотропных глутаматных рецепторов приводит к длительной деполяризации и входу избыточных количеств кальция в нейрон. Системы удаления кальция не справляются с такой нагрузкой, в результате развёртывается патологический процесс, который начинается с нарушений в работе митохондрий, являющихся энергетическими фабриками живых клеток, и завершается их гибелью.
Поэтому многочисленные усилия направлены на поиск нейропротекторов среди антагонистов глутаматных рецепторов. Какие антагонисты глутаматных рецепторов могут найти клиническое применение? Естественно, они должны быть избирательными, а именно, в терапевтических дозах взаимодействовать преимущественно с глутаматными рецепторами. Желательно также, чтобы их действие было направлено на определённый тип или подтип рецепторов. И, наконец, самое главное требование — чтобы их эффективность возрастала по мере увеличения числа активированных рецепторов, иначе говоря, чтобы их ингибирующее действие было минимальным в условиях нормальной физиологической активности глутаматергических систем, но было бы направлено на очаги патологически избыточного освобождения и действия глутамата.
У рецепторов есть два наиболее доступных для воздействия ингибиторами участка. Первый — это узнающий центр, где ингибитору приходится вступать в конкуренцию с ионами глутамата за обладание этим центром. Здесь прямая конкуренция: чем выше концентрация глутамата, тем выше должна быть концентрация конкурентного антагониста. Другой участок — ионный канал рецептора, где имеет место неконкурентное действие. Ингибиторы входят в уже открытый канал, подобно проникающим ионам, связываются с определёнными сайтами на его стенках, что приводит к блокаде проводимости через этот канал. В терапевтических дозах конкурентные антагонисты подавляют нормальную физиологическую активность глутаматергических систем сильнее, чем патологическую. Поэтому конкурентные антагонисты малоперспективны в качестве средств лечения нейродегенеративных заболеваний. Блокада каналов ионотропных глутаматных рецепторов, в особенности открытого состояния этих каналов, стратегически более правильна, поскольку ингибитор не воздействует на покоящийся канал, но существенно снижает суммарный глутамат-вызванный ионный ток с самого начала его генерации. Следовательно, поиск следует вести среди неконкурентных блокаторов, в частности блокаторов открытого канала ионотропных глутаматных рецепторов. Тем не менее пока только один лекарственный препарат, обладающий таким механизмом действия, — блокатор глутаматных рецепторов NMDA-типа мемантин — нашёл применение в клинической практике, преимущественно при лечении болезни Альцгеймера [44].
В настоящее время ионотропные рецепторы глутамата принято подразделять на три основных типа в соответствии с избирательным действием агонистов глутамата: NMDA, АМРА и каинатные [45]. Возбуждающая синаптическая передача в центральных глутаматергических синапсах в основном опосредуется рецепторами NMDA- и АМРА-подтипов. Рецепторы NMDA-типа всегда гетеромерны: они формируются с участием NR1 субъединицы в сочетании с одной из четырех (А—D) субъединиц NR2. Семейство АМРА-рецепторов включает субъединицы GluRl-4, которые могут формировать как гомомерные, так и гетеромерные рецепторы. Физиологические и фармакологические характеристики АМРА-рецепторов сильно зависят от присутствия в гетеромере субъединицы GluR2 [46, 47]. В этом случае резко падает проницаемость ионного канала для ионов кальция.
Наиболее узкая часть ионного канала (селективный фильтр) находится вблизи вершины внутримембранной М2 петли. Здесь расположены остатки, в значительной степени определяющие основные свойства канала: его проводимость, ионную селективность и взаимодействие с каналоблокаторами. Эту позицию обычно называют N/Q/R сайтом, поскольку все субъединицы NMDA-подтипа имеют здесь аспарагин (N), субъединицы GluRl, GluR3 GluR4 АМРА-рецепторов — глутамин (Q), а субъединица GluR2 — аргинин (R). Именно наличие аргинина определяет слабую проницаемость и блокируемость ионных каналов, включающих субъединицу GluR2, за счет электростатического отталкивания токонесущих и блокирующих катионов положительным зарядом боковой цепи аргинина.
Экспериментальное обнаружение высокой анти-АМРА активности дикатионных производных адамантана и 1-фенилциклогексила (табл. 8) явилось ценной находкой и позволило исследовать пространственное строение ионных каналов рецепторов глу-тамата и связанные с ним функциональные характеристики [9, 11, 12, 34, 48, 49].
Таблица 8.
Действие моно- и дикатионных соединений на NMDA и Са2+- проницаемые АМРА-каналы.
| Соединение | Структура | NMDA | АМРА |
| IC50, мкМ* | |||
| ИЭМ-1460 | 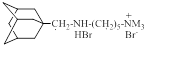
| 310 ±10 (n = 15) | 3.1 ±0.4 (n = 9) |
| ИЭМ-1754 | 
| 110 ±10 (n = 9) | 9.3 ±0.6 (n = 8) |
| ИЭМ-1925 | 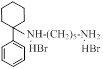
| 1.2 ±0.8 (n = 8) | 2.1 ±0.4 (n = 9) |
| ИЭМ-1618 | 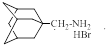
| 150 ±40 (n = 11) | >1000 |
| ИЭМ-1921 | 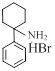
| 0.7 ±0.2 (n = 8) | >1000 |
*IC50 – (концентрация, вызывающая 50%-ный ингибирующий эффект на ионных каналах глутаматных рецепторов.
Обнаружение высокой анти-АМРА активности дикатионных производных адамантана ИЭМ-1460 и ИЭМ-1754 [34] поставило вопрос о том, какие структурные особенности этих соединений определяют их действие на АМРА-каналы. ИЭМ-1460 и ИЭМ-1754 включают в себя гидрофобное адамантановое ядро и дикатионную пентаметиленовую цепь. Замена адамантановой группы на другое гидрофобное ядро приводит к некоторому росту (ИЭМ-1925) анти-АМРА активности (табл. 6). Замена дикатионной цепи на монокатионную приводит к потере анти-АМРА активности. Различия в анти-NMDA активности между моно- и дикатионными соединениями были значительно менее выражены (табл. 6). Таким образом, наличие дикатионной цепи является необходимым условием блокады канала АМРА-рецептора.
На следующем этапе в двух сходных рядах дикатионных производных адамантана длина межазотной цепи варьировала. Результаты представлены на рис. 3.
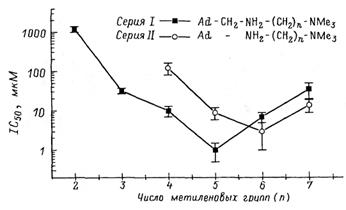
Рис. 3. Зависимость блокирующего действия дикатионных производных адамантана на АМРА-рецепторы в гигантских холинергических интернейронах стриатума от числа метиленовых групп между атомами азота (n).
Видно, что зависимость анти-АМРА активности от длины цепи имеет хорошо выраженный максимум (минимум экспериментально определяемой величины IС50), соответствующий пентаметиленовой цепи в серии I и гексаметиленовой — в серии II [11, 9]. Различие между этими сериями состоит в отсутствие метиленовой группы между адамантановым ядром и первым атомом азота в серии II. Таким образом, укорочение цепи в области гидрофобного ядра на одну метиленовую группу требует для восстановления максимальной активности введения дополнительной метиленовой группы в цепь между атомами азота. Этот факт позволяет сделать вывод, что связывание блокаторов в АМРА-канале определяется взаимодействием гидрофобного ядра блокатора с гидрофобной областью в канале и взаимодействием терминальной аммониевой группы с нуклеофильным участком [11, 9]. При этом оптимальное расстояние между центром гидрофобного ядра и терминальной аммониевой группой, составляющее около 10 Å, должно соответствовать расстоянию между гидрофобным и нуклеофильным участками в канале АМРА-рецептора. Топографическая модель такого связывания представлена на рис. 4, А. Монокатионные соединения имеют слишком короткую длину, чтобы одновременно взаимодействовать с обоими участками, потому проявляют слабую анти-АМРА активность (рис. 4, Б).
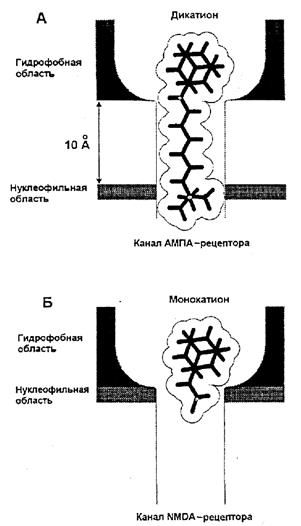
Рис. 4. Предполагаемая структура участков связывания моно- и дикатионов в каналах АМРА (А) и NMDA (Б) глутаматных рецепторов.
Гидрофобные и нуклеофильные области в канале NMDА-рецептора сопряжены друг с другом, что обеспечивает эффективную блокаду монокатионами. В канале ΑMPΑ-рецептора эти области разнесены на 10 Å, поэтому наиболее активными оказываются дикатионы соответствующей структуры (показано связывание ИЭМ-1460).
Таким образом, для блокады NMDA-каналов наличие второй аммониевой группы не играет критической роли. Варьирование межазотного расстояния в сериях I и II также не выявило значительных и систематических изменений анти-NMDA активности. Напротив, уменьшение расстояния между гидрофобной и аммониевой группами в ряде монокатионных соединений существенно усиливает их способность блокировать NMDA-каналы. Вероятно, в NMDA-канале гидрофобный и нуклеофильный компоненты участка связывания расположены близко друг к другу (рис. 4, Б), что обеспечивает высокую блокирующую активность разнообразных монокатионных соединений [9]. Следовательно, имеются существенное различие в строении NMDA- и АМРА-каналов, определяющее их блокируемость органическими катионами. Особенно важным представляется определение топографии АМРА-канала, что позволяет вести направленный синтез новых активных каналоблокаторов.
Использование методов молекулярного моделирования для сопоставления полученных топографических данных с литературными позволило определить молекулярные механизмы, контролирующие взаимодействие глутаматных рецепторов с органическими катионами [9]. В обоих типах каналов гидрофобный компонент участка связывания расположен вблизи селективного фильтра канала (N/Q/R сайта). В NMDA-канале остатки аспарагина (N) формируют нуклеофилыюе кольцо, с которым связываются аминогруппы разнообразных органических монокатионов. В АМРА-канале цикл, образуемый остатками глутамина (Q), не содержит нуклеофильных групп, доступных для взаимодействия с блокирующими ионами. Нуклеофильный компонент участка связывания в АМРА-каналах формируется атомами кислорода остатков глицина в положении +2 относительно N/Q/R сайта. Блокаторы, обладающие различным уровнем избирательности относительно АМРА- и NMDA-рецепторов, могут быть использованы в дальнейшем как инструменты в физиологических исследованиях, а также явиться прототипами лекарственных средств антиглутаматного действия.
6. ИТОГИ И ПЕРСПЕКТИВЫ.
Глутамат играет ключевую роль в нескольких физиологических функциях, включая развитие нейронов, нейропередачу, сенсорное восприятие и события синаптической пластичности, лежащие в основе памяти и обучения [50]. С другой стороны, аномальная передача сигналов глутамата участвует в патогенезе состояний острого повреждения головного мозга, таких как инсульт, эпилепсия и травма головы, а также в хронических нейродегенеративных заболеваниях, включая боковой амиотрофический склероз, болезнь Паркинсона и болезнь Альцгеймера. Хотя избыточная передача сигналов глутамата связана с гибелью клеток, глутамат выполняет важную трофическую функцию в развитии ЦНС, регулируя пролиферацию и миграцию предшественников нейронов [51].
Экспрессия субъединиц ионотропных глутаматных рецепторов была также продемонстрирована в опухолевых клетках, происходящих из нервной ткани, таких как клетки глиомы, глиобластомы, медуллобластомы и нейробластомы [52, 53, 54, 55, 56]. Активация AMPA рецептора глутаматом вызывает колебания внутриклеточного кальция [56], что, как полагают, играет решающую роль в росте и подвижности глиобластомы, наиболее агрессивной злокачественной первичной опухоли головного мозга у людей. Показано, что AMPA рецепторы способствуют прогрессированию опухоли при нескольких видах рака, включая глиобластому [57, 58, 59, 60, 61] и гепатоцеллюлярную карциному [62].
Установлено, что сверхэкспрессия кальций-проницаемого AMPA рецептора способствует миграции и пролиферации клеток глиобластомы, и что преобразование кальций-проницаемого в кальций-непроницаемый AMPA рецептор ингибирует клеточное перемещение и индуцирует апоптоз клеток глиобластомы [54]. Следовательно, антагонисты ионотропных глутаматных рецепторов представляют интерес в качестве потенциальных противоопухолевых терапевтических агентов. Антагонист NMDA рецептора MK-801 и антагонист AMPA рецептора GYKI52466 снижали пролиферацию клеточных линий астроцитомы мозга человека, нейробластомы человека, саркомы человека и медуллобластомы [63]. Кроме того, MK-801 замедляет рост нейробластомы и саркомы у мышей [64].
Сообщалось, что антагонисты NMDA и AMPA рецепторов ограничивают пролиферацию нескольких ненейрональных раковых клеток, включая толстую кишку [63], гортань [65], молочную железу [66], гепатоцеллюлярную карциному [67], простату [68], меланому [69, 70], легкое [71], щитовидную железу, глиальные и нейрональные опухоли [63].
При агрессивной глиобластоме раковые клетки образуют синапсы (или соединения) с нейронами и получают электрические сигналы от здоровых нервных клеток, что стимулирует их собственный рост [72]. В клетках глиомы отсутствуют NMDA-рецепторы, но они экспрессируют Са-проводящие AMPA-рецепторы, которые стимулируются глутаматом аутокринным и паракринным способом, способствуя росту и инвазии опухоли. Установлено, что у пациентов с глиомой перитуморальные (околоопухолевые) уровни глутамата повышены в 100 раз по сравнению с неповрежденным мозгом [73, 74] и ингибирование AMPA рецепторов могло бы замедлить рост глиомы. Прерывание этих сигналов противоэпилептическим препаратом перампанелом значительно уменьшило рост рака в опухолях человека, имплантированных мышам, предоставляя первое доказательство возможного нового способа лечения глиом.
Перампанел, единственный AMPA-блокатор, допущенный к клинику как антиэпилептик, имеет ряд побочных эффектов. Его лечебная доза вплотную граничит с дозой, вызывающей побочные эффекты, что отмечают сами авторы препарата [75]. Можно сравнить терапевтическое окно перампанела с таковым для синтезированного нами комбинированного (NMDA+AMPA) блокатора ИЭМ-1913. Терапевтический индекс ИЭМ-1913 равен 6430 (ТИ ‑ отношение токсической дозы (мг/кг), вызывающей гибель 50% мышей (ЛД50) к дозе (мг/кг), предупреждающей клонико-тонические коразоловые судороги у 50% крыс (ЕД50), ТИ= ЛД50/ЕД50=193/0.03=6430 [76, 77, 78]. Тогда как у перампанела ТИ близок к единице. Другим недостатком перампанела является нерастворимость в воде, он применяется только внутрь. У перампанела наблюдаются такие осложнения, как нарушение памяти, когнитивные и двигательные нарушения, атаксия, усталость, головокружение. Полагают, что причиной является влияние AMPA-блокаторов, подобных перампанелу, на индукцию LTP и LDP [79]. Перампанел и другие блокаторы этой группы блокируют не только GluA1 (что способствует лечебному эффекту), но и GluA2 (что вызывает побочные эффекты, поскольку GluA2 важен для памяти и обучения). AMPA блокатор ИЭМ-1460 избирательно блокирует только GluA1 AMPA рецепторы, не затрагивая GluA2 AMPA рецепторы, а комбинированные (NMDA+AMPA) блокаторы типа ИЭМ-1913 или ИЭМ-2062 препятствуют эксайтотоксичности, одновременно блокируя как GluA1 AMPA-, так и NMDA-рецепторы.
Возможно совместное введение глутаматных блокаторов вместе с препаратами платины и другими цитостатическими химиопрепаратами для профилактики и лечения нейропатической боли у онкологических больных и уменьшения побочных эффектов химиотерапии опухолей. Важно устранить побочные эффекты платины еще в острой фазе. Суть метода не столько в обезболивающем действии, которое доказано для ИЭМ-1460, ИЭМ-1913, ИЭМ-2062, ИЭМ-2121 [76, 80, 81, 82], сколько в их регенеративных свойствах, в способности защищать и восстанавливать нервные волокна при повреждении их цитостатиками, в частности, препаратами платины. В отличие от действия типичных цитостатиков, глутаматные блокаторы действуют по другому механизму, более избирательному, блокируя глутаматные функции, необходимые для роста раковой опухоли.
Синтезированные нами дикатионы ИЭМ-1913, ИЭМ-2062, ИЭМ-1460, ИЭМ-2121 проявляют свойства анальгетиков и антидепрессантов, что может быть немаловажным преимуществом для онкологических больных, и они же являются противосудорожными агентами, что особенно актуально для больных с глиомой мозга, страдающих судорогами [76, 78, 80, 83, 84]. Ряд синтезированных нами веществ, в том числе ИЭМ-1913, проявил активность в лечении экспериментального аллергического энцефаломиелита (ЭАЭ), что также свидетельствует в пользу возможного противопухолевого действия [85]. Причём указанные глутаматные блокаторы в предварительных экспериментах показали эффективность не только при остром, но и хроническом оральном введении, что увеличивает их перспективность в клиническом плане.
Глутаматные блокаторы проявили также антивирусные свойства. Было проведено исследование, которое показало, что опосредованная глутаматом эксайтотоксичность является основной причиной гибели нейронов во время энцефаломиелита, вызванной инфекцией нейронотропным вирусом, и что выживаемость нейронов увеличивается при лечении антагонистами глутаматных рецепторов [86]. Блокада АМРА или NMDA подтипов глутаматных рецепторов увеличивала выживаемость нейронов гиппокампа у NSV-инфицированных мышей, но только блокада АМРА-рецепторов предотвращала повреждение двигательных нейронов спинного мозга и защищала мышей от тяжелого паралича [86]. Ca - проницаемые АМРА-рецепторы присутствуют в моторных нейронах спинного мозга [87, 88]. Хотя эти нейроны также имеют рецепторы NMDA, только антагонист рецептора AMPA GYKI-52466 защищал двигательные нейроны спинного мозга от повреждения и предотвращал вызванную NSV гибель мышей. Таким образом, смертность от инфицирования этим вирусом более тесно связана с повреждением мотонейронов спинного мозга, чем с повреждением нейронов гиппокампа. Мемантин значительно снижал частоту паралича, вызванную вирусом Зика [89]. Мемантин и амантадин могут потенциально снизить вирулентность SARS-CoV-2 [90, 91].
Важно отметить следующее. Любой патологический процесс сопровождается эксайтотоксичностью (как следствие избытка глутамата в синапсе), и чем больше этот избыток (чем тяжелее болезнь), тем выше лечебная роль глутаматных блокаторов, что связано с особенностями их механизма действия. При невысокой частоте синаптической активности, которая в нормальных условиях чаще имеет место, блокада выражена слабо. А при высокочастотной активации, которая наблюдается в эпилептоформных процессах, действие блокатора усиливается, что может избирательно предотвращать негативные последствия такой активации [92, 93].
Трудности создания эффективных противовирусных вакцин в определенном смысле сходы с трудностями создания новых антибиотиков. Противодействуя микробам и вирусам, мы ускоряем их отбор и проигрываем в конкуренции с природой. Но у болезней, вызванных микробами и вирусами, есть одно общее звено ‑ глутаматная эксайтотоксичность, и глутаматные блокаторы ей препятствуют. В опытах на животных, упомянутых выше, мы показали высокую эффективность глутаматных блокаторов при лечении ряда нервных патологий, которые сопровождаются эксайтотоксичностью. Представляет интерес проверить их лечебные эффекты в отношении болезней, вызванных микробами и вирусами, поскольку подобные опыты не проводились с избирательными GluA1 AMPA блокаторами типа ИЭМ-1460 или с комбинированными (NMDA и AMPA) глутаматными блокаторами типа ИЭМ-1913 и ИЭМ-2062. Эксайтотоксичность опосредуется как НМДА, так и АМПА рецепторами, поэтому комбинированные (NMDA+AMPA) рецепторы представляют особый интерес как потенциальные защитные средства при лечении онкологических и вирусных патологий.
ЛИТЕРАТУРА
1. Р. Барлоу. Введение в химическую фармакологию, пер. с англ., ИЛ, Москва (1959).








