Определение теплоты реакции нейтрализации
| Зачтено ____ _____________ баллы подпись | Ф.И.О. ________________________ студента |
| "___" __________ 20___г | группа___________________ |
Лабораторная работа № 1.
Определение теплоты реакции нейтрализации
сильной кислоты сильным основанием.
Цель : Определить тепловой эффект реакции нейтрализации НCl щелочью NaOH.
Приборы и реактивы : Калориметр, термометры, мерные цилиндры, пробирки; 0,25н NaOH; 3н НCl; дистиллированная вода.
Теоретическая часть.
Тепловой эффект реакции нейтрализации сильной кислоты сильным основанием в разбавленных растворах практически не зависит от химической природы кислот и оснований. Например, для двух реакций
HCl + NaOH ® NaCl +H2O ; ΔН 1 ( А )
HNO3 + KOH ® KNO3 + H2O ; ΔН 2 ( Б )
изменения энтальпии одинаковы
ΔН1 = ΔН2 = -57,3 кДж/моль (при 20ºС) или -13,7ккал
(1 ккал составляет » 4,2 кДж),
хотя природа реагирующих веществ и продуктов реакции совершенно различна (за исключением получающейся в результате обеих реакций воды).
Представление об ионах позволило свести реакции (А) и (Б) к одному и тому же процессу,
Н+ + ОН- ®Н2О
или Н+(р-р) + ОН-(р-р) → Н2О(ж) (В)
который сопровождается определенным тепловым эффектом.
Таким образом, то количество тепла, которое выделяется при образовании 1 моля воды из Н+ (Н3О+) и ОН- при стандартных условиях, называется теплотой нейтрализации.
Для определения теплового эффекта реакции нейтрализации необходимо брать один моль эквивалента кислоты, нейтрализовать его одним молем эквивалента основания и измерить количество выделяемой теплоты.
Чтобы определить эту величину как можно точнее, необходимо провести реакцию нейтрализации так, чтобы, выделяемая, теплота не рассеивалась в окружающую среду. Для этого необходимо провести реакцию в термостате. Так как во время реакции выделается теплота, температура смеси увеличивается. Измеряя увеличение температуры, и зная теплоемкость, можно вычислить количество выделяемой теплоты:
Q = Cк(t2 –t1) (1)
где Q – количество выделившейся теплоты; Ск – теплоемкость калориметра;
t1 – температура до реакции; t2 – температура после реакции.
В теплоту, выделяемую при вливании раствора кислоты в раствор щелочи, помимо теплоты нейтрализации, входят теплоты разведения кислоты щелочью и щелочи кислотой. Если объем раствора щелочи велик и мало изменяется от прибавления к нему кислоты, то теплота разведения щелочи кислотой мала и ею можно пренебречь. Напротив, теплота разбавления кислоты щелочью может достигнуть 10% от теплоты нейтрализации и поэтому ее нужно учесть.
Теплоту разбавления (Qразб.) определяют, вливая раствор кислоты (в таком же количестве как и при нейтрализации) в чистую воду, взятую в том же объеме, что и щелочь.
Так как реакция разбавления соляной кислоты (или любой другой) – экзотермическая, то для нахождения теплоты нейтрализации следует теплоту разбавления вычесть из суммарной теплоты процесса:
Qнейтр. = Q – Qразб. (2)
Для экспериментального определения теплоты нейтрализации (теплового эффекта реакции нейтрализации) не обязательно брать 1 моль-эквивалент кислоты и 1 моль-эквивалент основания. Можно взять меньшее количество кислоты и соответственно основания (но только эквивалентные количества), определить количество выделяемой теплоты с учетом разбавления и затем пересчитать найденную теплоту на один моль эквивалента вещества (кислоты или основания). Это и будет теплота нейтрализации или тепловой эффект реакции нейтрализации (ΔН).
Экспериментальная часть.
1. Налить в калориметр 150 мл 0,25н раствора NaOH.
2. В мерный цилиндр налить 12,5 мл раствора 3н НCl (эквивалентное количество кислоты).
3. Цилиндр с соляной кислотой поместить на 15-20 мин в калориметр, чтобы температура кислоты и основания были одинаковыми.
4. С помощью термометра Бекмана измерить температуру раствора NaOH (t1). После этого постепенно влить раствор кислоты в раствор основания и вновь произвести измерение температуры t2. Определить наивысшую температуру после сливания растворов.
Температура раствора NaOH t1 = ______________________.
Температура после нейтрализации t2 = _________________.
5. По уравнению (1) рассчитать количество теплоты, учитывая, что теплоемкость калориметра равна
ck = 180 кал/град.
Q = Cк(t2 –t1) = ____________________________________________________
_______________________________________________________________
Но это еще не теплота нейтрализации, так как мы не брали 1 моль эквивалента кислоты и 1 моль эквивалента основания, а брали только по 0,0375моль эквивалента вещества.
6. Для более точного определения теплоты нейтрализации необходимо учесть теплоту разбавления. Поэтому надо повторить работу (согласно пунктам 1-5), но вместо раствора основания взять 150 мл воды. И по уравнению (1) рассчитать теплоту разбавления кислоты.
ck = 180 кал/град.
Q = Cк(t2 –t1) = ____________________________________________________
_______________________________________________________________
7. Теплота нейтрализации находится как разность суммарной теплоты процесса нейтрализации и теплоты разбавления по уравнению (2).
Qнейтр. = Q – Qразб = _____________________________________________.
8. Теплоту нейтрализации в расчете на 1 моль вещества (∆Н) необходимо найти по пропорции:
0,0375 моль-экв. ………………………….выделяет Q кал
1 моль-экв. ………………………….. выделяет x кал
X = _________________________________________________________________
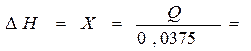 ________________________________________
________________________________________
___________________________________________________________________
Установить относительную погрешность (в %), если теоретическое значение теплового эффекта реакции нейтрализации для 1 моля соляной кислоты щелочью равняется 57,3 кДж.
Вывод:________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________








