Концентрированные растворы: HCl, H2SO4, Cl2∙aq (хлорная вода), Br2∙aq (бромная вода), CCl4, H2S, Hg2(NO3)2, NaOH, KIO3, K[I(I)2].
| ДИСЦИПЛИНА | Общая и неорганическая химия |
| полное название дисциплины без аббревиатуры | |
| ИНСТИТУТ | Тонких химических технологий |
| КАФЕДРА | Кафедра неорганической химии имени Реформатского А. Н. |
| полное название кафедры | |
| ГРУППА/Ы | ХЕБО-01-20 - ХЕБО-19-20, ХББО-01-20 - ХББО-05-20, ХХБО-01-20 - ХХБО-04-20, ХТБО-01-20 - ХТБО-02-20, ТЛБО-01-20 - ТЛБО-03-20 |
| номер групп/ы, для которых предназначены материалы | |
| ВИД УЧЕБНОГО | Лабораторные работы |
| МАТЕРИАЛА | лекция; материал к практическим занятиям; контрольно-измерительные материалы к практическим занятиям; руководство к КР/КП, практикам |
| ПРЕПОДАВАТЕЛЬ | Рукк Н.С., Кудряшова З.А., Савинкина Е.В., Кочетов А.Н., Давыдова М.Н., Дорохов А.В., Матвеев Е.Ю., Ефремова Е.И., Климова Э.В., Крынкина С.В., Караваев И.А., Кобрин М. Р., Стогний М. Ю. |
| фамилия, имя, отчество | |
| СЕМЕСТР | I |
| указать номер семестра обучения |
Лабораторная работа 6. Химия элементов VIIA-группы (часть 1)
Оборудование, материалы и посуда: пробирки центрифужные, фарфоровые тигли, грушевидные колбы, газоотводные трубки, штатив, круглодонные колбы, склянки Страшейна, фильтровальная бумага, стеклянные палочки.
Реактивы
Концентрированные растворы: HCl, H2SO4, Cl2∙aq (хлорная вода), Br2∙aq (бромная вода), CCl4, H2S, Hg2(NO3)2, NaOH, KIO3, K[I(I)2].
Разбавленные растворы: KI, NaBr, CuSO4, H2SO4, H2SO4, NaCl, NaF, NaOH.
Твердые вещества: KMnO4, K2Cr2O7, MnO2, NaCl, NaBr, KI, I2.
Ход выполнения работы
6.1. Простые вещества
6.1.1. Получение простых веществ (Внимание, работать в вытяжном шкафу при включенной вентиляции!)
П1. В пробирку шпателем насыпьте несколько кристалликов перманганата калия, прилейте 10 капель концентрированной соляной кислоты. Пробирку нагрейте. Отметьте его окраску выделяющегося газа. Фильтровальную бумагу смочите 1 каплей раствора иодида калия и поднесите к пробирке с выделяющимся газом. Как изменяется её окраска?
П2. В пробирку шпателем насыпьте несколько кристалликов дихромата калия, прилейте 10 капель концентрированной соляной кислоты. Пробирку нагрейте. Наблюдается выделение газа. Отметьте его окраску. Фильтровальную бумагу смочите 1 каплей раствора иодида калия и поднесите к пробирке с выделяющимся газом. Как изменяется её окраска?
П3. В пробирку шпателем насыпьте несколько кристалликов оксида марганца(IV) и твердого хлорида натрия, перемешайте встряхиванием. Прилейте 4 капли концентрированной серной кислоты и нагрейте. Наблюдайте выделение газа. Отметьте его окраску. Фильтровальную бумагу смочите 1 каплей раствора иодида калия и поднесите к пробирке с выделяющимся газом. Наблюдайте изменение окраски.
Установка 1 (У1) (рис. 1). Твердые оксид марганца(IV) и бромид натрия перемешайте на часовом стекле и внесите в колбу. Прилейте в колбу 10 капель конц. серной кислоты и нагрейте. Наблюдайте выделение пара. Какого цвета пары брома? Пропустите пары в воду (используйте полученный раствор в опыте 6.1.2); отметьте окраску раствора.
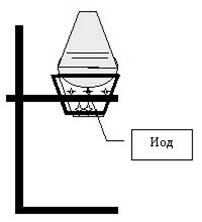
Установка 2 (У2) (рис. 2). Твердые оксид марганца(IV) и иодид натрия смешайте в фарфоровом тигле; прилейте в тигель 10 капель концентрированной серной кислоты и нагрейте. Наблюдайте выделение паров иода. Какого цвета пары иода? На тигель с выделяющимися парами иода установите круглодонную колбочку с холодной водой. На внешней поверхности круглодонной колбы наблюдайте рост кристаллов иода (используйте в 6.1.2); отметьте их окраску и вид.
Вопросы и задания. Что общего между реакциями, относящимися к п. 7.1.1? Рассчитайте разность стандартных потенциалов для соответствующих полуреакций. Соблюдается ли критерий протекания окислительно-восстановительных реакций в стандартных условиях? Почему рекомендовано использование твердых реагентов и концентрированных растворов кислот? Какова роль нагревания?
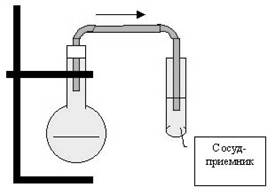
| 
|
| Рис. 1. Установка для получения брома и хлороводорода. | Рис. 2. Установка для получения иода. |
6.1.2. Взаимодействие с водой
П1. Измерьте рН хлорной воды (раствор хлора в воде).
П2. Измерьте рН бромной воды (раствор брома в воде, см. 6.1.1, У1).
П3. В пробирку шпателем насыпьте несколько кристалликов дииода (полученного в опыте 6.1.1, У2). Прилейте 5 капель воды. Наблюдается ли растворение иода в воде? Измерьте рН.
П4. В пробирку П3 прилейте по каплям раствор, содержащий иодид-ионы. Как меняется окраска раствора? Раствор используйте в п. 6.2.1.
Комментарии. Чем обусловлена кислотная среда растворов П1 и П2? Напишите уравнения протекающих реакций. Сравните протолитические свойства хлороводорода и хлорноватистой кислоты.
Какое вещество останется в растворе после 2–3 суток хранения хлорной воды в открытом сосуде? По результатам опытов сравните степень дисмутации простых веществ в воде и объясните, почему не идет реакция в П3. Какова причина перехода иода в раствор в присутствии иодид-иона? Запишите уравнение реакции комплексообразования. Назовите растворимый продукт в П4.
6.1.3. Растворимость в органическом растворителе
П1. В пробирку с бромной водой (используйте раствор из опыта 6.1.2, П2) прилейте 2 капли органического растворителя, не смешивающегося с водой. Встряхните. Какова окраска водной и органической фазы после отстаивания?
П2. В пробирку с иодом и водой (см. опыт 6.1.2, П3) прилейте 2 капли органического растворителя. Встряхните. Как меняется окраска водной и органической фазы после отстаивания?
Вопросы и задания. Сравните различное отношение диброма и дииода к воде и к органическому растворителю. Обратите внимание на различия в окраске органической фазы после экстракции (извлечения) галогенов из водной фазы в органическую.
Лабораторная работа 6. Химия элементов VIIA-группы (часть 2)
6.1.4. Окислительные свойства
П1. В пробирку прилейте 5 капель хлорной воды, 2 капли раствора, содержащего бромид-ионы, и 2 капли органического растворителя, не смешивающегося с водой. Встряхните. Как меняется окраска водной и органической фазы после отстаивания реакционной смеси?
П2. В пробирку прилейте 5 капель хлорной воды, 2 капли раствора, содержащего иодид-ионы, и 2 капли органического растворителя, не смешивающегося с водой. Встряхните. Как меняется окраска водной и органической фазы после отстаивания реакционной смеси?
П3. В пробирку прилейте 5 капель бромной воды, 2 капли раствора, содержащего иодид-ионы, и 2 капли органического растворителя, не смешивающегося с водой. Встряхните. Как меняется окраска водной и органической фазы после отстаивания реакционной смеси?
Вопросы и задания. Какой продукт переходит в органическую фазу в каждом из рассмотренных случаев? Учтите, что органический растворитель не участвует в химической реакции. Сравните с результатами опыта 6.1.3. Как в ряду хлор – бром – иод меняются окислительные свойства дигалогенов? При ответе используйте значения стандартных потенциалов.
6.2. Галогениды
6.2.1. Получение (Внимание: работать в вытяжном шкафу при включенной вентиляции!)
Установка 1 (У1) (см. занятие 13, рис. 1). В реакционную колбу внесите твердый хлорид натрия и 15 капель концентрированной серной кислоты. Нагрейте. Наблюдайте выделение газа. Пропустите газ через воду в сосуде-приемнике. Раствор используйте в опытах 6.2.1, П1 и П2.
П1. К 5 каплям раствора (см. У1) добавьте индикатор и измерьте рН.
П2. К 5 каплям раствора (см. У1) добавьте 2 капли раствора нитрата ди-ртути Hg2(NO3)2. Отметьте цвет и внешний вид образовавшегося осадка.
П3. К 4 каплям бромной воды прилейте по каплям сероводородную воду (до обесцвечивания). Нагрейте реакционную смесь. Отметьте цвет и внешний вид образовавшегося осадка. Раствор разделите на две порции и используйте в опытах П4 и П5.
П4. Измерьте рН раствора, полученного в П3.
П5. К раствору (см. П3) прилейте 2 капли раствора нитрата диртути Hg2(NO3)2. Отметьте цвет и внешний вид образовавшегося осадка.
П6. В пробирку внесите 5 капель «иодной воды» (см. опыт 6.1.2, П4) добавьте по каплям сероводородную воду (до обесцвечивания).
Нагрейте до кипения. Наблюдайте выпадение осадка. Отметьте цвет и внешний вид образовавшегося осадка. Раствор разделите на две порции и используйте в опытах П7 и П8.
П7. Измерьте рН раствора, полученного в П6.
П8. К раствору (см. П6) прилейте 2 капли раствора соли свинца(II). Отметьте цвет и внешний вид образовавшегося осадка.
Вопросы и задания. Каков состав осадка и растворов в опытах П3 и П6; рН растворов галогеноводородов и тип среды в П1, П4 и П7? Охарактеризуйте протолитические свойства галогеноводородов. Почему для получения бромоводорода и иодоводорода непригодны реакции, аналогичные использованной для хлороводорода (Установка 1)? Для ответа привлеките значения стандартных потенциалов и результаты опытов 7.2.2. Какими еще способами можно получить бромоводород и иодоводород в лаборатории? Каковы условия осаждения галогенидов ртути(I) и свинца(II) в П2, П5 и П8 с учетом ПР?
6.2.2. Восстановительные свойства








