4. В форме кинетической энергии молекул и атомов.
6. Механизм взаимодействия фотонов с молекулой (атомом)
Все эти формы образуются в результате химических взаимодействий на микроуровне. По этой причине требуется рассмотреть механизм взаимодействия фотонов с молекулой (атомом) и ответить на вопросы, которые мы ставили в начале нашей работы:
1) Почему некоторые фотоны поглощаются, а некоторые фотоны не поглощаются?
2) Почему некоторые из поглощаемых фотонов приводят к химической реакции, а некоторые фотоны дают только возбуждение молекул, и теряются, передаваясь другим молекулам при ударах второго рода или излучаясь в виде люминесценции?
Внимательные читатель обратит внимание, что эти вопросы тесно связаны с фундаментальным вопросом, который был сформулирован во введении к нашей работе: «Куда девается лучистая энергия и как она начинает вновь функционировать?».
Сформулированные выше вопросы являются естественным продолжением поиска решения проблемы на атомно-молекулярном уровне.
Ответ на первый вопрос довольно прост — каждая молекула поглощает те и только те фотоны, которые соответствуют спектру поглощения этой молекулы.
Ответ на второй вопрос сравнительно прост для атомарных спектров благородных газов, где он проявляется в чистом виде.
7. Эффект нагревания и химическая реакция
Если резонансный фотон не достигает энергии фотоионизации, то мы имеем дело с физическим процессом, который является эффектом НАГРЕВАНИЯ. Энергия поглощенного фотона будет обнаруживаться как КИНЕТИЧЕСКАЯ ЭНЕРГИЯ молекулы.
Если резонансный фотон соответствует частоте фотоэффекта, то наблюдается ХИМИЧЕСКИЙ процесс, так как из электрохимии известно, что процессы потери или приобретения электронов являются ХИМИЧЕСКИМИ РЕАКЦИЯМИ. Энергия поглощенного фотона будет обнаруживаться как ПОТЕНЦИАЛЬНАЯ ЭНЕРГИЯ молекулы.
8. 8. Резонансные частоты фотоэффекта
Для многоатомных газов к спектру поглощения, связанному с поглощением света и переходом электрона в возбужденное состояние, дополняется переходами не только электронов, но вращательными и колебательными спектрами этой молекулы. Однако и в этом случае, хотя число спектральных линий резко возрастает, имеет место поглощение фотона только тех частот, которые соответствуют спектру (резонансным частотам) той же самой молекулы. Здесь химическая реакция может быть связана не только с чистым фотоэффектом по отношению к электрону, но с фотодиссоциацией молекул.
9. Эффект парциального давления газа
Описанный выше эффект возможности передачи энергии от молекулы к молекуле в соответствии со спектром поглощения является основанием к наблюдаемому эффекту ПАРЦИАЛЬНОГО ДАВЛЕНИЯ ГАЗА.
Известно, что закон парциального давления газа был установлен еще Дальтоном в 1800 г., который пытался объяснить выпадение дождя, когда барометрическое давление падает. Дальтона, как и его современников, мучил вопрос: «Почему при падении барометрического давление собственное давление паров воды может увеличиваться и достигать точки росы, что и приводит к выпадению дождя?»
Дальтон ввел ДВА предположения:
1. Каждый из газов в атмосфере состоит из определенного вида АТОМОВ (Дальтон рассматривал как ПРОСТЫЕ, так и СОСТАВНЫЕ атомы). Это положение Дальтона и привело к нашим представлениям об атомарном строении вещества. Но из этого предположения выпадение дождя вовсе не следует. Суть в том, что это было не ЕДИНСТВЕННОЕ предположение.
2. Каждый вид атомов оказывает ОТТАЛКИВАТЕЛЬНОЕ действие только на подобные себе атомы, что дает возможность каждому виду атомов иметь ДАВЛЕНИЕ, которое не зависит от давления атомов другого вида.
Это предположение Дальтона вызвало критику и было отвергнуто. Сам Дальтон предполагал, что эти специфичные отталкивательные силы, которые действуют между атомами одного вида, напоминают магнитную силу, которая действует на одни тела и не оказывает действия на другие. Все попытки Дальтона защитить второе предположение оказались неудачными. Наука сохранила только первое предположение и отвергло второе. Ведь из второго предположения следовало, что существует столько разновидностей отталкивательных сил, сколько существует разных видов атомов.
Изложенное выше о возможности поглощения только резонансных фотонов, соответствующих собственным частотам данной молекулы, ОПРАВДЫВАЕТ и второе предположение Дальтона. Не следует забывать, что предположения Дальтона были предметом дискуссии в 1801—1807 годах, когда в физике господствовал ТЕПЛОРОД, а в химии — ФЛОГИСТОН.
Уточним формулы, которые должны описывать химические процессы, проходящие под действием резонансных фотонов, то есть такого излучения, которое соответствует спектру поглощения участников реакции. Мы будем исходить из ОСНОВНОГО СОСТОЯНИЯ, так как многоступенчатые переходы приводят к тому же эффекту.
С другой стороны, среди всех возможных актов поглощения фотонов молекулами газов из ОСНОВНОГО СОСТОЯНИЯ, мы выделим только одну частоту, которую будем называть «ЧАСТОТА ФОТОЭФФЕКТА». Именно эту частоту, которая вызывает фотоэффект, молодой Альберт Эйнштейн еще в 1905 году посчитал важнейшей фотохимической константой.
Совершенно очевидно, что имеется кардинальное различие между поглощением фотона с частотой МЕНЬШЕЙ, чем частота фотоэффекта, и частотой, превосходящей эту частоту.
Если частота меньше, то мы имеем ФИЗИЧЕСКИЙ эффект НАГРЕВАНИЯ, если частота превосходит этот порог, то мы имеем дело с ХИМИЧЕСКОЙ РЕАКЦИЕЙ.
Может быть, эта константа и разделяет диссипативные и антидиссипативные процессы и образует физико-химический фундамент для объяснения явлений неустойчивого равновесия, связанного с критической ситуацией первого рода?
10. Фотоника
Так как отсутствует название для фотохимических реакций, где уравнения и константы равновесия пишутся с участием фотонов определенных длин волн или определенных частот, то теоретическое описание таких реакций мы будем называть ФОТОНИКОЙ.
Запишем традиционно химическую реакцию между АТОМАМИ натрия и хлора:
Na0 + Cl0 = NaCl + Q. (4.3)
Здесь Q —тепловой эффект реакции.
11. Фотохимическое равновесие
Как отмечалось выше, эта запись химической реакции страдает отсутствием ПОЛНОТЫ. В ней нет места излучению, которое является непременным участником ЛЮБОЙ химической реакции. Фотохимическое равновесие предполагает наличие непрерывного потока лучистой энергии с заданной частотой или длиной волны. Физический смысл новой константы равновесия — поперечное сечение захвата фотона.
Аналогичное понятие пока существует лишь в ядерной физике, где поперечное сечение захвата нейтрона зависит от энергии нейтрона, которую тоже (по соотношению де Бройля) можно рассматривать как частоту или длину волны, связанную с нейтроном. Подобно тому, как существуют резонансы в ядерной физике, существуют подобные резонансы и в обычной химии: спектр резонансных частот и есть действительный спектр соответствующей молекулы.
Хотя это было очень давно, но один из собеседников, будучи физиком-теоретиком, отрицал возможность поглощения фотонов отдельными атомами, ссылаясь на геометрическую оптику: длина волны во много раз больше поперечного сечения любого атома, и такая волна «должна огибать препятствие столь малого размера». Пришлось сослаться на атомный абсорбционный анализ, где излучение натриевой лампы почти в три тысячи раз больше размера атома или иона натрия, но поперечное сечение захвата столь велико, что резонансная линия сильно поглощается натрием из пламени, расположенного между лампой и приемником излучения. Поскольку речь идет о весьма уважаемом физике-теоретике, то можно понять сколь маловероятно знание такого рода фактов из физических методов химического анализа для рядовых физиков. Другим примером являются оптико-акустические газоанализаторы. Это приборы, которые преобразуют резонансное излучение, различное в различных камерах, в колебания мембраны, то есть в звуковой эффект.
12. Уравнение реакций
Запишем уравнение реакции между фотоном и нейтральным атомом натрия.
Полная запись с участием фотонов приобретает вид:
Na0 + h n1 = Na+ + e-. (4.4)
Сделанная запись показывает, что атом натрия (свободный) не может сам отдать электрон и превратиться в ион натрия, так как отрыв электрона требует выполнения «работы выхода», которая и совершается под действием фотона с частотой n1. Нижний индекс — 1 — характеризует частоту, которая необходима для отрыва электрона.
Эта частота — является важнейшей КОНСТАНТОЙ для всей фотохимии, так как ее физический смысл, имеющий теоретическое обоснование только для спектра водорода, носит название константы Ридберга. Теоретического подхода к вычислению аналогичной величины для самых разнообразных атомов и молекул НЕ СУЩЕСТВУЕТ. Сами же эти величины легко определяются экспериментально, а наличие таблиц этих величин КВАНТОВОЙ ХИМИИ позволит надеяться на создание адекватной теории.
Желая указать связь этой константы с константой Ридберга, мы будем называть ее «Рид-с», где буква «с», написанная через черточку, означает «специфичность» этой константы, определяемой из условий реакции.
13. Константы фотохимического равновесия
Запишем константу фотохимического равновесия для первой стадии химического процесса:
Kфотохим1 = 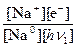 = Kфх1. (4.5)
= Kфх1. (4.5)
Запись справа является сокращением записи константы слева, так как левая требует слишком много букв. Но это не значит, что у новых констант фотохимического равновесия не было отличия от традиционной записи.
Запишем уравнение реакции между свободным электроном и нейтральным атомом хлора. Полная запись с участием фотонов приобретает вид:
Cl0 + e- = Cl- + h n2. (4.6)
Здесь захват электрона нейтральным атомом хлора связан с выделением «энергии сродства к электрону», которая высвечивается в виде фотона с частотой n2.
Запишем константу фотохимического равновесия для этой стадии химического процесса:
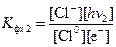 .
.
Последняя стадия этого химического процесса состоит в образовании связи между ионами натрия и хлора, а энергия образовавшейся связи выделяется в виде фотона с частотой n3:
Na+ + Cl- = NaCl + h n3. (4.7)
Запишем константу фотохимического равновесия и для этой стадии химического процесса:
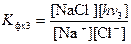 . (4.8)
. (4.8)
Последняя константа фотохимического равновесия отличается от обычной константы, принятой в химии тем, что в знаменателе стоят ионы, а не свободные атомы натрия и хлора. Но, пользуясь выражениями (4.4) и (4.6), можно совершить замену. Используя формулу (4.5) находим выражение для иона натрия, фигурирующего в формуле (4.8):
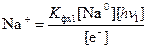 . (4.9)
. (4.9)
Подобным образом находим:
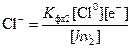 . (4.10)
. (4.10)
Нетрудно видеть, что сокращая концентрацию электронов, получим:
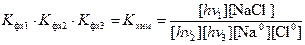 . (4.11)
. (4.11)
Полученный результат показывает, что полное выражение урезанной константы химического равновесия, игнорирует излучение, которое используется в химическом процессе.
Но до сих пор эта урезанная запись не приводила к особым недоразумениям. Это так и будет, если излучение соответствует формуле Планка, дающей распределение излучения в спектре абсолютно черного тела.
Если же, под действием внешних источников, плотность излучения отличается от того, что следует из формулы Планка, то мы и обнаруживаем несостоятельность обычной константы. Эта возможность и используется при подаче резонансного излучения в сферу реакции.
14. Тепловой эффект химической реакции
Мы еще не выразили тепловой эффект химической реакции Q через участников реакции при полном описании. Нетрудно видеть, что тепловой эффект химической реакции легко выражается через фотоны. Алгебраическая сумма поглощенных и излученных фотонов дает выражение для теплового эффекта реакции.
15. Энергия активации
В нашем описании отсутствует понятие ЭНЕРГИИ АКТИВАЦИИ; роль этой величины играет энергия первого фотона, обладающего «ЧАСТОТОЙ ФОТОЭФФЕКТА». В экзотермических реакциях энергия этого фотона МЕНЬШЕ, чем энергия выделившихся фотонов. В эндотермических реакциях энергия первого фотона БОЛЬШЕ, чем энергия выделившихся фотонов. Из этого следует, что эндотермические реакции предполагают использование дальнего ультрафиолета, которого сейчас на поверхности планеты практически нет. По утверждению В.И.Вернадского вся атмосфера Земли биогенного происхождения. Это означает, что в отсутствии Жизни этот ультрафиолет доходил до поверхности планеты и мог обеспечить протекание реакций синтеза %
Глава 5
БИОЛОГИЯ








