Гальванический элемент
Задание 1. Даны два электрода (см. вариант в табл. 12).
1. Запишите уравнение Нернста для расчета электродного потенциала и вычислите его значение для каждого электрода в растворе электролита при заданных условиях и Т=298 К.
2. Запишите электрохимическую систему (гальванический элемент), уравнения электродных реакций (на катоде и аноде), суммарной (токообразующей) реакции, определяющих работу этого элемента.
3. Рассчитайте равновесное напряжение составленного гальванического элемента.
Стандартные электродные потенциалы электродов приведены в приложении 6.
Т а б л и ц а 12
| Номер варианта | Электрод I | Электрод II | |||
| схема электрода | 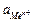 ,
моль/л ,
моль/л
| схема электрода | рН раствора | 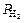 ( ( 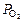 )
мм рт. cт. )
мм рт. cт.
| |
| 1 | Ag+ | Ag | 0,01 | Н2О, ОН– | О2, Pt | 8 | 0,5 |
| 2 | Fe2+ | Fe | 0,05 | Н2О, ОН– | О2, Pt | 5 | 0,5 |
| 3 | Cu2+ | Cu | 0,02 | Н+ | Н2, Pt | 4 | 0,5 |
| 4 | Co2+ | Co | 0,01 | Н2О, ОН– | О2, Pt | 9 | 0,25 |
| 5 | Ni2+ | Ni | 0,03 | Н2О, ОН– | О2, Pt | 2 | 0,7 |
| 6 | Fe2+ | Fe | 0,05 | Н+ | Н2, Pt | 3 | 1,5 |
| 7 | Pb2+ | Pb | 0,02 | Н+ | Н2, Pt | 9 | 0,5 |
| 8 | Bi3+ | Bi | 0,03 | Н+ | Н2, Pt | 4 | 0,2 |
| 9 | Sn2+ | Sn | 0,04 | Н2О, ОН– | О2, Pt | 2 | 1,2 |
| 10 | Cr2+ | Cr | 0,02 | Н2О, ОН– | О2, Pt | 3 | 0,4 |
О к о н ч а н и е т а б л. 12
| Номер варианта | Электрод I | Электрод II | |||
| схема электрода | 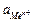 ,
моль/л ,
моль/л
| схема электрода | рН раствора | 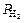 ( ( 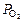 )
мм рт. cт. )
мм рт. cт.
| |
| 11 | Cr3+ | Cr | 0,01 | Н+ | Н2, Pt | 11 | 0,4 |
| 12 | Ti3+ | Ti | 0,03 | Н+ | Н2, Pt | 5 | 0,9 |
| 13 | In3+ | In | 0,01 | Н2О, ОН– | О2, Pt | 1 | 0,2 |
| 14 | Cu+ | Cu | 0,02 | Н2О, ОН– | О2, Pt | 2 | 0,7 |
| 15 | Mn2+ | Mn | 0,01 | Н+ | Н2, Pt | 12 | 0,3 |
| 16 | Ti2+ | Ti | 0,04 | Н+ | Н2, Pt | 5 | 1,5 |
| 17 | Cd2+ | Cd | 0,05 | Н+ | Н2, Pt | 9 | 0,5 |
| 18 | Zn2+ | Zn | 0,5 | Н2О, ОН– | О2, Pt | 2 | 0,7 |
| 19 | Mg2+ | Mg | 0,02 | Н+ | Н2, Pt | 4 | 1,2 |
| 20 | Al3+½ Al | 0,03 | Н+ | Н2, Pt | 8 | 0,5 |
| 21 | Ag+ | Ag | 0,05 | Н2О, ОН– | О2, Pt | 5 | 0,5 |
| 22 | Fe2+ | Fe | 0,01 | Н2О, ОН– | О2, Pt | 8 | 0,5 |
| 23 | Sb3+ | Sb | 0,04 | Н2О, ОН– | О2, Pt | 5 | 0,8 |
| 24 | W3+ | W | 0,01 | Н2О, ОН– | О2, Pt | 12 | 0,1 |
| 25 | Mo3+ | Mo | 0,03 | Н+ | Н2, Pt | 6 | 0,4 |
Задание 2. Гальванический элемент составлен из двух металлических электродов (см. вариант в табл. 13).
1. Подберите электролиты (см. приложение 7) и запишите электрохимическую систему (гальванический элемент).
2. Запишите уравнения электродных реакций и суммарной реакции, определяющие работу гальванического элемента.
3. Рассчитайте равновесное напряжение гальванического элемента, составленного из указанных электродов с учетом активности потенциалопределяющих ионов (а).
4. Рассчитайте энергию Гиббса, используя равновесное напряжение гальванического элемента.
Т а б л и ц а 13
| Номер варианта | Электрод I | Электрод II | Активность потенциал определяющих ионов а, моль/л | |
| электрода I | электрода II | |||
| 1 | Ga3+½Ga | Ag+ | Ag | 0,1 | 0,01 |
| 2 | Pd2+ | Pd | Cr3+ | Co | 0,2 | 0,05 |
| 3 | Au3+ | Au | Cd2+ | Cd | 0,01 | 0,5 |
| 4 | Sn2+ ½ Sn | Ag+ ½ Ag | 0,2 | 0,001 |
| 5 | Au3+ | Au | Sn2+ | Sn | 0,005 | 1,5 |
| 6 | Ag+ | Ag | Mg2+ | Zn | 0,02 | 0,5 |
| 7 | Cu+ | Cu | Ti2+ | Ti | 0,05 | 0,2 |
| 8 | Cr3+½Cr | Sn2+ | Sn | 0,03 | 1,2 |
| 9 | Ni2+ | Ni | Al3+ | Al | 0,05 | 1,3 |
| 10 | Mg2+ | Mg | In3+ | In | 1,7 | 0,05 |
| 11 | Pb2+ | Pb | Au3+ | Au | 0,02 | 0,003 |
| 12 | Cd2+ | Cd | Cr3+ | Cr | 0,8 | 0,2 |
| 13 | Zn2+ | Zn | Sb3+ | Sb | 0,002 | 0,03 |
| 14 | Pd2+ | Pd | Ga3+½ Ga | 0,01 | 1,0 |
| 15 | Fe2+ | Fe | Sb3+ | Sb | 0,02 | 0,2 |
| 16 | In3+ | In | Cо2+ | Cо | 0,2 | 0,005 |
| 17 | Ti2+ | Ti | Fе3+ | Fe | 0,05 | 1,5 |
| 18 | Ga3+ | Ga | Zn2+ | Zn | 0,8 | 0,5 |
| 19 | Cr3+ | Cr | Ag+ ½Ag | 0,7 | 0,1 |
| 20 | Cd2+ | Cd | Fe3+ | Fe | 0,5 | 0,02 |
О к о н ч а н и е т а б л. 13
| Номер варианта | Электрод I | Электрод II | Активность потенциал определяющих ионов а, моль/л | |
| электрода I | электрода II | |||
| 21 | Cu2+ | Cu | Au3+ | Au | 2,0 | 0,001 |
| 22 | V2+ | V | Sn4+ | Sn | 0,04 | 0,5 |
| 23 | Bi3+ ½ Bi | Cu2+ | Cu | 0,5 | 0,05 |
| 24 | Pb2+½ Pb | Ga3+½Ga | 0,5 | 0,1 |
| 25 | Mo3+ | Mo | Zn2+ | Zn | 0,01 | 0,9 |








