Тема 3. Основные закономерности протекания химических процессов 8
№ 4158
54
Х 465
Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
ХИМИЯ
Сборник индивидуальных домашних заданий
для студентов технических направлений
дневной формы обучения
НОВОСИБИРСК
2012
УДК
Составители: А.И. Апарнев, к.х.н., доцент
В.К. Варенцов, д.т.н., профессор
Г.К. Лупенко, к.х.н., доцент
Р.Е. Синчурина, ассистент
Рецензенты: Т.П. Александрова, к.х.н., доцент
Работа подготовлена на кафедре химии
Ó Новосибирский государственный
| |
технический университет, 2012
ОГЛАВЛЕНИЕ
Тема 1. Химический эквивалент. Закон эквивалентов. Окислительно-восстановительные реакции .......................................................................................................... 5
Тема 2. Строение вещества ....................................................... 7
Тема 3. Основные закономерности протекания химических процессов 8
Тема 4. Кинетика химических процессов и химическое равновесие 9
Тема 5. Растворы электролитов ............................................. 12
Тема 6. Коллоидные растворы................................................ 16
Тема 7. Общие свойства растворов ....................................... 19
Тема 8. Комплексные соединения .......................... 21
Тема 9. Электрохимические процессы .......................... 23
Приложения................................................................................. 30
Литература ................................................................................. 40
ПРЕДИСЛОВИЕ
Выполнение индивидуальных заданий дает возможность проверить уровень усвоения основных разделов курса химии. Индивидуальная работа осуществляется в основном по учебникам Коровин Н. В. Общая химия: учебник для вузов / В. Н. Коровин. – М.: Высшая школа, 2008; Глинка Н. Л. Общая химия: [учебное пособие для вузов] / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005 и конспектам лекций. Необходимые справочные данные приведены в приложении. Студенту выдается определенное число заданий по темам, номер варианта соответствует номеру в журнале группы. Задания выполняются в письменной форме в отдельной тетради (или на отдельных листах) и сдаются преподавателю в сроки, указанные в учебном плане.
Т е м а 1
Химический эквивалент.
Закон эквивалентов.
Окислительно-восстановительные реакции
Задание 1. Даны массы двухвалентного металла (mМе), его оксида (mо) и сульфида (mс) (см. ваш вариант в табл. 1).
Рассчитайте молярные массы эквивалентов металла, серы, оксида и сульфида металла. Установите и запишите химические формулы веществ.
Задание 2. Даны масса двухвалентного металла (mМе) и объем кислорода ( 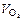 ), затраченного на его окисление при н.у. (см. ваш вариант в табл. 1).
), затраченного на его окисление при н.у. (см. ваш вариант в табл. 1).
Рассчитайте молярную массу эквивалентов металла, молярную массу металла и назовите металл.
Т а б л и ц а 1
| Номер варианта | Задание 1 | Задание 2 | Номер варианта | Задание 1 | Задание 2 | ||||||
| mМе, г | mо, г | mс, г | mМе, г | 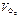 ,
л ,
л
| mМе, г | mо, г | mс, г | mМе, г | 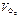 ,
л ,
л
| ||
| 1 | 3,01 | 3,56 | 4,11 | 17,9 | 1,46 | 14 | 3,74 | 4,99 | 6,24 | 7,42 | 1,41 |
| 2 | 3,22 | 4,01 | 4,80 | 9,4 | 1,61 | 15 | 3,66 | 6,07 | 8,48 | 5,05 | 0,89 |
| 3 | 2,58 | 3,23 | 3,88 | 6,6 | 3,04 | 16 | 2,98 | 4,17 | 5,36 | 5,44 | 1,52 |
| 4 | 3,07 | 3,95 | 4,83 | 7,9 | 1,01 | 17 | 3,22 | 3,93 | 4,64 | 16,56 | 1,65 |
| 5 | 4,07 | 5,18 | 6,29 | 9,8 | 1,87 | 18 | 3,99 | 4,59 | 5,19 | 4,4 | 5,47 |
| 6 | 3,88 | 5,01 | 6,14 | 11,4 | 2,01 | 19 | 3,65 | 4,29 | 4,93 | 3,3 | 1,52 |
| 7 | 2,98 | 3,21 | 3,44 | 6,6 | 3,04 | 20 | 3,72 | 4,25 | 4,78 | 10,36 | 0,56 |
| 8 | 3,34 | 3,79 | 4,24 | 5,8 | 1,62 | 21 | 3,94 | 4,66 | 5,38 | 4,98 | 0,95 |
| 9 | 2,74 | 3,13 | 3,52 | 11,4 | 0,93 | 22 | 2,86 | 3,56 | 4,26 | 21,85 | 1,22 |
| 10 | 2,51 | 2,71 | 2,91 | 4,9 | 0,84 | 23 | 4,41 | 5,52 | 6,63 | 10,64 | 1,12 |
| 11 | 3,17 | 3,43 | 3,69 | 10,84 | 1,08 | 24 | 2,27 | 2,92 | 3,57 | 8,18 | 3,77 |
| 12 | 3,35 | 3,74 | 4,13 | 15,8 | 2,02 | 25 | 2,31 | 2,94 | 3,57 | 15,88 | 2,03 |
| 13 | 4,59 | 5,28 | 5,97 | 9,15 | 1,47 | 26 | 2,14 | 2,66 | 3,19 | 7,3 | 2,04 |
Задание 3. Дана схема реакции (см. в табл. 2):
1. определите степень окисления атомов элементов, меняющих ее в процессе реакции;
2. составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления;
3. запишите множители в уравнение окислительно - восстановительной реакции как основные стехиометрические коэффициенты;
4. подберите стехиометрические коэффициенты остальных участников реакции;
5. выпишите формулы вещества – окислителя и восстановителя и рассчитайте их молярные массы эквивалентов.
Т а б л и ц а 2
| Номер варианта | Схема реакции |
| 1 | KI + KIO3 + H2SO4 ® I2 + K2SO4 + H2O |
| 2 | SnCl2 + K2Cr2O7 + HCl ® SnCl4 + CrCl3 + KCl + H2O |
| 3 | CuS + HNO3 ® Cu(NO3)2 + NO2 + H2SO4 + H2O |
| 4 | KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O |
| 5 | HNO2 + KMnO4 + H2SO4 ® HNO3 + MnSO4 + K2SO4 + H2O |
| 6 | K2Cr2O7 + HBr ® CrBr3 + Br2 + KBr + H2O |
| 7 | H2S + Cl2 + H2O ® H2SO4 + HCl |
| 8 | I2 + HNO3 ® HIO5 + NO + H2O |
| 9 | HNO3 + Zn ® Zn(NO3)2 + N2O + H2O |
| 10 | FeS + HNO3 ® Fe(NO3)2 + S + NO + H2O |
| 11 | Cr2O3 + KClO3 + KOH ® K2CrO4 + KCl + H2O |
| 12 | K2Cr2O7 + KI + H2SO4 ® Cr2(SO4)3 + I2 + K2SO4 + H2O |
| 13 | FeCl2 + HNO3 + HCl ® FeCl3 + NO + H2O |
| 14 | H2SO3 + HNO3 ® H2SO4 + NO + H2O |
| 15 | K2Cr2O7 + SO2 + HCl ® CrCl3 + KCl + H2SO4 + H2O |
| 16 | Cl2 + Br2 + KOH ® KCl + KBrO3 + H2O |
| 17 | K2Cr2O7 + H2O2 + H2SO4 ® O2 + Cr2(SO4)3 + H2O + K2SO4 |
| 18 | NaIO3 + CO + H2SO4 ® I2 + CO2 + Na2SO4 + H2O |
| 19 | H2S + HClO3 ® H2SO4 + HCl |
О к о н ч а н и е т а б л. 2
| 20 | KCl + KMnO4 + H2SO4 ®Cl2 + MnSO4 + K2SO4 + H2O |
| 21 | FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O |
| 22 | Cr2(SO4)3 + Br2 + NaOH®Na2CrO4 + NaBr + Na2SO4 + H2O |
| 23 | MnSO4 + KMnO4 + H2O ® MnO2 + H2SO4 + K2SO4 |
| 24 | Sn + HNO3 ® Sn(NO3)2 + N2 + H2O |
| 25 | Ca + HNO3 ® Ca(NO3)2 + NH4NO3 + H2O |
Т е м а 2.
Строение вещества
Задание. Для элементов, атомы которых образуют молекулу (см. вариант в табл. 3):
1. напишите электронные формулы, подчеркните валентные электроны и определите семейство;
2. укажите значения квантовых чисел для валентных электронов;
3. распределите валентные электроны по энергетическим ячейкам и определите валентность в основном (невозбужденном) и возбужденном состояниях;
4. объясните связь электронного строения атома элементов с их положением в периодической системе (период, группа, подгруппа);
Т а б л и ц а 3
| Номер варианта | Формула вещества | Номер варианта | Формула вещества | Номер варианта | Формула вещества |
| 1 | CF4 | 10 | AlCl3 | 19 | BrF3 |
| 2 | CCl4 | 11 | GaCl3 | 20 | BeCl2 |
| 3 | NF3 | 12 | SBr6 | 21 | CS2 |
| 4 | SiCl4 | 13 | SiBr4 | 22 | SnCl2 |
| 5 | PI3 | 14 | SbBr3 | 23 | ScBr3 |
| 6 | AsCl3 | 15 | HgCl2 | 24 | AsF5 |
| 7 | PCl3 | 16 | PCl5 | 25 | CdF2 |
| 8 | SeF4 | 17 | SF6 | 26 | SCl6 |
| 9 | PbCl2 | 18 | InI3 | 27 | BF3 |
5. определите степени окисления элементов в молекуле;
6. составьте электронные формулы для атомов элементов с данной степенью окисления и охарактеризуйте их окислительно-восстановительные свойства;
7. охарактеризуйте химические свойства элементов, заполнив таблицу:
| Элемент | Формула оксида | Формула гидроксида | Формула водородного соединения |
| Химический характер |
Т е м а 3
Основные закономерности протекания
химических процессов
Задание. Дано уравнение реакции (см. вариант в табл. 4).
1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 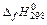 и
и 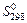 .
.
2. Вычислите изменение энтальпии реакции 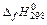 и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции 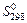 . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак
. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 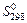 .
.
4. Вычислите энергию Гиббса прямой реакции в стандартных условиях 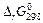 и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции.








