Определение pH раствора с помощью хингидронного электрода
выполнил студент 3 курса 1 группы Кравцов Егор
Цель: Определение pH и буферной емкости ацетатных буферных растворов.
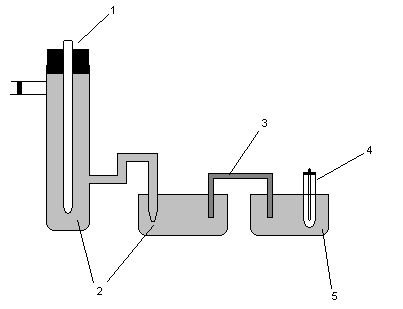 Схема установки:
Схема установки:
1.Каломельный электрод
2.Насыщенный р-р KCl
3.Солевой мостик
4.Платиновый электрод
5.Раствор гидрохинона
Основные формулы:
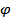 0XГ= 0,699-7,4*10-4(t-25)
0XГ= 0,699-7,4*10-4(t-25)
Eцепи= 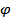 0XГ – 0,058pH –
0XГ – 0,058pH – 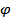 Cl-/Hg2Cl2,Hg
Cl-/Hg2Cl2,Hg
pH = ( 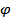 0XГ - Eцепи -
0XГ - Eцепи - 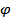 Cl-/Hg2Cl2,Hg) / 0,058
Cl-/Hg2Cl2,Hg) / 0,058
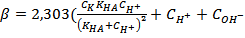 ,
,
где β – коэффициент буфера, 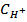 - концентрация сильной кислоты,
- концентрация сильной кислоты, 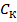 – концентрация слабой кислоты,
– концентрация слабой кислоты, 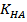 - константа диссациации слабой кислоты.
- константа диссациации слабой кислоты.
Таблицы расчетов:
Таблица 1. Определение pHбуферов различных концентраций
| CH 3 COOH , 0,2 H , мл | CH 3 COONa , 0,2 H , мл | ЭДС в цепи | pH буфера |
| 10,0 | 10,0 | 0,159 | 5,04 |
| 10,0 | 5,0 | 0,173 | 4,80 |
| 5,0 | 10,0 | 0,144 | 5,30 |
Таблица 2. Определение буферной емкости буфера (1:1).
| V(HCl), мл | E,B | pH | Vобщ,мл |
| 0,0 | 0,159 | 5,09 | 20,0 |
| 2,0 | 0,165 | 4,99 | 22,0 |
| 4,0 | 0,169 | 4,92 | 24,0 |
| 6,0 | 0,175 | 4,82 | 26,0 |
| 8,0 | 0,182 | 4,70 | 28,0 |
| 10,0 | 0,188 | 4,59 | 30,0 |
| 12,0 | 0,194 | 4,49 | 32,0 |
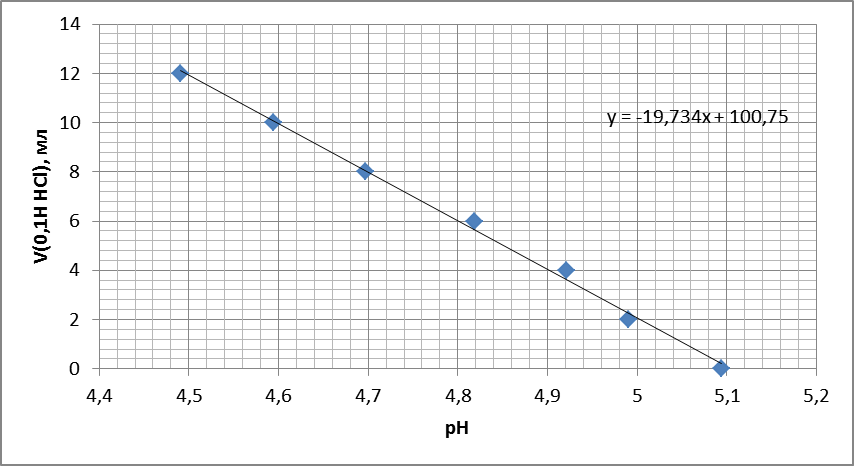
График 1. График зависимости pH буфера от объема добавленной к-ты.
По уравнению линии тренда была вычислена буферная емкость раствора.
Расчеты:
Буферная емкость:
V=19,73мл
b=19,73*0,1/1000=1,973*10-3моль
Vобщ=24мл
β=0,0512 моль.экв/мл
V=19,53мл
Стандартный электродный потенциал хингидронного электрода:
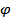 0XГ= 0,699+7,4*10-4(21-25)= 0,6960 (В)
0XГ= 0,699+7,4*10-4(21-25)= 0,6960 (В)
Вывод: С помощью хингидронного электрода был определен pH трех ацетатных буферных растворов(5,0, 4,8, 5,3), а также буферная емкость раствора (1:1), которая равна 1,973*10-3моль.








