Примеры решения задач
1. Основы молекулярно-кинетической теории
Основные положения молекулярно-кинетической теории и их опытное обоснование. Броуновское движение. Движение и взаимодействие атомов и молекул вещества. Зависимость скорости движения атомов и молекул от температуры. Диффузия. Количество вещества. Постоянная Авогадро. Молярная масса. Число молекул. Масса вещества. Масса и размеры атомов и молекул. Концентрация. Силы взаимодействия молекул. Скорость молекул газа. Средняя квадратичная скорость теплового движения молекул. Распределение молекул по скоростям. Опыт Штерна. Температура и тепловое равновесие. Измерение температуры (термометры). Абсолютная температура. Абсолютный нуль. Молекулярно-кинетический смысл температуры. Постоянная Больцмана. Тепловое расширение твердых и жидких тел.
2. Основы молекулярно-кинетической теории идеального газа
Свойства газов. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа (вывод). Давление газа. Уравнение состояния идеального газа. Универсальная газовая постоянная. Изопроцессы в газах. Газовые законы. Закон Авогадро. Закон Дальтона.
§1. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Краткие теоретические сведения
Закон Авогадро. В равных объемах газа при одинаковых давлениях и температурах находится одинаковое число молекул.
Из закона Авогадро следует: один моль любого газа при одинаковых условиях занимает одинаковый объем. В том числе при нормальных условиях объем 1 моля любого газа равняется 22,4 л.
Нормальные условия:
р = 1,01·105 Па = 0,101 МПа = 760 мм рт. ст., T = 273 K (0 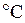 ).
).
Число Авогадро 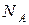 – это физическая постоянная, которая численно равна количеству специфицированных структурных единиц в 1 моле вещества. Определяется как количество атомов в 12 граммах чистого изотопа углерода-12. CODATA (Committee on Data for Science and Technology – Комитет по данным для науки и техники) рекомендует следующее значение числа Авогадро:
– это физическая постоянная, которая численно равна количеству специфицированных структурных единиц в 1 моле вещества. Определяется как количество атомов в 12 граммах чистого изотопа углерода-12. CODATA (Committee on Data for Science and Technology – Комитет по данным для науки и техники) рекомендует следующее значение числа Авогадро:
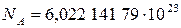 моль–1.
моль–1.
Количеством вещества называется физическая величина, характеризующая количество однотипных структурных единиц (молекул, атомов), содержащихся в веществе, и численно равная
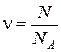 , (1.1)
, (1.1)
где 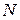 – число структурных элементов (молекул, атомов).
– число структурных элементов (молекул, атомов).
Молярная масса вещества – масса одного моля вещества, т. е.
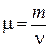 , (1.2)
, (1.2)
где 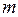 – масса вещества,
– масса вещества, 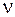 – количество вещества.
– количество вещества.
Массу одной молекулы m0 можно найти как
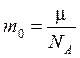 .
.
Зависимость давления 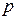 газа от концентрации
газа от концентрации 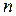 молекул и температуры
молекул и температуры 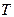 :
:
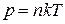 , (1.3)
, (1.3)
где 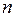 – концентрация молекул,
– концентрация молекул, 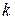 = 1,3806·10–23 Дж/К – постоянная Больцмана,
= 1,3806·10–23 Дж/К – постоянная Больцмана, 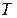 – абсолютная температура газа.
– абсолютная температура газа.
Основное уравнение молекулярно-кинетической теории газов (уравнение Клаузиуса): давление газа численно равно двум третям средней кинетической энергии 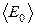 поступательного движения всех молекул в единице объема:
поступательного движения всех молекул в единице объема:
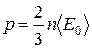 . (1.4)
. (1.4)
Средняя кинетическая энергия жесткой молекулы:
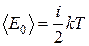 , (1.5)
, (1.5)
где 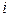 – сумма поступательных и вращательных степеней свободы.
– сумма поступательных и вращательных степеней свободы.
Числом степеней свободы молекулы называют количество независимых параметров, с помощью которых можно однозначно задать положение и ориентацию молекулы в пространстве.
Теорема Больцмана о равномерном распределении энергии по степеням свободы: на каждую степень свободы поступательного и вращательного движений приходится в среднем одинаковое количество энергии, равное 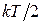 . Для одноатомного газа
. Для одноатомного газа 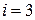 , для жестких молекул двухатомного газа
, для жестких молекул двухатомного газа 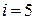 , трех- и более атомных газов
, трех- и более атомных газов 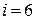 .
.
Для идеального газа средняя квадратичная скорость определяется
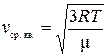 . (1.6)
. (1.6)
Основное уравнение молекулярно-кинетической теории газов (уравнение Клаузиуса) справедливо лишь для идеального газа, так как в процессе его вывода не учитывается взаимодействие молекул на расстоянии, столкновения молекул рассматриваются как удары упругих шариков. Поэтому уравнение (1.3) и связанное с ним (1.6) применяются лишь для разреженных газов и паров.
Примеры решения задач
Задача 1.1. В озеро, имеющее среднюю глубину 10 м и площадь поверхности 20 км2, бросили кристаллик поваренной соли массой 0,01 г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см3, зачерпнутом из озера, если полагать, что соль, растворившись, равномерно распределилась во всем объеме воды?
Решение. Для химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов. Тогда для нахождения молярной массы молекулы поваренной соли NaCl необходимо определить молярную массу натрия и молярную массу хлора, используя периодическую таблицу химических элементов Д.И. Менделеева, т. е.
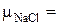
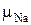 +
+ 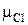 = 35·1 + 23·1 = 58 (г/моль).
= 35·1 + 23·1 = 58 (г/моль).
Один моль любого вещества содержит 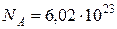 моль–1 частиц (число Авогадро). Одна молекула поваренной соли имеет массу:
моль–1 частиц (число Авогадро). Одна молекула поваренной соли имеет массу:
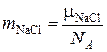 .
.
Количество молекул в кристалле соли массой m:
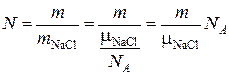 .
.
Объем озера найдем, умножив его площадь S = 20 км2 = 2·1011 см2 на его глубину h = 10 м = 103 см:
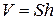 .
.
Тогда количество молекул соли, находящихся в 1 см3 воды:
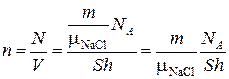 .
.
Количество молекул в наперстке объемом VН:
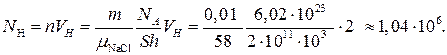
Обратите внимание, что при растворении в большом озере очень маленького количества соли (0,01 г), в наперстке воды окажется миллион молекул соли.
Задача 1.2. Кубическая кристаллическая решетка золота содержит один атом золота на элементарный куб. Плотность золота 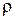 = 19320 кг/м3, атомная масса А = 0,197 кг/моль. Определите расстояние между ближайшими атомами золота.
= 19320 кг/м3, атомная масса А = 0,197 кг/моль. Определите расстояние между ближайшими атомами золота.
Решение. Решёткой является совокупность точек (атомов), которые обладают замечательным свойством: относительно каждой точки все остальные расположены совершенно одинаково. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с центрами молекул. Таким образом, объем золота можно вычислить по формуле 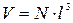 , где l – расстояние между ближайшими атомами.
, где l – расстояние между ближайшими атомами.
Плотность золота 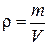 , где масса золота т = т0 · N (т0 – масса одного атома, N – число атомов). Масса одного атома
, где масса золота т = т0 · N (т0 – масса одного атома, N – число атомов). Масса одного атома
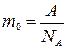 ,
,
т. е. плотность
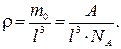

Откуда
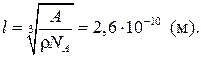
Задача 1.3. Какое давление на стенки сосуда производит кислород, если средняя квадратичная скорость его молекул 400 м/с и концентрация 2,7·1019 см–3?
Решение. Воспользуемся периодической таблицей химических элементов Д.И. Менделеева. В молекуле кислорода два атома кислорода, каждый массой 16 а.е.м. Следовательно, молярная масса кислорода:
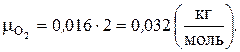
Один моль любого вещества содержит 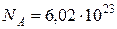 моль–1 частиц (число Авогадро). Одна молекула кислорода имеет массу:
моль–1 частиц (число Авогадро). Одна молекула кислорода имеет массу:
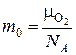 .
.
Согласно основному уравнению молекулярно-кинетической теории, давление газа с массой молекул 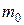 , средней квадратичной скоростью
, средней квадратичной скоростью 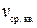 и концентрацией (количество молекул в единице объема) n = 2,7 · 1019 частиц/см3 = 2,7·1025 частиц/м3:
и концентрацией (количество молекул в единице объема) n = 2,7 · 1019 частиц/см3 = 2,7·1025 частиц/м3:
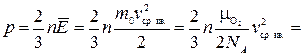
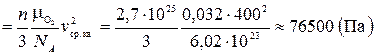 .
.
Задача 1.4. Средняя квадратичная скорость молекул газа около 400 м/с. Определите объем газа при среднем давлении 1·105 Н/м2 и массе 1,0 кг.
Решение. Среднюю квадратичную скорость движения молекул найдем из связи давления газа со средней кинетической энергией молекул:
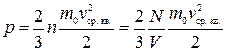 .
.
Произведение массы одной молекулы на концентрацию молекул (число молекул в единице объема) n равно массе молекул, заключенных в единице объема, т. е. плотности газа 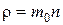 . Следовательно, основное уравнение молекулярно-кинетической теории можно записать в виде:
. Следовательно, основное уравнение молекулярно-кинетической теории можно записать в виде:
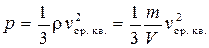 .
.
Отсюда найдем объем газа:
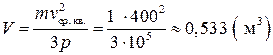 .
.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.5. Найти массу 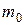 атома водорода и гелия.
атома водорода и гелия.
1.8. Кубическая кристаллическая решетка железа содержит один атом железа на элементарный куб, повторяя который, можно получить всю решетку кристалла. Определить расстояние между ближайшими атомами железа, если плотность железа ρ = 7,9 г/см3, атомная масса железа А = 56 г/моль.
1.10. Современные вакуумные насосы позволяют получать давления до 4 . 10–10 атм (при комнатной температуре). Найти число молекул газа в 1 см3 и среднее расстояние между ними при этом давлении.
1.17. В сосуде объемом 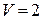 л находится
л находится 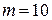 г кислорода под давлением
г кислорода под давлением 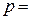 8·104 Па. Найти: а) среднюю квадратичную скорость молекул
8·104 Па. Найти: а) среднюю квадратичную скорость молекул 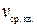 ; б) количество молекул в сосуде; в) плотность газа.
; б) количество молекул в сосуде; в) плотность газа.
1.24. Альпинист при каждом вдохе поглощает 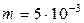 кг воздуха. Какой объем воздуха должен вдыхать альпинист в горах, где давление воздуха равняется
кг воздуха. Какой объем воздуха должен вдыхать альпинист в горах, где давление воздуха равняется 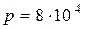 Па при температуре
Па при температуре 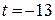
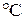 ? Сколько молекул он выдыхает за один раз? Найти их концентрацию.
? Сколько молекул он выдыхает за один раз? Найти их концентрацию.








