8.1. Вычисление массы навески для приготовления растворов
Задача 1. Какую навеску тиосульфата натрия необходимо взять для приготовления 250 мл 0,05н раствора ?
Дано:
СН (Na2S2O3×5H2O) = 0,05 моль/л
V = 250 мл
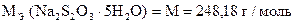
|
| m Н = ? |
Решение:
2S2O32- - 2e- = S4O62-
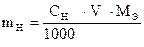
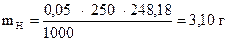
‚ ƒ
| - | Сколько моль-экв Na2S2O3×5H2O содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв Na2S2O3×5H2O содержится в 250 мл раствора. |
| ƒ - | Сколько г Na2S2O3×5H2O содержится в 250 мл раствора. |
Задача 2. Какую навеску кристаллического иода необходимо взять
для приготовления 500 мл 0,02н раствора ?
Дано:
СН (J2) = 0,02 моль/л
V = 500 мл
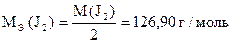
|
| m Н = ? |
Решение:
J2 + 2e- = 2J-
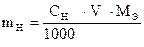
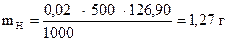
‚ ƒ
| - | Сколько моль-экв J2 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв J2 содержится в 500 мл раствора. |
| ƒ - | Сколько г J2 содержится в 500 мл раствора. |
Задача 3. Какую навеску х.ч. K2Cr2O7 необходимо взять для приготовления 0,05н раствора в объеме мерной колбы 200,00 мл ?
Дано:
СН (K2Cr2O7) = 0,05 моль/л
VК = 200,00 мл
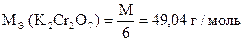
|
| m Н = ? |
Решение:
Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O
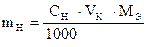
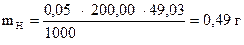
‚ ƒ
| - | Сколько моль-экв K2Cr2O7 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв K2Cr2O7 содержится в 200,00 мл раствора. |
| ƒ - | Сколько г K2Cr2O7 содержится в 200,00 мл раствора. |
8.2. Вычисление концентрации стандартных растворов
Задача 1. Навеска 0,2486 г х.ч. K2Cr2O7 растворена в мерной колбе 500 мл.
На титрование 20,00 мл приготовленного раствора после прибавления KJ и HCl расходуется 25,05 мл раствора Na2S2O3×5H2O. Вычислить СН(Na2S2O3×5H2O), К0,01Н , Т(Na2S2O3×5H2O), Т(Na2S2O3×5H2O/KBrO3).
| Дано: m (х.ч. K2Cr2O7) = 0,2486 г VК = 500,00 мл Vn = 20,00 мл V(Na2S2O3×5H2O) = 25,05 мл | 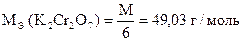
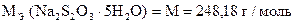
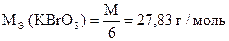
|
| СН (Na2S2O3×5H2O) = ? К0,01Н = ? | Т(Na2S2O3×5H2O) = ? Т(Na2S2O3×5H2O/KBrO3) = ? |
Решение:
1) K2Cr2O7 + 6KJ + 14HCl = 8KCl + 2CrCl3 + 3J2 + 7H2O
| 1 | Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O |
| 3 | 2J- - 2e- = J2 |
| Cr2O72- + 6J- + 14H+ = 2Cr3+ + 3J2 + 7H2O |
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
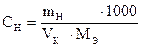
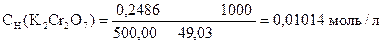
‚ ƒ
| - | Сколько г K2Cr2O7 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв K2Cr2O7 содержится в 1 мл раствора. |
| ƒ - | Сколько моль-экв K2Cr2O7 содержится в 1000 мл раствора или СН (K2Cr2O7) . |
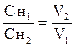
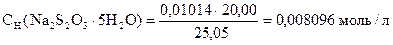
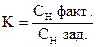
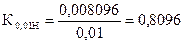
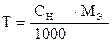
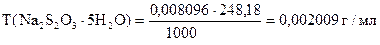
‚
| - | Сколько моль-экв Na2S2O3×5H2O содержится в 1 мл раствора. |
| ‚ - | Сколько г Na2S2O3×5H2O содержится в 1 мл раствора. |
BrO3- + 6H+ + 6e- = Br- + 3H2O
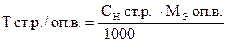
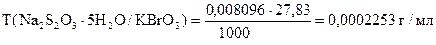
‚
| - | Сколько моль-экв Na2S2O3×5H2O содержится в 1 мл раствора. Столько же моль-экв KBrO3 эквивалентно 1 мл раствора Na2S2O3×5H2O. |
| ‚ - | Сколько г KBrO3 эквивалентно 1 мл раствора Na2S2O3×5H2O или Т(Na2S2O3×5H2O/KBrO3). |
Задача 2. На титрование 10,00 мл приготовленного раствора иода расходуется 12,64 мл 0,04864н раствора тиосульфата натрия.
Вычислить СН(J2), К0,05Н , Т(J2), Т(J2/ Na2SO3).
Дано:
V(J2) = 10,00 мл
V(Na2S2O3×5H2O) = 12,64 мл
СН (Na2S2O3×5H2O) = 0,04864 моль/л
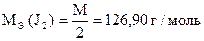
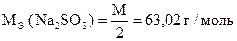
|
| СН (J2) = ? К0,05Н = ? Т (J2) = ? Т (J2/Na2SO3) = ? |
Решение:
2Na2S2O3 + J2 = Na2S4O6 + 2NaJ
| 1 | 2S2O32- - 2e- = S4O62- |
| 1 | J2 + 2e- = 2J- |
| 2S2O32- + J2 = S4O62- + 2J- |
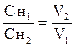
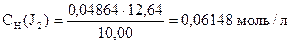
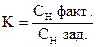
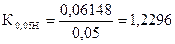
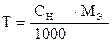
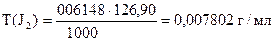
‚
| - | Сколько моль-экв J2 содержится в 1 мл раствора. |
| ‚ - | Сколько г J2 содержится в 1 мл раствора или Т(J2). |
SO32- + H2O - 2e- = SO42- + 2H+
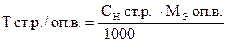
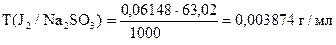
‚
| - | Сколько моль-экв J2 содержится в 1 мл раствора. Столько же моль-экв Na2SO3 эквивалентно 1 мл раствора J2. |
| ‚ - | Сколько г Na2SO3 эквивалентно 1 мл раствора J2. |
8.3. Вычисление процентного содержания окислителей
Задача 1. Навеска хлорида железа (III) массой 1,9450 г растворена в мерной колбе 100 мл. На титрование 10,00 мл полученного раствора после прибавления KJ и кислоты израсходовано 9,20 мл стандартного раствора тиосульфата натрия.
СН (Na2S2O3×5H2O) = 0,04661 моль/л.
Вычислить процентное содержание FeCl3 в образце.
Дано:
m Н = 1,9450 г
Vn = 10,00 мл
VК = 100,00 мл
V(Na2S2O3×5H2O) = 9,20 мл
СН (Na2S2O3×5H2O) = 0,04661 моль/л
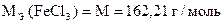
|
| w (FeCl3) = ? |
Решение:
1) 2FeCl3 + 2KJ = 2FeCl2 + J2 + 2KCl
| 2 | Fe3+ + e- = Fe2+ |
| 1 | 2J- - 2e- = J2 |
| 2Fe3+ + 2J- = 2Fe2+ + J2 |
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
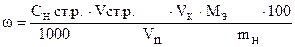
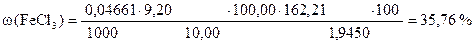
‚ ƒ „ … † ‡
| - | Сколько моль-экв Na2S2O3×5H2O содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв Na2S2O3×5H2O содержится в 9,20 мл раствора. Столько же моль-экв FeCl3 содержится в 10,00 мл раствора. |
| ƒ - | Сколько моль-экв FeCl3 содержится в 1 мл раствора. |
| „ - | Сколько моль-экв FeCl3 содержится в 100,00 мл раствора. |
| … - | Сколько г FeCl3 содержится в 100,00 мл раствора. Столько же г FeCl3 содержится в навеске. |
| † - | Сколько г FeCl3 содержится в 1 г образца. |
| ‡ - | Сколько г FeCl3 содержится в 100 г образца или w (FeCl3). |
Задача 2. К навеске 0,1500 г K2Cr2O7 добавили избыток KJ и соляной кислоты.
Выделившийся J2 оттитровали 21,65 мл раствора Na2S2O3×5H2O.
Т (Na2S2O3×5H2O) = 0,002482 г/мл.
Вычислить процентное содержание K2Cr2O7 в образце.
Дано:
m Н = 0,1500 г
V(Na2S2O3×5H2O) = 21,65 мл
T (Na2S2O3×5H2O) = 0,02482 г/мл
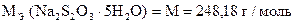
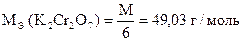
|
| w (K2Cr2O7) = ? |
Решение:
1) K2Cr2O7 + 6KJ + 14HCl = 3J2 + 2CrCl3 + 8KCl + 7H2O
| 1 | Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O |
| 3 | 2J- - 2e- = J2 |
| Cr2O72- + 6J- + 14H+ = 2Cr3+ + 3J2 + 7H2O |
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = 2J- + S4O62- |
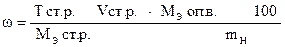
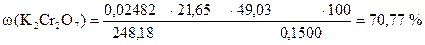
‚ ƒ „ …
| - | Сколько моль-экв Na2S2O3×5H2O содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв Na2S2O3×5H2O содержится в 21,65 мл раствора. Столько же моль-экв K2Cr2O7 содержится в навеске. |
| ƒ - | Сколько г K2Cr2O7 содержится в навеске. |
| „ - | Сколько г K2Cr2O7 содержится в 1 г образца. |
| … - | Сколько г K2Cr2O7 содержится в 100 г образца или w (K2Cr2O7). |
8.4. Вычисление процентного содержания восстановителей
Задача 1. Навеска сульфида натрия 3,9050 г растворена в мерной колбе 500 мл.
К 40,00 мл раствора J2 (K0,2H = 0,9342) прибавили 20,00 мл анализируемого раствора сульфида. На титрование остатка иода израсходовано 41,25 мл 0,09520 нормального раствора тиосульфата натрия.
Вычислить процентное содержание Na2S в образце.
Дано:
m (Na2S) = 3,9050 г
Vn = 20,00 мл
VК = 500,00 мл
V(J2) = 40,00 мл
К0,2Н = 0,9342
V (Na2S2O3×5H2O) = 41,25 мл
СН (Na2S2O3×5H2O) = 0,09520 моль/л
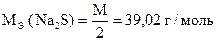
|
| w (Na2S) = ? |
Решение:
1) Na2S + J2 = S ¯ + 2NaJ + [J2]
|
| 1 | S2- - 2e- = S |
| 1 | J2 + 2e- = 2J- |
| S2- + J2 = S ¯ + 2J- |
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
|
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
I способ расчета (по количеству моль-эквивалентов)
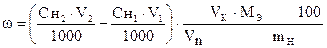
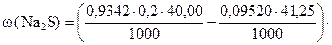
ƒ ‚
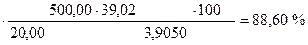
„ … † ‡ ˆ
| - | Сколько моль-экв J2 содержится в 40,00 мл раствора. |
| ‚ - | Сколько моль-экв Na2S2O3×5H2O содержится в 41,25 мл раствора. Столько же моль-экв J2 содержится в остатке. |
| ƒ - | Сколько моль-экв J2 пошло на окисление Na2S. Столько же моль-экв Na2S содержится в 20,00 мл раствора. |
| „ - | Сколько моль-экв Na2S содержится в 1 мл раствора. |
| … - | Сколько моль-экв Na2S содержится в 500,00 мл раствора. |
| † - | Сколько г Na2S содержится в 500,00 мл раствора. Столько же г Na2S содержится в навеске. |
| ‡ - | Сколько г Na2S содержится в 1 г образца. |
| ˆ - | Сколько г Na2S содержится в 100 г образца или w (Na2S). |
II способ расчета (через избыточный объем)
1) Сколько мл J2 содержится в остатке
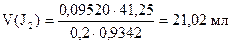
2) Сколько мл J2 израсходовано на окисление Na2S
40,00 - 21,02 = 18,98 мл
3) Сколько г Na2S содержится в 100 г образца или w (Na2S)
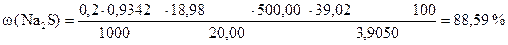
‚ ƒ „ … † ‡
| - | Сколько моль-экв J2 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв J2 содержится в 18,98 мл раствора. Столько же моль-экв Na2S содержится в 20,00 мл раствора. |
| ƒ - | Сколько моль-экв Na2S содержится в 1 мл раствора. |
| „ - | Сколько моль-экв Na2S содержится в 500,00 мл раствора. |
| … - | Сколько г Na2S содержится в 500,00 мл раствора. Столько же г Na2S содержится в навеске. |
| † - | Сколько г Na2S содержится в 1 г образца. |
| ‡ - | Сколько г Na2S содержится в 100 г образца или w (Na2S). |
Задача 2. Навеску технического сульфита натрия 0,4680 г растворили и прибавили
к 100,00 мл 0,1000 нормального раствора J2. Избыток J2 оттитровали 42,40 мл раствора Na2S2O3×5H2O, 1,00 мл которого эквивалентен 1,02 мл раствора J2.
Вычислить процентное содержание Na2SO3 в образце.
Дано:
m Н = 0,4680 г
V(J2) = 100,00 мл
СН (J2) = 0,1000 моль/л
V(Na2S2O3×5H2O) = 42,40 мл
1,00 мл Na2S2O3×5H2O экв. 1,02 мл раствора J2 («глухой опыт»)
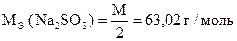
|
| w (Na2SO3) = ? |
Решение:
1) Na2SO3 + J2 + H2O = Na2SO4 + 2HJ + [J2]
|
| 1 | SO32- + H2O - 2e- = SO42- + 2H+ |
| 1 | J2 + 2e- = 2J- |
| SO32- + J2 + H2O = SO42- + 2H+ + 2J- |
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
|
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = 2J- + S4O62- |
I способ расчета (по количеству моль-эквивалентов)
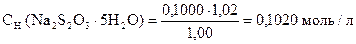
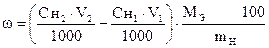
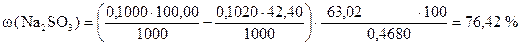
ƒ ‚ „ … †
| - | Сколько моль-экв J2 содержится в 100,00 мл раствора. |
| ‚ - | Сколько моль-экв Na2S2O3×5H2O содержится в 42,40 мл раствора. Столько же моль-экв J2 содержится в остатке. |
| ƒ - | Сколько моль-экв J2 пошло на окисление Na2SO3. Столько же моль-экв Na2SO3 содержится в навеске. |
| „ - | Сколько г Na2SO3 содержится в навеске. |
| … - | Сколько г Na2SO3 содержится в 1 г образца. |
| † - | Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3). |
II способ расчета (через избыточный объем)
1) 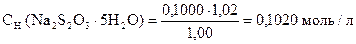
2) Сколько мл J2 содержится в остатке
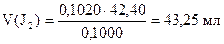
3) Сколько мл J2 израсходовано на окисление Na2SO3
100,00 - 43,25 = 56,75 мл
4) Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3)
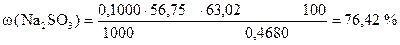
‚ ƒ „ …
| - | Сколько моль-экв J2 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв J2 содержится в 56,75 мл раствора. Столько же моль-экв Na2SO3 содержится в навеске. |
| ƒ - | Сколько г Na2SO3 содержится в навеске. |
| „ - | Сколько г Na2SO3 содержится в 1 г образца. |
| … - | Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3). |
III способ расчета (по «глухому опыту»)
1) Сколько мл J2 эквивалентно 42,40 мл раствора Na2S2O3×5H2O
1,00 мл Na2S2O3×5H2O экв. 1,02 мл J2
42,40 мл Na2S2O3×5H2O экв. Х мл J2
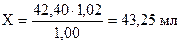
2) Сколько мл J2 эквивалентно содержанию Na2SO3
100,00 - 43,25 = 56,75 мл
3) Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3)
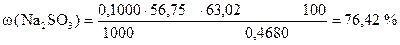
‚ ƒ „ …
| - | Сколько моль-экв J2 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв J2 содержится в 56,75 мл раствора. Столько же моль-экв Na2SO3 содержится в навеске. |
| ƒ - | Сколько г Na2SO3 содержится в навеске. |
| „ - | Сколько г Na2SO3 содержится в 1 г образца. |
| … - | Сколько г Na2SO3 содержится в 100 г образца или w (Na2SO3). |
9. Опорный конспект по иодометрическому методу анализа
Иодометрический метод анализа основан на окислительно-восстановительных реакциях, связанных с окислением J- ионов до J2 и восстановлением J2 до J- :
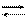 2J- - 2e- J2
2J- - 2e- J2
j0 J2 /2J- = + 0,536 B
Стандартные растворы: Na2S2O3×5H2O (восстановитель), J2 (окислитель).
Стандартные растворы готовят приблизительной концентрации (установленные растворы).
Точную концентрацию Na2S2O3 ×5H2O устанавливают по х.ч. K2Cr2O7 (титрование по способу замещения), J2 - по установленному стандартному раствору Na2S2O3×5H2O (способ прямого титрования).
Основная реакция метода иодометрии:
2Na2S2O3 + J2 = 2NaJ + Na2S4O6
| 1 | 2 S2O32- - 2e- = S4O62- |
| 1 | J2 + 2e- = 2J- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
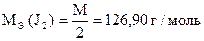
В иодометрическом методе анализа используют:
· прямое титрование -
восстановители: Na2S2O3×5H2O, Na3AsO3, H2S.
· обратное титрование (титрование по остатку) -
восстановители: Na2SO3, K2SO3, Na2S, K2S.
· титрование по способу замещения -
окислители: KMnO4, K2Cr2O7, KClO3, KJO3, KBrO3, FeCl3, CuSO4×5H2O, H2O2, Na2O2, CaOCl2.
Момент эквивалентности определяют с помощью индикатора крахмала.
При титровании раствором иода конец реакции определяют по появлению неисчезающей синей окраски.
При титровании иода раствором тиосульфата натрия - по исчезновению синей окраски.








