Сущность способа обратного титрования
К точно измеренному объему стандартного раствора J2, взятому в избытке, добавляют кислоту (HCl или H2SO4) и аликвоту (объем пипетки) анализируемого восстановителя. При этом часть стандартного раствора J2 вступает в реакцию с анализируемым восстановителем, полностью окисляя его, а другая избыточная часть (остаток) стандартного раствора J2 остается в растворе без изменения. Затем остаток стандартного раствора J2 оттитровывают стандартным раствором тиосульфата натрия.
ПРИМЕРЫ
1. Анализ технического сульфита натрия
Химическая сущность
1) Na2SO3 + J2 + H2O = Na2SO4 + 2HJ + [J2]
|
| 1 | SO32- + H2O - 2e- = SO42- + 2H+ |
| 1 | J2 + 2e- = 2J- |
| SO32- + J2 + H2O = SO42- + 2H+ + 2J- |
j 0 SO42- / SO32- = + 0,17 B
j 0 J2 / 2J- = + 0,536 B
Dj = 0,536 - 0,17 = 0,366 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
|
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
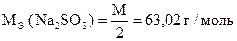
2. Анализ технического сульфида натрия
Химическая сущность
1) Na2S + J2 = S ¯ + 2NaJ + [J2]
|
| 1 | S2- - 2e- = S |
| 1 | J2 + 2e- = 2J- |
| S2- + J2 = S ¯ + 2J- |
j 0 S / S2- = - 0,464 B
j 0 J2 / 2J- = + 0,536 B
Dj = 0,536 + 0,464 = 1,00 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
|
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
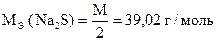
7.3. Условия титрования восстановителей
1. Иод – летучее вещество, поэтому титрование в этом методе проводят без нагревания. Это необходимо также и потому, что с повышением температуры понижается чувствительность крахмала как индикатора.
2. Иодометрическое титрование нельзя проводить в щелочной среде, т.к. иод реагирует со щелочами с образованием гипоиодида.
J2 + 2NaOH = NaJO + NaJ + H2O
|
| 1 | J0 + 1e- = J- |
| 1 | J0 + 2OH- - 1e- = JO- + H2O |
| J2 + 2OH- = J- + JO- + H2O |
рН раствора не должен превышать 9.
3. Иодометрическое титрование нельзя проводить в кислой среде, т.к. будет разлагаться тиосульфат натрия
Na2S2O3 + 2HCl = 2NaCl + SO2 + S ¯ + H2O
Поэтому перед титрованием раствор разбавляют дистиллированной водой.
4. Так как реакция между раствором восстановителя и J2 протекает медленно, то приступать к титрованию избытка J2 следует спустя некоторое время..
5. Смесь (восстановитель + раствор иода) перед титрованием помещают в темное место, закрыв колбу для титрования часовым стеклом, т.к. иод летуч, а свет в кислой среде ускоряет побочную реакцию (окисление J- до J2 кислородом воздуха).
4KJ + O2 + 4HCl = 2J2 + 4KCl + 2H2O
| 1 | O2 + 4H+ + 4e- = 2H2O |
| 2 | 2J- - 2e- = J2 |
| 4J- + O2 + 4H+ = 2J2 + 2H2O |
8. Расчеты в иодометрическом методе анализа








