Определение активного хлора в белильной извести (анализ хлорной извести)
Хлорную известь получают путем насыщения хлором гашеной извести
2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(OCl)2 + 2H2O

Химическая сущность
CaOCl2 + 2HCl = CaCl2 + Cl2 + H2O
| 1 | OCl- + 2H+ + 1e- = Cl0 + H2O |
| 1 | Cl- - 1e- = Cl0 |
| OCl- + Cl- + 2H+ = Cl2 + H2O |
Cl2 + 2KJ = J2 + 2KCl
| 1 | Cl2 + 2e- = 2Cl- |
| 1 | 2J- - 2e- = J2 |
| Cl2 + 2J- = 2Cl- + J2 |
| CaOCl2 + 2KJ + 2HCl = J2 + CaCl2 + 2KCl + H2O |
J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
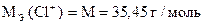
| Количество моль-экв J2 | = | количество моль-экв Cl+ |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв Cl+ | = | количество моль-экв Na2S2O3 ×5H2O |
7. Анализ восстановителей иодометрическим методом
7.1. Способ прямого титрования
Прямое титрование в иодометрическом методе применяют для определения восстановителей: Na2S2O3 , Na3AsO3 в бикарбонатной среде, H2S в сероводородной воде, сульфидов (Na2S, K2S) в малых концентрациях.
Раствор анализируемого восстановителя (аликвота или точно взвешенная навеска) оттитровывается в определенных условиях стандартным раствором иода в присутствии индикатора крахмала. Точку эквивалентности определяют по появлению устойчивой синей окраски от одной избыточной капли стандартного раствора иода.
ПРИМЕРЫ
1. Анализ технического тиосульфата натрия
Химическая сущность
2Na2S2O3 + J2 = Na2S4O6 + 2NaJ
| 1 | 2S2O32- - 2e- = S4O62- |
| 1 | J2 + 2e- = 2J- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B

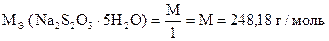
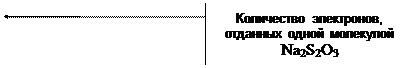
2. Определение арсенита натрия Na3 As O3
Химическая сущность
 Na3AsO3 + J2 + H2O Na3AsO4 + 2HJ
Na3AsO3 + J2 + H2O Na3AsO4 + 2HJ
| 1 | AsO33- + H2O - 2e- = AsO43- + 2H+ |
| 1 | J2 + 2e- = 2J- |
| AsO33- + J2 + H2O = AsO43- + 2H+ + 2J- |
j 0 AsO43- / AsO33- = + 0,56 B
j 0 J2 / 2J- = + 0,54 B
Dj = 0,54 - 0,56 = - 0,02 B
Поэтому реакция склонна протекать в обратном направлении. Для того, чтобы реакция протекала достаточно полно в сторону прямой, необходимо связывать образующиеся H+-ионы. Для этого при титровании прибавляют NaHCO3.
NaHCO3 + HJ = NaJ + H2O + CO2
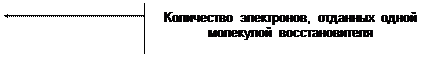
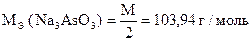
3. Определение H 2 S в сероводородной воде
Химическая сущность
Н2S + J2 = S ¯ + 2НJ
| 1 | Н2S - 2e- = S + 2Н+ |
| 1 | J2 + 2e- = 2J- |
| Н2S + J2 = S + 2Н+ + 2J- |
j 0 S / H2S = + 0,14 B
j 0 J2 / 2J- = + 0,536 B
Dj = 0,536 - 0,14 = 0,396 B
7.2. Способ обратного титрования
Обратное титрование (титрование по остатку) в иодометрическом методе применяют для определения восстановителей: Na2SO3, K2SO3, Na2S, K2S, которые в водном растворе гидролизуются с образованием щелочной среды.
Например:
Na2SO3 + HOH NaHSO3 + NaOH pH > 7
 SO32- + HOH HSO3- + OH-
SO32- + HOH HSO3- + OH-
Na2S + HOH NaHS + NaOH pH > 7

 S2- + HOH HS- + OH-
S2- + HOH HS- + OH-
В щелочной среде иод реагирует со щелочью
J2 + 2NaOH = NaJO + NaJ + H2O
| 1 | J0 + 1e- = J- |
| 1 | J0 + 2OH- - 1e- = JO- + H2O |
| J2 + 2OH- = J- + JO- + H2O |
Для устранения побочной реакции анализируемый раствор восстановителя добавляют в раствор иода, подкисленный соляной или серной кислотами.
Способ обратного титрования дает более точные результаты, чем прямое титрование, т.к. реакция между восстановителем и раствором иода идет сравнительно медленно, особенно в конце титрования, когда концентрация восстановителя становится незначительной. В результате не успевший прореагировать с восстановителем иод вызывает окрашивание крахмала, прежде чем будет достигнута точка эквивалентности, и результат определения будет заниженным.








