Хранение раствора иода
Раствор иода хранят в темных бутылях с притертой пробкой, так как иод вещество летучее, а раствор иодида калия на свету окисляется кислородом воздуха.
Техника безопасности
Пары иода отравляют воздух лаборатории и вызывают коррозию металлических частей приборов. Поэтому пересыпание иода, возгонку и другие операции необходимо проводить под тягой. Особенно следует защищать от воздействия паров иода аналитические весы.
5. Стандартизация раствора иода
Стандартизацию приготовленного раствора иода проводят по стандартному раствору тиосульфата натрия прямым титрованием.
J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | 2S2O32- - 2e- = S4O62- |
| 1 | J2 + 2e- = 2J- |
| 2S2O32- + J2 = S4O62- + 2J- |
Титрование проводят в присутствии индикатора крахмала, который прибавляют в конце титрования, когда концентрация J2 будет небольшой и титруемый раствор будет иметь соломенно-желтую окраску.
В присутствии крахмала раствор приобретает синюю окраску.
Продолжают титровать стандартным раствором тиосульфата натрия до обесцвечивания раствора от одной избыточной капли Na2S2O3×5H2O.
По найденному объему Na2S2O3×5H2O и его концентрации рассчитывают СН(J2), Т(J2), К0,05Н , Т (J2/ Na2SO3).
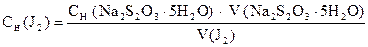
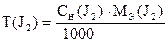
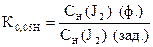
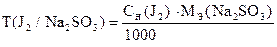
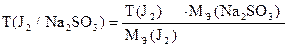
6. Анализ окислителей иодометрическим методом
6.1. Титрование по способу замещения
В иодометрическом методе анализа окислители определяют титрованием по способу замещения. Данный способ титрования применяют для анализа окислителей, стандартный потенциал которых больше, чем j0 J2 /2J- = + 0,536 B: K2Cr2O7, CrO3, KBrO3, KJO3, KClO3, CaOCl2 (белильная известь), соли Fe3+, соли Cu2+, H2O2, Na2O2, Cl2, Br2, NaNO2, KNO2, KMnO4 и др.
Прямое титрование указанных окислителей не применяют. Окислители титровать раствором KJ нельзя, так как невозможно установить точку эквивалентности (прекращение выделения иода установить нельзя).
Реакции взаимодействия Na2S2O3×5H2O с окислителями протекают нестехиометрично, поэтому окислители нельзя титровать тиосульфатом натрия.
Сущность способа замещения
К точно взятой и растворенной навеске анализируемого окислителя или к аликвоте (объем пипетки) анализируемого окислителя прибавляют избыток кислоты (HCl или H2SO4) и KJ. После завершения реакции выделяется J2, эквивалентный определяемому окислителю, который оттитровывают стандартным раствором тиосульфата натрия.
Точку эквивалентности определяют с помощью индикатора крахмала по обесцвечиванию синей окраски раствора от одной избыточной капли тиосульфата натрия.
Объем тиосульфата натрия эквивалентен количеству определяемого окислителя и используется для расчета количественного содержания окислителя.
6.2. Условия титрования окислителей
Потенциал пары J2/2J- невелик, и потому многие иодометрические реакции обратимы и до конца не доходят; только при создании надлежащих условий они протекают до конца.
1. Иод – летучее вещество, поэтому титрование в этом методе проводят без нагревания. Это необходимо также и потому, что с повышением температуры понижается чувствительность крахмала как индикатора.
2. Иодометрическое титрование нельзя проводить в щелочной среде, так как иод реагирует со щелочами с образованием гипоиодида.
J2 + 2NaOH = NaJO + NaJ + H2O
|
| 1 | J0 + 1e- = J- |
| 1 | J0 + 2OH- - 1e- = JO- + H2O |
| J2 + 2OH- = J- + JO- + H2O |
рН раствора не должен превышать 9.
3. Иодометрическое титрование нельзя проводить в кислой среде, т.к. будет разлагаться тиосульфат натрия
Na2S2O3 + 2HCl = 2NaCl + SO2 + S ¯ + H2O
Поэтому перед титрованием раствор разбавляют дистиллированной водой.
4. Растворимость иода в воде мала, поэтому при иодометрических определениях окислителей необходимо добавлять избыток KJ.
Это способствует растворению выделенного при реакции иода, который с KJ образует нестойкий комплексный ион [J3]- :
KJ + J2 K[J3]
J- + J2 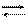
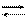 [J3]-
[J3]-
5. Скорость реакции между определяемым окислителем и J- –ионами оказывается обычно недостаточной. Поэтому к титрованию выделившегося иода приступают лишь через некоторое время после прибавления окислителя.
6. Реакционную смесь сохраняют в темноте, закрыв колбу для титрования часовым стеклом, так как иод летуч, а свет ускоряет в кислых растворах побочную реакцию окисления J--ионов до J2 кислородом воздуха:
4KJ + O2 + 4HCl = 2J2 + 4KCl + 2H2O
| 1 | O2 + 4H+ + 4e- = 2H2O |
| 2 | 2J- - 2e- = J2 |
| 4J- + O2 + 4H+ = 2J2 + 2H2O |
6.3. Примеры
Анализ технического дихромата калия
Химическая сущность
1) K2Cr2O7 + 6KJ + 14HCl = 8KCl + 2CrCl3 + 3J2 + 7H2O
| 1 | Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O |
| 3 | 2J- - 2e- = J2 |
| Cr2O72- + 6J- + 14H+ = 2Cr3+ + 3J2 + 7H2O |
j 0 Cr2O72- / 2Cr3+ = + 1,33 B
j 0 J2 / 2J- = + 0,536 B
Dj = 1,33 - 0,536 = 0,794 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
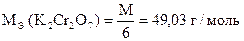
| Количество моль-экв J2 | = | количество моль-экв K2Cr2O7 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв K2Cr2O7 | = | количество моль-экв Na2S2O3 ×5H2O |
Анализ технического хлората калия
Химическая сущность
1) KClO3 + 6KJ + 6HCl = 7KCl + 3J2 + 3H2O
| 1 | ClO3- + 6H+ + 6e- = Cl- + 3H2O |
| 3 | 2J- - 2e- = J2 |
| ClO3- + 6J- + 6H+ = Cl- + 3J2 + 3H2O |
j 0 ClO3- / Cl- = + 1,45 B
j 0 J2 / 2J- = + 0,536 B
Dj = 1,45 - 0,536 = 0,914 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
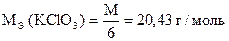
| Количество моль-экв J2 | = | количество моль-экв KClO3 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв KClO3 | = | количество моль-экв Na2S2O3 ×5H2O |
Анализ технического перманганата калия
Химическая сущность
1) 2KMnO4 + 10KJ + 8H2SO4 = 2MnSO4 + 5J2 + 6K2SO4 + 8H2O
| 2 | MnO4- + 8H+ + 5e- = Mn2+ + 4H2O |
| 5 | 2J- - 2e- = J2 |
| 2MnO4- + 10J- + 16H+ = 2Mn2+ + 5J2 + 8H2O |
j 0 MnO4- / Mn2+ = + 1,51 B
j 0 J2 / 2J- = + 0,536 B
Dj = 1,51 - 0,536 = 0,974 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
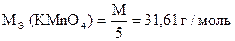
| Количество моль-экв J2 | = | количество моль-экв KMnO4 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв KMnO4 | = | количество моль-экв Na2S2O3 ×5H2O |
Анализ технического иодата калия
Химическая сущность
1) KJO3 + 5KJ + 6HCl = 6KCl + 3J2 + 3H2O
| 1 | JO3- + 6H+ + 6e- = J- + 3H2O |
| 3 | 2J- - 2e- = J2 |
| JO3- + 5J- + 6H+ = 3J2 + 3H2O |
j 0 JO3- / J- = + 1,08 B
j 0 J2 / 2J- = + 0,536 B
Dj = 1,08 - 0,536 = 0,544 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
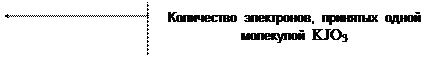
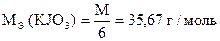
| Количество моль-экв J2 | = | количество моль-экв KJO3 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв KJO3 | = | количество моль-экв Na2S2O3 ×5H2O |
Анализ технического бромата калия
Химическая сущность
1) KBrO3 + 6KJ + 6HCl = KBr + 6KCl + 3J2 + 3H2O
| 1 | BrO3- + 6H+ + 6e- = Br- + 3H2O |
| 3 | 2J- - 2e- = J2 |
| BrO3- + 6J- + 6H+ = Br- + 3J2 + 3H2O |
j 0 BrO3- / Br- = + 1,45 B
j 0 J2 / 2J- = + 0,536 B
Dj = 1,45 - 0,536 = 0,914 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
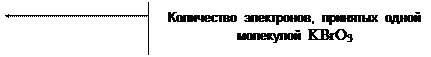
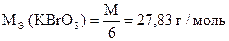
| Количество моль-экв J2 | = | количество моль-экв KBrO3 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв KBrO3 | = | количество моль-экв Na2S2O3 ×5H2O |
Анализ технического хлорида железа (III)
Химическая сущность
1) 2FeCl3 + 2KJ = 2FeCl2 + 2KCl + J2
| 2 | Fe3+ + 1e- = Fe2+ |
| 1 | 2J- - 2e- = J2 |
| 2Fe3+ + 2J- = J2 + 2Fe2+ |
j 0 Fe3+ / Fe2+ = + 0,77 B
j 0 J2 / 2J- = + 0,536 B
Dj = 0,77 - 0,536 = 0,234 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
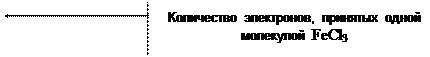
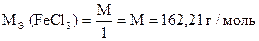
| Количество моль-экв J2 | = | количество моль-экв FeCl3 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв FeCl3 | = | количество моль-экв Na2S2O3 ×5H2O |
Анализ перекиси водорода
Химическая сущность
1) H2O2 + 2KJ + 2HCl = 2KCl + J2 + 2H2O
| 1 | H2O2 + 2H+ + 2e- = 2H2O |
| 1 | 2J- - 2e- = J2 |
| H2O2 + 2J- + 2H+ = J2 + 2H2O |
j 0 H2O2 / H2O = + 1,77 B
j 0 J2 / 2J- = + 0,536 B
Dj = 1,77 - 0,536 = 1,234 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
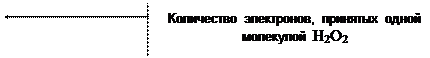
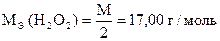
| Количество моль-экв J2 | = | количество моль-экв H2O2 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв H2O2 | = | количество моль-экв Na2S2O3 ×5H2O |
Анализ технического сульфата меди
Химическая сущность
1) 2CuSO4 + 4KJ = 2CuJ ¯ + J2 + 2K2SO4
| 2 | Cu2+ + J- + 1e- = CuJ ¯ |
| 1 | 2J- - 2e- = J2 |
| 2Cu2+ + 4J- = 2CuJ ¯ + J2 |
j 0 Cu2+ / CuJ = + 0,86 B
j 0 J2 / 2J- = + 0,536 B
Dj = 0,86 - 0,536 = 0,324 B
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | J2 + 2e- = 2J- |
| 1 | 2S2O32- - 2e- = S4O62- |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B

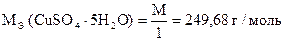
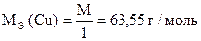
| Количество моль-экв J2 | = | количество моль-экв CuSO4 ×5H2O |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв CuSO4 ×5H2O | = | количество моль-экв Na2S2O3 ×5H2O |








