Хранение раствора тиосульфата натрия
Хранят раствор в бутылях из темного стекла (свет благоприятствует размножению в растворе тиобактерий), закрытых пробкой с хлоркальциевой трубкой, заполненной натронной известью (CaO + NaOH + прокалить) для поглощения CO2 из воды и воздуха
CaO + CO2 = CaCO3
2NaOH + CO2 = Na2CO3 + H2O
3. Стандартизация раствора тиосульфата натрия
Стандартизацию раствора тиосульфата натрия проводят по следующим стандартным веществам:
· х.ч. иоду - J2;
· х.ч. иодату калия - KJO3;
· х.ч. бромату калия - KBrO3;
· х.ч. дихромату калия - K2Cr2O7.
На практике чаще всего используют х.ч. K2Cr2O7, так как:
1. K2Cr2O7 может быть получен химически чистым путем перекристаллизации.
2. K2Cr2O7 точно соответствует своей формуле. Он устойчив в твердом состоянии и в растворе.
Недостатками дихромата калия является образование в результате реакции Cr3+-ионов зеленой окраски, затрудняющих фиксирование точки эквивалентности. Чтобы ослабить эту окраску, раствор перед титрованием сильно разбавляют водой.
K2Cr2O7 является сильным окислителем
j 0 Cr2O72-/2Cr3+ = + 1,33 В
окисляет тиосульфат натрия
j 0 S4O62-/ 2S2O32- = + 0,09 В
Но реакция протекает сложно, нестехиометрично и не может быть выражена одним уравнением. Поэтому непосредственно титровать дихромат калия тиосульфатом натрия нельзя. В этом случае используют способ замещения.
Этот способ заключается в замещении более сильного окислителя на более слабый окислитель - J2, с которым Na2S2O3 реагирует в строго эквивалентных количествах. Аликвоту раствора K2Cr2O7 (объем пипетки) обрабатывают в кислой среде избытком KJ.
В результате реакции выделяется иод в количестве, эквивалентном дихромату калия. Выделившийся иод титруют стандартным раствором тиосульфата натрия.
Выражается этот способ определения двумя уравнениями реакций:
1) K2Cr2O7 + 6KJ + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 +3J2 + 7H2O
| 1 | Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O |
| 3 | 2J- - 2e- = J2 |
| Cr2O72- + 14H+ +6J- = 2Cr3+ + 3J2 + 7H2O |
K2Cr2O7 замещается эквивалентным количеством иода, который оттитровывают раствором тиосульфата.
2) J2 + 2Na2S2O3 = Na2S4O6 + 2NaJ
| 1 | 2S2O32- - 2e- = S4O62- |
| 1 | J2 + 2e- = 2J- |
| 2S2O32- + J2 = S4O62- + 2J- |
| Количество моль-экв J2 | = | количество моль-экв K2Cr2O7 |
| Количество моль-экв J2 | = | количество моль-экв Na2S2O3 ×5H2O |
| Количество моль-экв K2Cr2O7 | = | количество моль-экв Na2S2O3 ×5H2O |
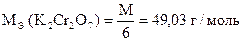
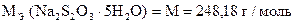
4. Приготовление стандартного раствора иода
Иод обычно содержит примеси хлора, различные соединения иода с другими галогенидами (JCl, JBr, JCl3), а также гигроскопическую воду. Очищают иод от примесей возгонкой или сублимацией.
Иод летуч. Поэтому при приготовлении раствора иода приблизительной концентрации его взвешивают на технических весах в закрытом бюксе.
Иод плохо растворим в воде, поэтому его растворяют в концентрированном растворе KJ, с которым он образует растворимый комплексный ион красно-бурого цвета [(J2)J]- или [J3]-. Чтобы растворение произошло достаточно легко и быстро, нужно брать тройное (в сравнении с массой иода) количество иодида калия KJ.
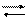 KJ + J2 K[J3]
KJ + J2 K[J3]
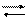 J- + J2 [J3] -
J- + J2 [J3] -
j 0 [J3]- / 3J- = + 0,545 B
j 0 J2 / 2J- = + 0,536 B








