2. Приготовление стандартного раствора тиосульфата натрия.. 3
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
ИОДОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
СОДЕРЖАНИЕ
1. Теоретические основы иодометрического метода анализа.. 2
2. Приготовление стандартного раствора тиосульфата натрия.. 3
3. Стандартизация раствора тиосульфата натрия.. 4
4. Приготовление стандартного раствора иода.. 5
5. Стандартизация раствора иода.. 6
6. Анализ окислителей иодометрическим методом... 7
6.1. Титрование по способу замещения. 7
6.2. Условия титрования окислителей. 7
6.3. Примеры.. 8
Анализ технического дихромата калия. 8
Анализ технического хлората калия. 9
Анализ технического перманганата калия. 10
Анализ технического иодата калия. 10
Анализ технического бромата калия. 11
Анализ технического хлорида железа (III) 12
Анализ перекиси водорода. 12
Анализ технического сульфата меди. 13
Определение активного хлора в белильной извести (анализ хлорной извести) 14
7. Анализ восстановителей иодометрическим методом... 15
7.1. Способ прямого титрования. 15
7.2. Способ обратного титрования. 16
7.3. Условия титрования восстановителей. 19
8. Расчеты в иодометрическом методе анализа.. 19
8.1. Вычисление массы навески для приготовления растворов. 19
8.2. Вычисление концентрации стандартных растворов. 21
8.3. Вычисление процентного содержания окислителей. 23
8.4. Вычисление процентного содержания восстановителей. 25
9. Опорный конспект по иодометрическому методу анализа.. 29
1. Теоретические основы иодометрического метода анализа
Иодометрический метод анализа основан на окислительно-восстановительных реакциях, связанных с окислением J- ионов до J2 и восстановлением J2 до J- ионов:
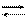 2J- - 2e- J2
2J- - 2e- J2
j0 J2 /2J- = + 0,536 B
Из стандартного потенциала пары J2 / 2J- следует, что в отличие от применявшихся ранее стандартных растворов окислителей в методах редоксиметрии (KMnO4, K2Cr2O7) свободный J2 является относительно слабым окислителем. Наоборот, J--ион – более сильный восстановитель, чем ионы Cr3+ и Mn2+.
Отсюда возникает возможность двоякого использования окислительно-восстановительных свойств пары J2 / 2J- в титриметрическом анализе: для определения восстановителей - окислением их раствором иода и для определения окислителей - восстановлением J- -ионами.
В методе применяют два стандартных раствора:
· Na2S2O3 ×5H2O (тиосульфат натрия) – восстановитель;
· J2 (иод) – окислитель.
Для определения момента эквивалентности в качестве индикатора используют чувствительный реактив на иод – раствор крахмала, который образует с иодом смешанное комплексно-адсорбционное соединение интенсивного синего цвета. При титровании раствором иода конец реакции определяют по появлению неисчезающей синей окраски. При титровании иода раствором тиосульфата натрия – по исчезновению синей окраски.
Раствор крахмала прибавляют в конце титрования, когда иода останется очень мало и титруемый раствор будет иметь соломенно-желтую окраску. Если прибавить крахмал раньше, когда иода в растворе еще много, то образуется в большом количестве соединение иода с крахмалом, которое медленно реагирует с тиосульфатом натрия. Поэтому раствор легко перетитровать.
Основной реакцией метода иодометрии, по которой определяют молярные массы эквивалентов Na2S2O3×5H2O и J2, является реакция восстановления J2 раствором тиосульфата натрия с образованием Na2S4O6 – тетратионата натрия
2Na2S2O3 + J2 = Na2S4O6 + 2NaJ
| 2S2O32- - 2e- = S4O62- | (окисление) |
| J2 + 2e- = 2J- | (восстановление) |
| 2S2O32- + J2 = S4O62- + 2J- |
j 0 J2 / 2J- = + 0,536 B
j 0 S4O62- / 2S2O32- = + 0,09 B
Dj = 0,536 - 0,09 = 0,446 B
Структурно реакцию можно представить так:
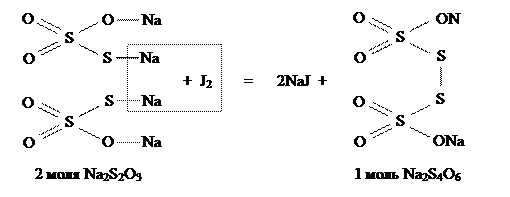
Из полуреакции окисления видно, что 2S2O32- отдают 2e-, что соответствует 2 молекулам Na2S2O3 , а одной молекуле Na2S2O3 будет соответствовать 1e-, поэтому
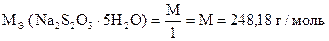
Из полуреакции восстановления видно, что 1 молекула J2 принимает 2e-, поэтому
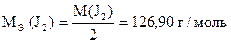
2. Приготовление стандартного раствора тиосульфата натрия
Тиосульфат натрия Na2S2O3×5H2O представляет собой белое кристаллическое вещество. Несмотря на то, что при определенных условиях он может быть получен химически чистым, приготовить стандартный раствор сразу точной концентрации по точной навеске нельзя.
Тиосульфат натрия является соединением неустойчивым, т.к.
1. Na2S2O3×5H2O легко теряет кристаллизационную воду.
2. Окисляется кислородом воздуха
2Na2S2O3 + O2 = 2Na2SO4 + 2S ¯
| 2 | S2O32- + H2O – 2e- = S + SO42- + 2H+ |
| 1 | O2 + 4H+ + 4e- = 2H2O |
| 2S2O32- + O2 = 2S + 2SO42- |
Под влиянием кислорода воздуха концентрация тиосульфата натрия уменьшается.
3. Поглощает CO2
Na2S2O3 + CO2 + H2O = NaHSO3 + NaHCO3 + S ¯
Под влиянием CO2 концентрация тиосульфата натрия увеличивается, т.к. образующийся NaHSO3 окисляется J2
NaHSO3 + J2 + H2O = NaHSO4 + 2HJ
| 1 | HSO3- + H2O – 2e- = HSO4- + 2H+ |
| 1 | J2 + 2e- = 2J- |
| HSO3- + J2 + H2O = HSO4- + 2H+ + 2J- |

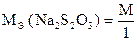
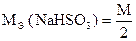
Следовательно, из 1 моль-эквивалента Na2S2O3 образуется 2 моль-эквивалента NaHSO3.
При приготовлении раствора добавляют Na2CO3
Na2CO3 + CO2 + H2O = 2NaHCO3
4. Разлагается микроорганизмами (тиобактериями).
Под влиянием микроорганизмов концентрация тиосульфата уменьшается.
Стандартный раствор тиосульфата натрия готовят приблизительной концентрации: навеску взвешивают на технических весах, для растворения используют свежепрокипяченную и охлажденную дистиллированную воду.
К установке точной концентрации приступают через 1-2 дня.








