Способ 2. По простому титру (по рабочему раствору).
Иодометрия.
Иодометрический метод объемного анализа основан на окислительно-восстановительных процессах, связанных с реакцией восстановления: I2 + 2e = 2I- или с реакцией окисления:
2I- -2e = I2 . Стандартный потенциал Е0 (I2 / 2I-) = +0,54В и все восстановители, у которых окислительно-восстановительный потенциал меньше +0,54В, способны окисляться иодом. А все окислители, имеющие потенциал больше +0,54В, способны восстанавливаться иодид-ионами. Отсюда возникает возможность использования свойств окислительно-восстановительной пары I2 / 2I- в титриметрическом анализе:
а) для определения восстановителей окислением их раствором иода;
б) для определения окислителей восстановлением иодид-ионами;
в) для определения кислот (косвенным методом титрования).
Определение восстановителей.
Определение небольших концентраций сильных восстановителей, у которых ОВ-потенциал значительно меньше +0,54В, можно проводить прямым титрованием раствора иода.
Например, пр действии иодом на тиосульфат натрия происходит реакция:
2Na2S2O3 + I2 = 2NaI + Na2S4O6
1 | 2S2O32- -2e = S4O62-
1 | I2 + 2e = 2I-
Молекула иода I2 отнимает по одному электрону у двух ионов S2O32- и окисляет их до тетратионат-иона - S4O62- . Атомы иода восстанавливаются за счет этого до ионов I- . Зная нормальную концентрацию раствора иода и затраченный на титрование объем, вычисляют массу тиосульфата натрия в анализируемом растворе.
Если ОВ-потенциал восстановителя приближается к +0,54В, то применяют метод обратного титрования. В этом случае к анализируемому раствору прибавляют избыток рабочего раствора иода. Реакционную смесь выдерживают 5 – 10 мин. После окончания реакции избыток иода оттитровывают рабочим раствором Na2S2O3∙5H2O.
Например: определить массу Na3AsO3 в растворе, если к нему добавлено 50 мл 0,02н раствора иода а на титрование избытка иода затрачено 10 мл 0,05н раствора Na2S2O3∙5H2O.
Na3AsO3 + I2 + HOH → Na3AsO4 + 2HI
1| AsO33- + HOH -2e → AsO43- + 2H+
1| I2 + 2e = 2I-
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Э(Na3AsO3) = 
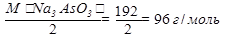
Решение.
1).Определяем избыток объема раствора иода, оттитрованного раствором Na2S2O3∙5H2O.
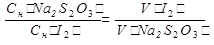
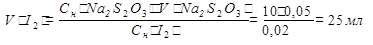
2).Определяем объем раствора иода, который вступил в реакцию с Na3AsO3 .
Vобщ(I2) - Vизб(I2) = 50-25 = 25мл
3).Определяем массу Na3AsO3.
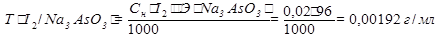
m(Na3AsO3) = 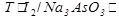 ∙V(I2) = 0,00192∙25 = 0,048 г
∙V(I2) = 0,00192∙25 = 0,048 г
Определение окислителей.
При иодометрическом определении окислителей к исследуемому раствору прибавляют избыток иодида калия, из которого окислитель выделяет строго эквивалентное количество свободного иода. Последний оттитровывают раствором восстановителя в присутствии крахмала и вычисляют содержание окислителя. Например, если к подкисленному раствору перманганата калия добавить иодид калия, то произойдет следующая реакция:
2KMnO4 + 10KI + 8H2SO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
MnO4- +8H+ +5e→ Mn2+ + 4H2O | 1
I- + e → I0 | 5
В ходе реакции перманганат окисляет ионы иода I- до эквивалентного количества иода I2 .Этот иод оттитровывают тиосульфатом натрия и вычисляют нормальную концентрацию раствора перманганата калия. Затраченное количество тиосульфата натрия эквивалентно количеству перманганата калия и эквивалентно количеству выделившегося иода:
n(I2) = n(KMnO4) = n(Na2S2O3)
Пример: Рассчитать массу K2Cr2O7 , содержащегося в 10 мл раствора, если при добавлении к нему избытка KI и H2SO4 , на титрование выделившегося иода расходуется 20 мл 0,02н раствора Na2S2O3∙5H2O.
Решение: K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + К2SO4 + Cr2(SO4)3 + 7H2O
Cr2O72- +14H+ +6e→ 2Cr3+ + 7H2O | 1
2I- +2 e = I20 | 3
Cr2O72- +14H+ +6I- →2Cr3+ + 7H2O +3I2
Э(K2Cr2O7) = 
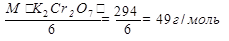
Э(I2) = 
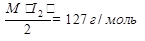
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
2S2O32- -2e = S4O62- | 1
I2 + 2e = 2I- | 1
Количество выделившегося иода эквивалентно количеству бихромата калия, выделившийся иод оттитровывают тиосульфатом натрия. Затраченное количество тиосульфата эквивалентно количеству бихромата калия, выделившийся иод оттитровывают тиосульфатом натрия. Затраченное количество тиосульфата натрия косвенно эквивалентно количеству бихромата калия:
n(I2) = n(K2Cr2O7) = n(Na2S2O3)
Расчет. Способ 1. Через титр по определяемому веществу.
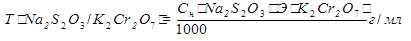
m(K2Cr2O7) = 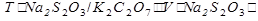
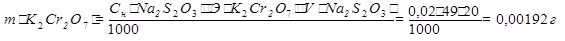
Способ 2. По простому титру (по рабочему раствору).
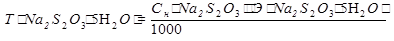
m(Na2S2O3∙5H2O) = 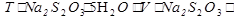 ∙
∙
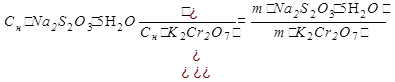
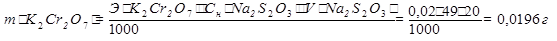
Способ 3
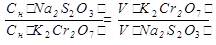
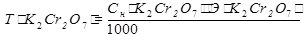
m(K2Cr2O7) = 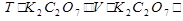 =0,0196г
=0,0196г
Определение кислот.
Этот метод основан на использовании реакции иодида калия с иодатом, т.е. косвенным методом титрования. Например:
HCl + KI + KIO3 → I2 + H2O + KCl
2IO3- + 12 H+ +10e → I20 + 6H2O | 1
2I- +2 e = I20 | 5
IO3- + 5I- + 6H+ → 3I2 + 3H2O
Количество выделившегося иода эквивалентно количеству ионов водорода. Количества KI и KIO3 взяты с избытком, сюда же добавляют исследуемый раствор HCl. Выделившийся иод оттитровывают раствором Na2S2O3∙5H2O.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Метод применим для кислот: муравьиной, аскорбиновой, малеиновой, щавелевой, а также кислот, содержащихся в пищевых продуктах: соках, винах, маслах, жирах. Метод определения кислот иодометрически отличается большей точностью, чем кислотно-основной. Точность в иодометрии 10-8 г/л, в нейтрализации 10-4 г/л.
Приготовление рабочих растворов.
Рабочими растворами данного метода являются титрованные растворы иода и тиосульфата натрия. Основная реакция:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
1 | 2S2O32- -2e = S4O62-
1 | I2 + 2e = 2I-
Э(I2) =М(I2) /2 =127 г/моль
Э(Na2S2O3∙5Н2О) =М(Na2S2O3∙5Н2О) /2 =248 г/моль
Рабочий раствор иода готовят по точной навеске иода. Устанавливают концентрацию раствора иода по титрованному раствору тиосульфата натрия. Иод плохо растворим в воде, поэтому его обрабатывают раствором KI для образования растворимого комплекса:
I2 + KI ↔ K[I3]
Рабочий раствор тиосульфата натрия приготовить точно нельзя, т.к. он неустойчив в хранении. Точную его концентрацию устанавливают по х.ч. раствору K2Cr2O7 или KIO3 .
В качестве индикатора применяют 5% раствор крахмала.
При титровании иодом в присутствии крахмала конец реакции определяют по появлению синей окраски, не исчезающей от одной лишней капли раствора иода. Можно титровать раствор иода тиосульфатом до обесцвечивания синего раствора от одной капли Na2S2O3∙5Н2О. В этом случае крахмал добавляют в конце титрования, когда раствор имеет соломенно-желтую окраску.
Крахмал не растворяется в воде. Однако нагреванием взвеси его до кипения удается получить коллоидный раствор, который и используется в иодометрии. Чувствительность крахмала к водному раствору иода довольно велика, но она еще более увеличивается в присутствии иодида калия. Поэтому считают, что крахмал образует адсорбционное соединение синего цвета в присутствии полииодид-иона [I3]- .С повышением температуры чувствительность иод-крахмальной реакции сильно снижается.
Условия проведения иодометрии.
1. Титрование ведут на холоду, т.к. иод - летучее вещество и к тому же чувствительность крахмала понижается с повышением температуры.
2. Иодометрическое определение нельзя проводить проводить при рН>7, т.к. иод реагирует с ОН- группами:
I2 +2OH- = IO- +I- +H2O
3. Растворимость I2 мала в воде, поэтому при иодометрических определениях окислителей, кислот необходимо применять избыток KI , который способствует ускорению реакции и более полному течению ее в нужном направлении:
I2 + KI ↔ K[I3]
Лабораторная работа.








