Отсюда тривиальное название фенола – карболовая кислота.
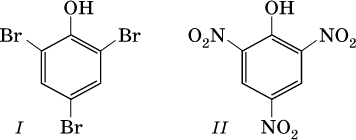
Отметим, что группа ОН в феноле никогда не замещается ни на какие другие группы или атомы, но делает более подвижными атомы водорода бензольного кольца. Так, фенол легко реагирует с бромом в воде и азотной кислотой, образуя соответственно 2,4,6‑трибромфенол (I) и 2,4,6‑тринитрофенол (II, традиционное название – пикриновая кислота):
Фенол в промышленности получают нагреванием хлорбензола с раствором гидроксида натрия под давлением при 250 °C:
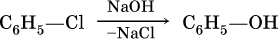
Фенол применяют в качестве сырья для производства пластмасс и смол, полупродуктов для лакокрасочной и фармацевтической промышленности, как дезинфицирующее средство.
10.2. Альдегиды и кетоны
Альдегиды и кетоны – это производные углеводородов, содержащие функциональную карбонильную группу СО. В альдегидах карбонильная группа связана с атомом водорода и одним радикалом, а в кетонах с двумя радикалами.
Общие формулы:
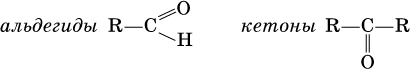
Названия распространенных веществ этих классов приведены в табл. 10.
Метаналь – бесцветный газ с резким удушающим запахом, хорошо растворим в воде (традиционное название 40 %‑ного раствора– формалин), ядовит. Последующие члены гомологического ряда альдегидов – жидкости и твердые вещества.
Простейший кетон – пропанон‑2, более известный под названием ацетон, при комнатной температуре – бесцветная жидкость с фруктовым запахом, tкип = 56,24 °C. Хорошо смешивается с водой.
Химические свойства альдегидов и кетонов обусловлены присутствием в них карбонильной группы СО; они легко вступают в реакции присоединения, окисления и конденсации.

В результате присоединения водорода к альдегидам образуются первичные спирты:
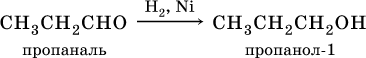
При восстановлении водородом кетонов образуются вторичные спирты:
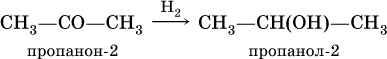
Реакция присоединения гидросульфита натрия используется для выделения и очистки альдегидов, так как продукт реакции малорастворим в воде:
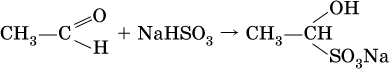
(действием разбавленных кислот такие продукты превращаются в альдегиды).
Окисление альдегидов проходит легко под действием кислорода воздуха (продукты – соответствующие карбоновые кислоты). Кетоны сравнительно устойчивы к окислению.
Альдегиды способны участвовать в реакциях конденсации. Так, конденсация формальдегида с фенолом протекает в две стадии. Вначале образуется промежуточный продукт, являющийся фенолом и спиртом одновременно:
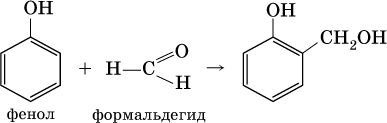
Затем промежуточный продукт реагирует с другой молекулой фенола, и в результате получается продукт поликонденсации – фенолформальдегидная смола:
Качественная реакция на альдегидную группу – реакция «серебряного зеркала», т. е. окисление группы С(Н)O с помощью оксида серебра (I) в присутствии гидрата аммиака:
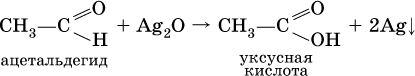
Аналогично протекает реакция с Cu(ОН)2, при нагревании появляется красный осадок оксида меди (I) Cu2O.
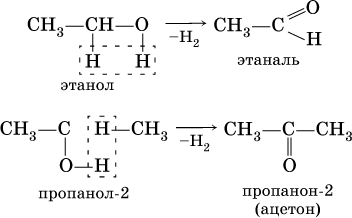
Получение: общий способ для альдегидов и кетонов – дегидрирование (окисление) спиртов. При дегидрировании первичных спиртов получают альдегиды, а при дегидрировании вторичных спиртов – кетоны. Обычно дегидрирование протекает при нагревании (300 °C) над мелкораздробленной медью:
При окислении первичных спиртов сильными окислителями (перманганат калия, дихромат калия в кислотной среде) процесс трудно остановить на стадии получения альдегидов; альдегиды легко окисляются до соответствующих кислот:
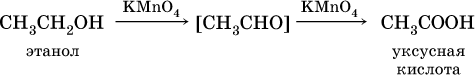
Более подходящим окислителем является оксид меди (II):
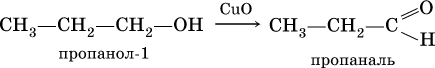
Ацетальдегид в промышленности получают по реакции Кучерова (см. 19.3).
Наибольшее применение из альдегидов имеют метаналь и этаналь. Метаналь используют для производства пластмасс (фенопластов), взрывчатых веществ, лаков, красок, лекарств. Этаналь – важнейший полупродукт при синтезе уксусной кислоты и бутадиена (производство синтетического каучука). Простейший кетон – ацетон используют в качестве растворителя различных лаков, ацетатов целлюлозы, в производстве кинофотопленки и взрывчатых веществ.
10.3. Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН (карбоксил).
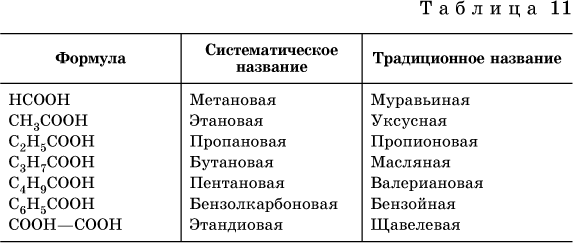
Формулы и названия некоторых распространенных карбоновых кислот приведены в табл. 11.
Традиционные названия кислот НСООН (муравьиная), СН3СООН (уксусная), С6Н5СООН (бензойная) и (СООН)2 (щавелевая) рекомендуется использовать вместо их систематических названий.
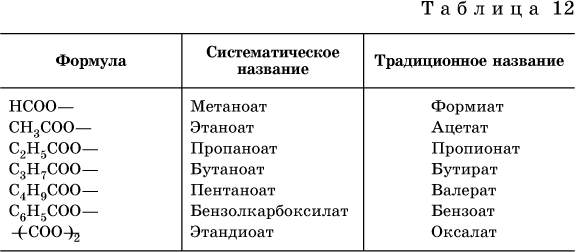
Формулы и названия кислотных остатков приведены в табл. 12.
Для составления названий солей этих карбоновых кислот (а также их сложных эфиров, см. ниже) обычно используются традиционные названия, например:
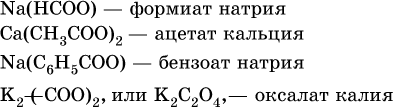
Низшие карбоновые кислоты – бесцветные жидкости с резким запахом. При увеличении молярной массы температура кипения возрастает.
Карбоновые кислоты обнаружены в природе:

Простейшие карбоновые кислоты растворимы в воде, обратимо диссоциируют в водном растворе с образованием катионов водорода:
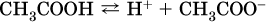
и проявляют общие свойства кислот:
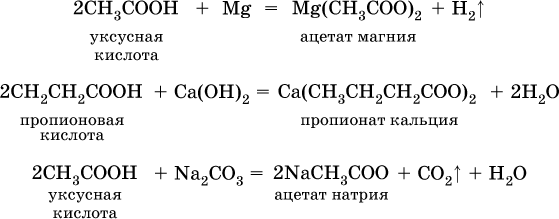
Важное практическое значение имеет взаимодействие карбоновых кислот со спиртами (подробнее см. ниже):
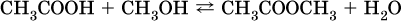
Отметим, что кислота НСООН вступает в реакцию «серебряного зеркала» как альдегиды:
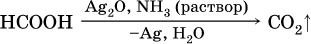
и разлагается под действием водоотнимающих реактивов:
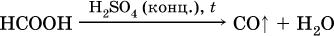
Получение:
• окисление альдегидов:
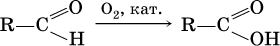
• окисление углеводородов:
а)
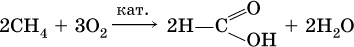
б)
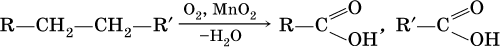
Кроме того, муравьиную кислоту получают по схеме:
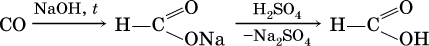
а уксусную кислоту – по реакции:
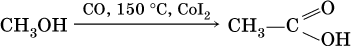
Применяют муравьиную кислоту как протраву при крашении шерсти, консервант фруктовых соков, отбеливатель, дезинфекционный препарат. Уксусную кислоту используют как сырье в промышленном синтезе красителей, медикаментов, ацетатного волокна, негорючей кинопленки, органического стекла. Натриевые и калиевые соли высших карбоновых кислот – основные компоненты мыла.
Сложные эфиры – продукты обменного взаимодействия карбоновых кислот со спиртами. Это взаимодействие называется реакцией этерификации:
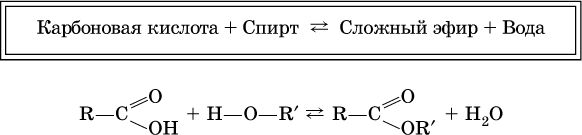
Механизм реакции этерификации был установлен при использовании спирта, меченного изотопом 18O; этот кислород после реакции оказался в составе эфира (а не воды):
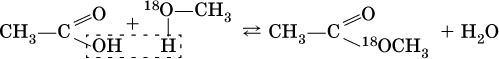
Следовательно, в отличие от реакции нейтрализации неорганической кислоты щелочью (Н+ + ОН‑ = Н2O), в реакции этерификации карбоновая кислота всегда отдает группу ОН, спирт – атом Н (образуется вода). Реакция этерификации обратима; она лучше протекает в кислотной среде, обратная реакция (гидролиз, омыление) – в щелочной среде.
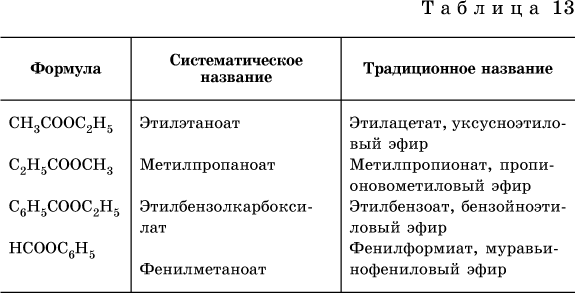
Формулы и названия распространенных сложных эфиров приведены в табл. 13.
Среди сложных эфиров есть бесцветные низкокипящие горючие жидкости с фруктовым запахом, например:
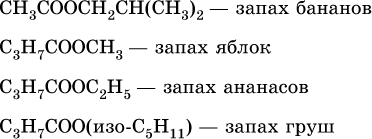
Используются сложные эфиры как растворители для лаков, красок и нитратов целлюлозы, носители фруктовых ароматов в пищевой промышленности.
Сложные эфиры трехатомного спирта – глицерина и высших карбоновых кислот (в общем виде RCOOH), например с формулами и названиями:
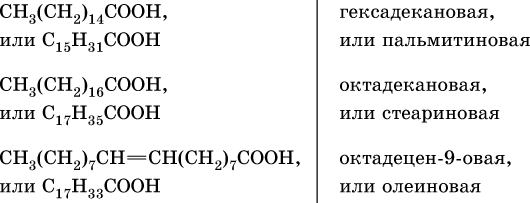
носят названия жиров. Примером жира будет смешанный сложный эфир глицерина и этих кислот:
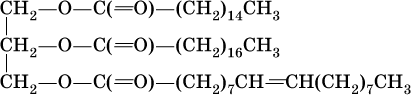
Чем выше содержание остатков олеиновой кислоты (или других ненасыщенных кислот), тем ниже температура плавления жира. Жидкие при комнатной температуре жиры называются маслами. Путем гидрогенизации, т. е. присоединения водорода по двойной связи, масла превращают в твердые жиры (например, растительное масло – в маргарин). Реакция этерификации (образования жира) обратима:
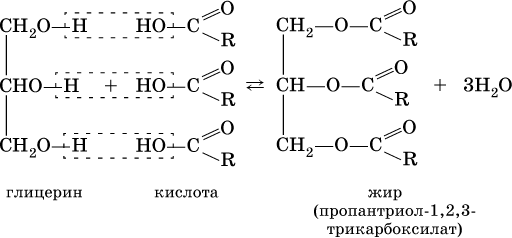
Прямая реакция лучше идет в кислотной среде, обратная реакция – гидролиз, или омыление, жира – в щелочной среде; при пищеварении жир омыляется (расщепляется) с помощью ферментов.
10.4. Углеводы
Углеводы (сахара) – важнейшие природные соединения, состоящие из углерода, водорода и кислорода. Углеводы подразделяются на моносахариды, дисахариды и полисахариды. Моносахариды не подвергаются гидролизу, а остальные углеводы при кипячении в присутствии кислот расщепляются до моносахаридов.
Моносахариды (и все другие углеводы) относятся к полифункциональным соединениям. В молекуле моносахарида имеются функциональные группы разных типов: группы ОН (спиртовая функция) и группы СО (альдегидная или кетонная функция). Поэтому различают альдозы (альдегидоспирты, спиртоальдегиды) и кетозы (кетоноспирты, спиртокетоны).
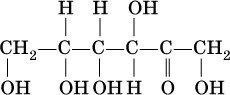
Важнейший представитель альдоз – глюкоза:
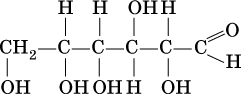
а представитель кетоз – фруктоза: