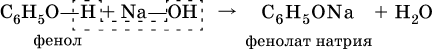Качественные реакции на алкены – обесцвечивание бромной воды и раствора КMnO4 (уравнения реакций см. выше).
Алкадиены – непредельные углеводороды, в молекулах которых содержатся две связи С=С. Общая формула алкадиенов СnН2n‑2 (n ≥ 3), формула совпадает с таковой для алкинов.
Примеры:
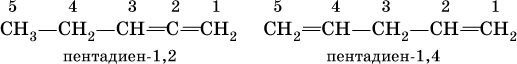
Большое практическое значение имеют сопряженные диены, в молекулах которых связи С=С разделены одинарной связью С – С:
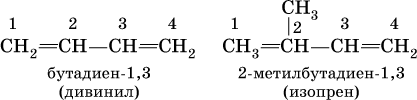
Дивинил и изопрен – традиционные названия.
Дивинил – бесцветный, легко сжижающийся (при ‑4,5 °C) газ, изопрен – низкокипящая (34,1 °C) жидкость.
Алкадиены вступают в те же реакции присоединения, что и алкены. Сопряженные диены имеют особые свойства, в частности, в реакциях присоединения; они образуют продукты 1,4‑присоединения с одной двойной связью посредине:
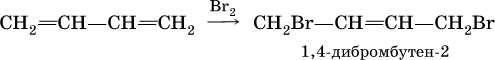
(далее возможно образование 1, 2, 3, 4‑тетрабромбутана).
Алкадиены способны полимеризоваться с образованием каучуков:
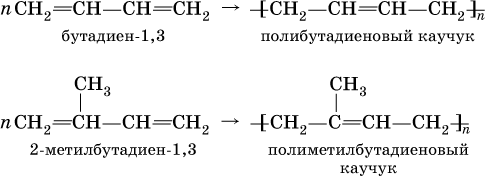
Полиметилбутадиеновый каучук – это полимер, существующий в природе (натуральный каучук), а полибутадиеновый каучук получен искусственно (С. В. Лебедев, 1932 г.) и называется синтетическим каучуком.
Получение: для алкенов в промышленности используют метод каталитического дегидрирования алканов:
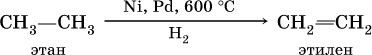
В лаборатории алкены получают:
1) дегидратацией спиртов (отщепление воды от спиртов):
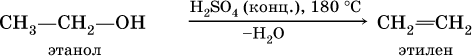
2) дегидрогалогенированиеж – отщеплением галогеноводорода от моногалогенопроизводного под действием спиртового раствора щелочи:
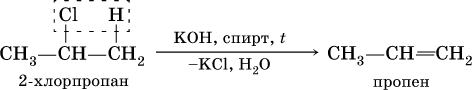
3) дегалогенированиеж – отщеплением галогенов от дигалогенопроизводных, в которых атомы галогена находятся у соседних атомов углерода:
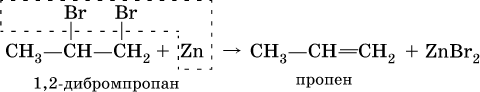
Промышленное получение дивинила:
1) дегидрирование бутана:
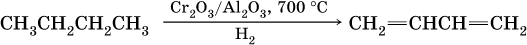
2) способ Лебедева – одновременное отщепление воды и водорода от этанола на катализаторе (ZnO/Al2O3):
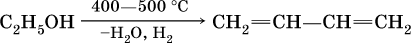
Алкены используются для органического синтеза, производства пластмасс, искусственного моторного топлива, диеновые углеводороды – исходное сырье в промышленном синтезе каучуков.
9.3. Алкины
Алкины – углеводороды с тройной связью C≡C в молекулах (непредельные углеводороды ряда ацетилена). Простейший представитель этого ряда – ацетилен С2Н2, общая формула алкинов CnH2n‑2 (при n ≥ 2).
Названия простейших алкинов:
С2Н2 – этин (традиционно: ацетилен)
С3Н4 – пропин (метилацетилен)
С4Н6 – бутин
Изомеры бутина:
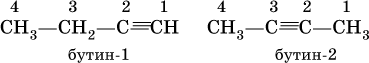
Ацетилен, пропин и бутин‑1 – бесцветные газы при комнатной температуре, бутин‑2 – легкокипящая жидкость, обладает легким «эфирным» запахом.
В алкинах атомные орбитали углерода у тройной связи имеют sp‑гибридизацию (линейное строение). Наличие двух π‑связей обусловливает их химические свойства, в частности высокую способность к реакциям ступенчатого присоединения водорода, хлора, брома, галогеноводородов, воды:
а)
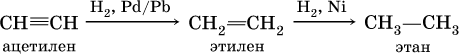
б)
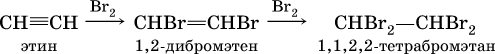
в)
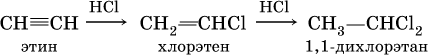
(присоединение НCl к хлорэтену происходит по правилу Марковникова; хлорэтен традиционно называют хлорвинилом или винилхлоридом);
г) реакция Кучерова (гидратация на катализаторе)
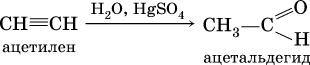
При циклизации ацетилена образуется бензол:
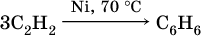
Упомянутый выше хлорвинил способен полимеризоваться:
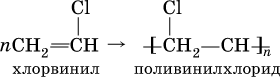
Поливинилхлорид (ПВХ) – полимер, основа пластмассы, волокон и пленок, применяется в производстве труб, искусственной кожи, электроизоляции, пеноматериалов.
Качественные реакции:
1) на алкины любого строения – обесцвечивание раствора КMnO4, чаще всего происходит разрыв углеродной цепи по месту тройной связи (ср. с алкенами);
2) на алкины с концевой тройной связью – замещение концевого атома водорода на медь (I) с образованием ярко‑красного осадка:
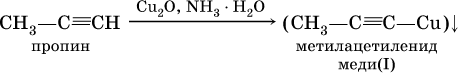
Получение: в промышленности ацетилен ранее получали гидролизом дикарбида (ацетиленида) кальция:
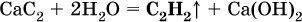
(неприятный «карбидный» запах газа обусловлен примесями, главным образом фосфином РН3).
Современный способ – пиролиз (термическое разложение) метана:
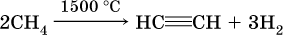
В лаборатории для получения ацетилена и его гомологов используют взаимодействие дигалогенопроизводных алканов со щелочами в спиртовом растворе при нагревании:
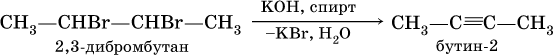
(обязательное условие – атомы галогенов должны находиться при соседних атомах углерода). Эта реакция может проходить в одну стадию (как показано выше), но чаще – в две стадии:
а)
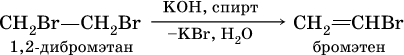
б)
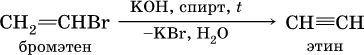
Алкины, особенно ацетилен, используются как исходное сырье в химической промышленности для многих органических синтезов. Кроме того, ацетилен благодаря высокой теплотворной способности сгорания:
применяется для автогенной сварки и резки металлов.
9.4. Арены
Арены – это непредельные углеводороды, которые можно рассматривать как производные простейшего из них – бензола С6Н6. Общая формула углеводородов гомологического ряда бензола СnН2n‑6 (при n ≥ 6).
В молекуле бензола все атомы углерода находятся в sр2‑гибридизации, каждый атом углерода соединен в одной плоскости σ‑связями с двумя другими атомами углерода и одним атомом водорода. У атома углерода остается еще облако четвертого валентного электрона, расположенное перпендикулярно плоскости. Эти облака участвуют в образовании π‑связи, причем в молекуле образуются не три отдельные π‑связи (как думали раньше, см. формулу Кекуле, 1865 г.), а единая шестицентровая (С6) π‑связь (все атомы равноценны):
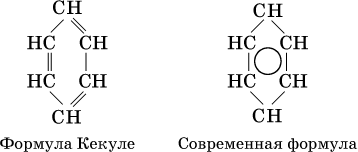
Формула Кекуле часто применяется в тех случаях, когда необходимо более наглядно представить протекание реакции с участием бензольного кольца С6; его изображение:
В обеих формулах атомы С кольца и не участвующие в реакции атомы Н опускаются (для краткости). Некоторые простейшие гомологи бензола:
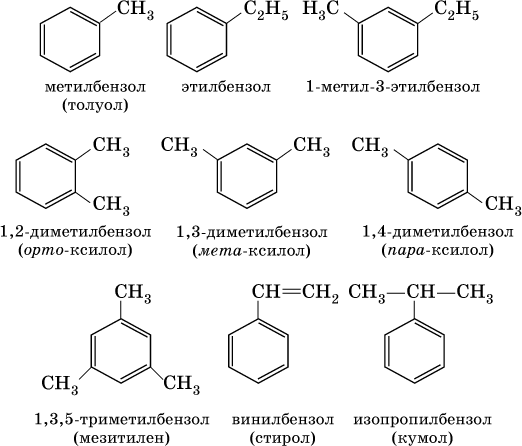
Радикал бензола С6Н5 называется фенил, радикал толуола С6Н5СН2 – бензил.
Бензол и его ближайшие гомологи – жидкости без цвета, но с характерным запахом, имеют широкий интервал жидкого состояния. Практически не растворяются в воде, но хорошо смешиваются между собой и с другими органическими растворителями. Пар бензола сильно ядовит.
Несмотря на формальную непредельность, бензол отличается высокой устойчивостью к нагреванию и окислению (в гомологах бензола окисляется только боковая цепь). Характерными для бензола являются реакции замещения:
а) нитрование в присутствии концентрированной серной кислоты на холоду:
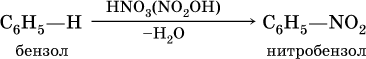
б) галогенирование в присутствии галогенидов железа (III):
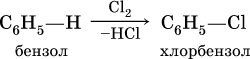
в) алкилирование в присутствии хлорида алюминия:
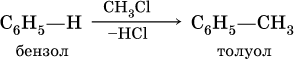
Особый характер ненасыщенности бензола и его гомологов иллюстрируется этими химическими свойствами и называется «ароматическим» характером.
В производных бензола атом или группа, заместившие водород кольца, и само бензольное кольцо влияют друг на друга. По характеру влияния различают:
1) заместители I рода – CI, Br, I, СН3, СnН2n+1, ОН и NH2. Они облегчают реакции дальнейшего замещения и направляют второй заместитель по отношению к себе в орто‑ (о‑, или 2‑) положение и в пара‑ (п‑, или 4‑) положение [для запоминания: орто – около, пара – против], например:
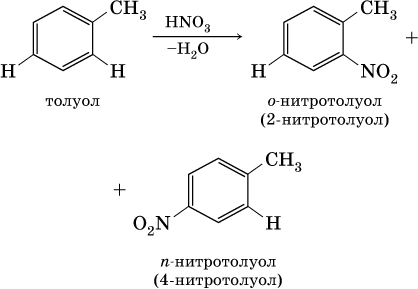
2) заместители II рода – NO2, С(Н)O, СООН и CN. Они затрудняют реакции дальнейшего замещения и направляют второй заместитель в мета‑ (м‑, или 3‑) положение, например:
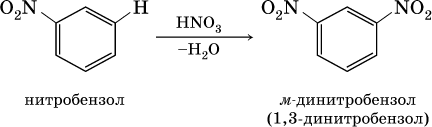
Очевидно, что существуют два орто‑положения рядом с первым заместителем X, два мета‑положения, отделенные от первого заместителя одним углеродом кольца, и лишь одно пара‑положение через два атома углерода бензольного кольца:
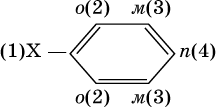
Ранее уже отмечалось, что бензол стоек к окислению даже при действии сильных окислителей. Гомологи бензола с одним боковым радикалом вступают в реакции окисления только за счет радикала; при этом, какова бы ни была его длина, отщепляется вся цепь, кроме ближайшего к кольцу атома углерода (он создает карбоксильную группу):
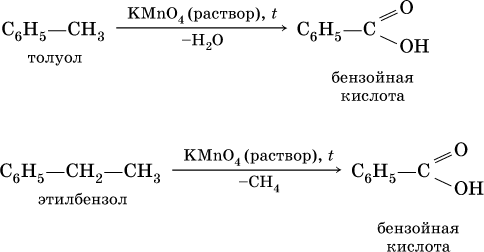
В жестких условиях бензол вступает в реакции присоединения:
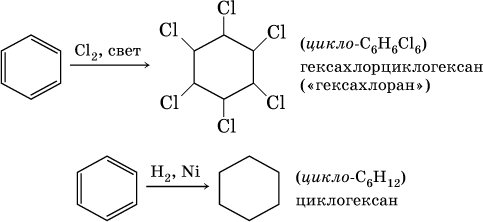
Стирол C6H5–CH=CH2, как этилен, легко полимеризуется:
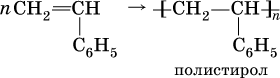
Полистирол – термопластичная пластмасса (термопласт), прозрачный материал, размягчающийся при температуре выше 80 °C. Используется для изготовления изоляции электропроводов, посуды разового употребления, упаковочной массы (пенопласт).
Получение аренов – ароматизация алифатических и алициклических углеводородов, содержащихся в нефтяных или буроугольных бензиновых фракциях:
1) дегидрирование:
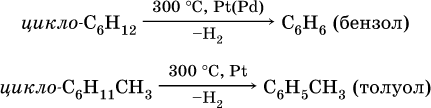
2) дегидроциклизация:
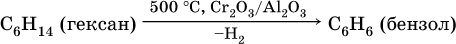
3) тримеризация ацетилена (устаревший способ):
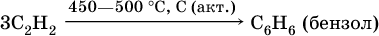
Бензол и его гомологи используются в качестве малополярных растворителей (для каучука, лаковых смол, полимеров), сырье в органическом синтезе.
Примеры заданий частей А, В
1–6. Углеводороды с групповым названием
1. алканы
2. алкадиены
3. циклоалканы
4. алкины
5. алкены
6. арены
имеют общую формулу
1) СnН2n‑6
2) СnН2n‑6
3) СnН2n+2
4) СnН2n‑2
7. Длина связи углерод – углерод наибольшая в молекуле
1) С2Н2
2) С2Н4
3) С6Н6
4) С2Н6
8. При гидрировании ацетилена могут образовываться
1) пропилен
2) этилен
3) бензол
4) этан
9. При взаимодействии 2‑бромпропана с натрием образуется
1) 2,2‑диметилбутан
2) изобутан
3) гексан
4) 2‑метилпентан
10. В реакции З‑метилпентана‑1 с хлороводородом получают
1) З‑метил‑З‑хлорпентан
2) 3‑метил‑1,2‑дихлорпентан
3) З‑метил‑2‑хлорпентан
4) З‑метил‑1‑хлорпентан
11. При действии спиртовым раствором щелочи на 2‑хлорпропан образуется
1) бутан
2) пропан
3) бутен
4) пропен
12. Соединение 1,2‑дихлорпропан – это продукт хлорирования
1) пропана
2) пропена
3) пропина
4) пропадиена
13. При полимеризации ароматического углеводорода стирол образуется продукт с формулой
1) [ – С6Н4–СН(СН3) – ]n
2) [ – CH2–С6Н3(СН3) – ]n
3) [ – CH2–СН(С6Н5) – ]n
4) [ – СН2–С6Н4–СН2–]n
14. При нитрировании пропилбензола проходит замещение атомов H в положениях
1) 2,3 радикала фенил
2) 2,4,6 радикала фенил
3) 2,3 радикала пропил
4) 1,2,3 радикала пропил
15. Способы получения бензола – это
1) дегидрирование циклогексана
2) дегидрирование и циклизация гексана
3) тримеризация ацетилена
4) действие Na на 1,6‑цикло‑С6Н10Cl2
16–19. Указанные органические соединения – это
16. цис‑ и транс‑1,2‑дихлорэтен
17. пентен‑2 и циклопентан
18. 1,2‑диметилэтен и бутен‑3
19. 1,2‑дибромпропан и 2,3‑дибромбутан
1) гомологи
2) структурные изомеры
3) пространственные изомеры
4) одно и то же вещество
20. В ряду превращений
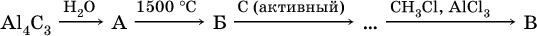
продукты А, Б, В – это соответственно
1) толуол
2) хлорбензол
3) ацетилен
4) метан
21. Углеводород, который обесцвечивает бромную воду, легко полимеризуется, присоединяет водород и при взаимодействии с бромоводородом образует бромэтан, – это
1) этилен
2) ацетилен
3) этан
4) пропилен
22. С помощью бромной воды можно различить
1) пропан и этан
2) пропин и этин
3) ацетилен и дивинил
4) пропин и пропан
23. Бензол и стирол можно распознать
1) раствором NaOH
2) нитрующей смесью
3) раствором AgNO3
4) раствором КMnO4
24. Установите соответствие между формулой углеводорода и его названием.
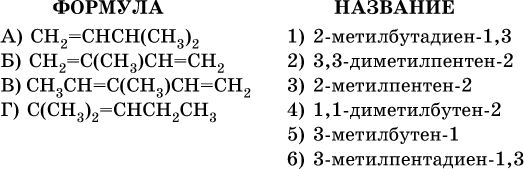
25. Процесс, не относящийся к переработке нефти, – это
1) перегонка
2) крекинг
3) риформинг
4) коксование
26. При крекинге нефти из октана образуются
1) бутан
2) этан
3) этилен
4) бутилен
27. Продукт полимеризации этилена (полиэтилен) отвечает формуле
1) (СН2)n(–СН=СН–)n
3) (–СН2–СН2–)n
4) (СН2=СН2)n
28. Для промышленного синтеза бутадиенового каучука используют мономер
1) CH2=CHCH=CH2
2) CH2=CH–C≡CH
3) CH3CH=C=CH2
4) CH2=C(CH3)C≡CH
29. Мономер пластмассы тефлон (политетрафторэтилен) синтезируют по реакции
1) замещения СCl2 + F2 →…
2) пиролиза CHClF2
3) окисления CCl2F2
4) фторирования С2Н6
10. Кислородсодержащие органические соединения
10.1. Спирты. Простые эфиры. Фенолы
Спирты – производные углеводородов, содержащие функциональную группу ОН (гидроксил). Спирты, в которых имеется одна группа ОН, называются одноатомными, а спирты с несколькими группами ОН – многоатомными.
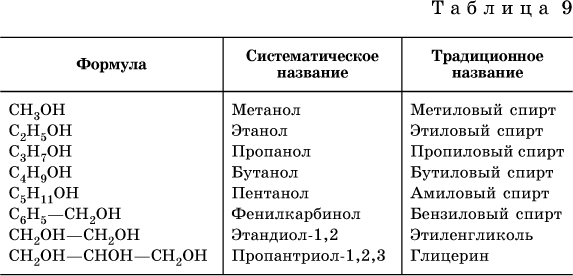
Названия некоторых распространенных спиртов приведены в табл. 9.
По строению различают спирты первичные, вторичные и третичные, в зависимости от того, при каком атоме углерода (первичном, вторичном или третичном) находится группа ОН:
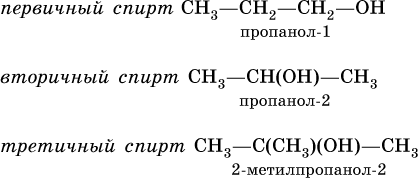
Одноатомные спирты – бесцветные жидкости (до Cl2Н25ОН), растворимые в воде. Простейший спирт – метанол СН3ОН чрезвычайно ядовит. С увеличением молярной массы температура кипения спиртов повышается.
Молекулы жидких одноатомных спиртов ROH ассоциированы за счет водородных связей:
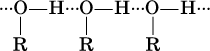
(эти связи аналогичны водородным связям в чистой воде).
При растворении в воде молекулы ROH образуют водородные связи с молекулами воды:
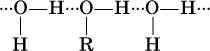
Водные растворы спиртов ROH имеют нейтральную среду; другими словами, спирты практически не диссоциируют в водном растворе ни по кислотному, ни по основному типу.
Химические свойства одноатомных спиртов обусловлены присутствием в них функциональной группы ОН.
Водород группы ОН в спиртах может замещаться на металл:
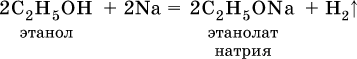
Этанолаты и производные других спиртов (алкоголяты) легко гидролизуются:
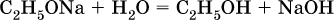
Группу ОН в спиртах можно заместить на Cl или Br:
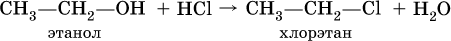
При действии на спирты водоотнимающих средств, например концентрированной H2SO4, происходит межмолекулярная дегидратация:
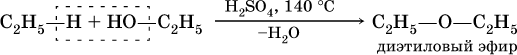
Продукт реакции – диэтиловый эфир (С2Н5)2O – относится к классу простых эфиров.
В более жестких условиях дегидратация становится внутримолекулярной и образуется соответствующий алкен:
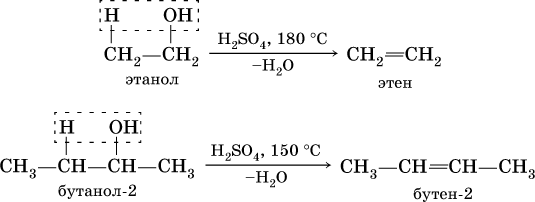
Многоатомные спирты рассмотрим на примере простейших представителей двух– и трехатомных спиртов:
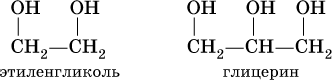
При комнатной температуре они – бесцветные вязкие жидкости с температурами кипения 198 и 290 °C соответственно, неограниченно смешиваются с водой. Этиленгликоль ядовит.
Химические свойства многоатомных спиртов подобны свойствам спиртов ROH. Так, в этиленгликоле одну или две группы ОН можно заместить на галоген:
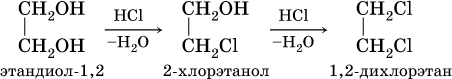
Кислотные свойства многоатомных спиртов проявляются в том, что (в отличие от одноатомных спиртов) водород группы ОН замещается на металл под действием не только металлов, но и гидроксидов металлов:
а)
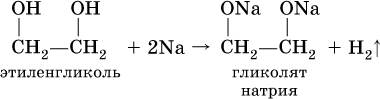
б)
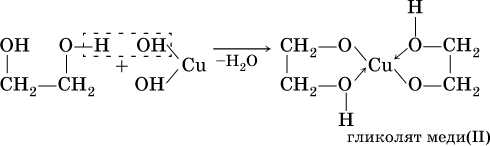
(стрелками в формуле гликолята меди показано образование ковалентных связей медь – кислород по донорно‑акцепторному механизму).
Аналогично реагирует с гидроксидом меди (II) глицерин:
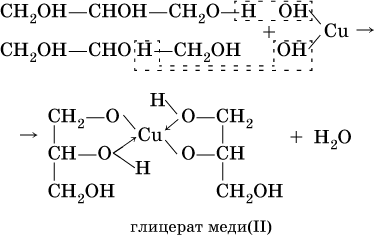
Гликолят и глицерат меди (II), имеющие ярко‑синюю окраску, позволяют качественно обнаруживать многоатомные спирты.
Получение одноатомных спиртов в промышленности – гидратация алкенов в присутствии катализаторов (H2SO4, Al2O3), причем присоединение воды к несимметричным алкенам происходит по правилу Марковникова:
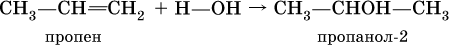
(способ получения вторичного спирта), или присоединение к алкенам СО и Н2 в присутствии кобальтового катализатора (процесс называется гидрофоржилирование):
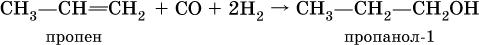
(способ получения первичного спирта).
В лаборатории (а иногда и в промышленности) спирты получают взаимодействием галогенпроизводных углеводородов с водой или водным раствором щелочи при нагревании:
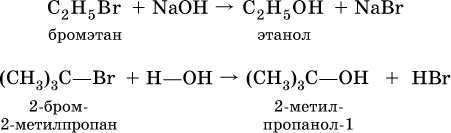
Этанол С2Н5ОН образуется также при спиртовом брожении сахаристых веществ, например глюкозы:
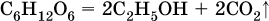
Этиленгликоль получают в двухстадийном процессе:
а) окисление этилена:
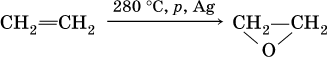
б) гидратация этиленоксида:
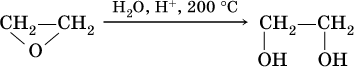
Глицерин ранее получали омылением жиров (см. 20.3), современный трехстадийный способ – постепенное окисление пропена (приведена только схема процесса):
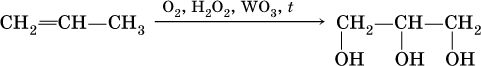
Спирты используют как сырье в органическом синтезе, в качестве растворителей (для лаков, красок и т. п.), а также в бумажной, полиграфической, парфюмерной, фармакологической и пищевой промышленности.
Простые эфиры – класс органических соединений, содержащих мостиковый атом кислорода – О– между двумя углеводородными радикалами: R – О–R'. Самый известный и широко применяемый простой эфир – диэтиловый эфир С2Н5–О – С2Н5. Бесцветная, легкоподвижная жидкость с характерным («эфирным») запахом, в лабораторной практике его называют просто эфиром. Почти не смешивается с водой, tкип = 34,51 °C. Пар эфира воспламеняется на воздухе. Получают диэтиловый эфир при межмолекулярной дегидратации этанола (см. выше), основное применение – растворитель.
Фенолы – это спирты, в которых группа ОН непосредственно связана с бензольным кольцом. Простейший представитель – фенол С6Н5–ОН. Белые (розовеющие на свету) кристаллы с сильным запахом, tпл = 41 °C. Вызывает ожоги кожи, ядовит.
Для фенола характерна значительно большая кислотность, чем для ациклических спиртов. Вследствие этого фенол в водном растворе легко реагирует с гидроксидом натрия: