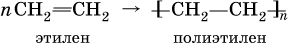7. карбоновые кислоты отвечает функциональной группе
1) – С(О)–
2) – СООН
3) – С(Н)O
4) – ОН
8–10. Молекулы класса соединений с названием
8. простые эфиры
9. сложные эфиры
10. белки
содержат функциональную группу
1) С – О–С
2) С – С(О) – О – С
3) C – OH
4) С(О) – N(H) – С
11. Функциональные группы углеводов – в наборах
1) СООН, ОН
2) ОН, СО
3) С(Н)O, OH
4) СО, С(Н)O
12–15. Органическое соединение с формулой
12. C2H5NH2
13. c2h5no2
14. NH2CH2C00H
15. (C2H5)3N относится к классу
1) аминокислот
2) аминов
3) нитросоединений
4) белков
16–19. Органическое соединение с формулой
16. СН3–О – С2Н5
17. С2Н5–С(Н)O
18. СН3–С(О) – О – С2Н5
19. С6Н5–СН2ОН относится к классу
1) сложных эфиров
2) простых эфиров
3) альдегидов
4) спиртов
20. Этан вступает в реакции
1) изомеризации
2) замещения
3) присоединения
4) дегидрирования
21. Для олефинов характерны реакции
1) замещения
2) полимеризации
3) присоединения
4) разложения
22. Бензол склонен вступать в реакции
1) нейтрализации
2) присоединения
3) полимеризации
4) изомеризации
23–25. Взаимодействие между реагентами
23. С6Н6, HNO3
24. C2H4, НCl
25. C2H2, КMnO4
по отношению к углеводороду называется
1) окислением
2) присоединением
3) восстановлением
4) замещением
26. Установите соответствие между формулой функциональной группы и классом органических соединений, который она определяет.

27. Установите соответствие между названием соединения и классом, к которому оно относится

9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
9.1. Алканы. Циклоалканы
Алканы (парафины) – это соединения углерода с водородом, в молекулах которых атомы углерода соединены между собой одинарной связью (предельные углеводороды). Общая формула гомологического ряда алканов СnН2n+2. Радикал, получающийся при отрыве одного атома водорода от молекулы предельного углеводорода, называется алкилож, общая формула алкилов СnН2n+1.
Формулы и названия первых шести алканов (С1–С6) и отвечающих им радикалов:
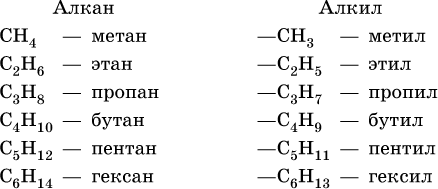
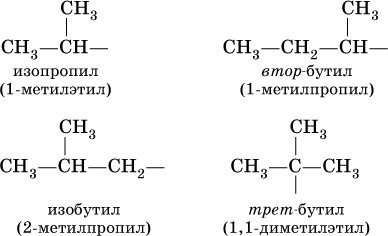
Для радикала С5Н11 использование названия амил не рекомендуется. Для составления названий алканов с разветвленной цепью, например
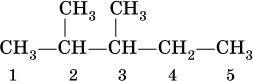
выбирают самую длинную углеродную цепь (в примере – 5 атомов) и получают основу названия (5 – пентан). Нумеруют цепь (от 1 до 5) так, чтобы заместители (–СН3) получили наименьшие номера (2 и 3). В названии арабскими цифрами указывают положение заместителей, а приставками ди – 2, три – 3, тетра – 4 и т. д. – число одинаковых заместителей. Таким образом, в нашем примере алкан должен быть назван 2,3‑диметилпентан.
При наличии разных заместителей их названия расставляют по алфавиту, т. е., например, сначала метил, а затем этил.
Для некоторых разветвленных предельных углеводородов используются, наравне с систематическими, традиционные названия, например, для алканов состава С4Н10 и С5Н12 с формулами:
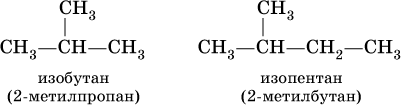
Такие же названия используются для разветвленных радикалов:
При обычных условиях первые алканы – метан, этан, пропан и бутан (С1–С4) – представляют собой газы без цвета и запаха, малорастворимые в воде. Последующие гомологи (С5–C15) – жидкости (при 20 °C), высшие гомологи (C16 и выше) – твердые вещества.
В алканах атомные орбитали углерода имеют sр3‑гибридизацию; четыре электронных облака атома углерода направлены в вершины тетраэдра под углами 109,5°. Ковалентные связи, образуемые каждым атомом углерода, в алканах малополярны.
Поэтому алканы – сравнительно инертные вещества, вступают только в реакции замещения, протекающие с симметричным (радикальным) разрывом связей С – Н. Эти реакции обычно идут в жестких условиях (высокая температура, освещение). В результате становится возможным замещение водорода на галоген (CI, Br) и нитрогруппу (NO2), например, при обработке метана хлором:
Вторая и последующие стадии реакции протекают легче, чем первая, из‑за смещения электронной плотности к атому хлора:
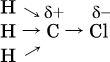
и увеличения подвижности остающихся атомов водорода. Названия продуктов: СН3Cl – хлорметан, СН2Cl2 – дихлорметан, СНCl3 – трихлорметан (хлороформ), СCl4 – тетрахлорметан (тетрахлорид углерода).
В тех алканах, где кроме первичных есть также вторичные и третичные атомы углерода, замещение обычно протекает с образованием смеси однозамещенных продуктов (т. е. в каждой молекуле замещается один атом водорода), например:
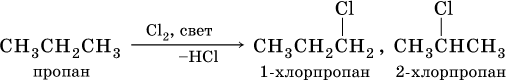
Циклоалканы – предельные углеводороды циклического строения, общая формула гомологического ряда СnH2n (п 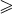
3), формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
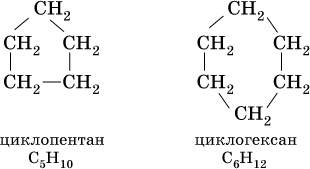
При комнатной температуре С5Н10 и С6Н12 – бесцветные жидкости, малорастворимые в воде. Химические свойства циклоалканов подобны свойствам алканов, например:
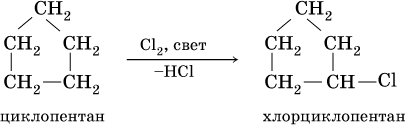
Получение: источниками алканов и циклоалканов в промышленности служат нефть, природный газ, каменный уголь. В лаборатории применяют такие способы синтеза алканов:
1) реакция Вюрца – действие натрия на галогенпроизводные углеводородов:
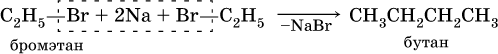
2) каталитическое гидрирование этиленовых углеводородов (катализаторы Pt, Pd, Ni):
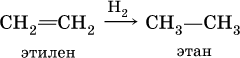
3) сплавление солей карбоновых кислот с гидроксидом натрия:
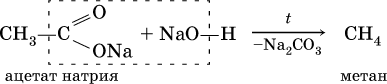
Циклоалканы синтезируют из дигалогенпроизводных алканов:
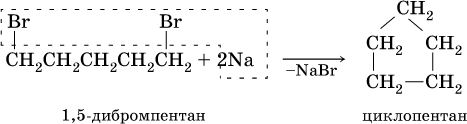
Алканы широко используются как исходное сырье в химической промышленности, моторное топливо (бензин, керосин и др.); циклоалканы применяются в органическом синтезе.
При горении метана выделяется много теплоты:
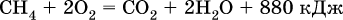
Поэтому его (в виде природного газа) применяют в качестве топлива в быту и в промышленности.
9.2. Алкены. Алкадиены
Алкены (олефины) – это углеводороды, в молекулах которых содержатся атомы углерода, соединенные между собой двойной связью (непредельные углеводороды ряда этилена). Простейший представитель – этилен С2Н4, общая формула гомологического ряда этиленовых углеводородов СnН2n (при п ≥ 2).
Систематические названия олефинов производятся от корней названий алканов с заменой суффикса – ан → – ен:

Сохраняются также традиционные названия с заменой суффикса – ан на – илен: С2Н4 – этилен, С3Н6 – пропилен, С4Н8 – бутилен; использование названия амилен для алкена С5Н10 не рекомендуется.
Положение двойной связи С=С в изомерах строения (начиная с алкена С4) указывается цифрой после названия:
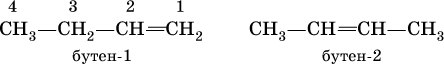
Радикал этилена – этенил СН2=СН – обычно называют винил, пропена – пропенил СН2=СН – СН2 – именуют аллил.
Другой вид изомерии в непредельных углеводородах, помимо структурной изомерии, осуществляется потому, что атомы углерода, образующие двойную связь, находятся в sр2‑гибридном состоянии; σ‑составляющая двойной связи С=С и σ‑связи С – Н лежат в одной плоскости под углом 120° друг к другу, а π‑составляющая двойной связи С=С представляет собой электронное облако, вытянутое в направлении, перпендикулярном плоскости о‑связей. Следствием такого строения алкенов является возможность геометрической изомерии (или цис‑транс‑изомерии) в зависимости от положения заместителей (атомов или радикалов):
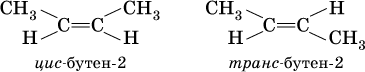
(цис – от лат. «рядом, по одну сторону», транс – от лат. «напротив, по разные стороны»).
Алкены С2–С4 при комнатной температуре – бесцветные газы со слабым запахом нефти, малорастворимые в воде; алкены С5–C18 – жидкости, алкены C19 и выше – твердые вещества.
Важнейшие химические свойства алкенов определяются тем, что в силу меньшей прочности π‑связи (по сравнению с σ‑связью) она легко разрывается, в результате чего протекают реакции присоединения и образуются насыщенные органические соединения. Как правило, такие реакции идут в мягких условиях, часто на холоду и в растворителях, например воде, тетрахлорметане СCl4 и др.:
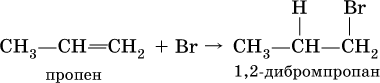
Аналогично протекает взаимодействие алкенов с бромоводородом:

Присоединение галогеноводородов к несимметричным алкенам теоретически может привести к двум продуктам:
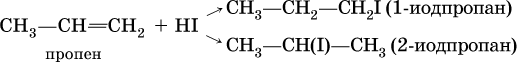
Согласно правилу Марковникова, присоединение галогеноводородов к несимметричным алкенам протекает так, что водород направляется к атому углерода, который уже содержит большее число атомов водорода. В приведенной выше реакции продуктом будет 2‑иодпропан СН3СН(I)СН3.
По правилу Марковникова протекает и реакция гидратации, т. е. реакция присоединения воды в присутствии серной кислоты. Она происходит в две стадии:
а) вначале образуется алкилсерная кислота, т. е. H2SO4 присоединяется к алкену:
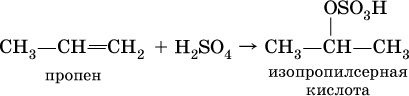
б) затем происходит ее необратимый гидролиз:
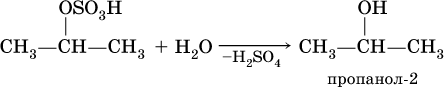
Алкены обесцвечивают раствор перманганата калия на холоду в нейтральной среде, при этом образуются гликоли (двухатомные спирты):
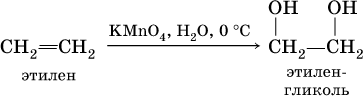
Алкены способны вступать в реакции полимеризации: