Качественная реакция – помутнение раствора хлорида палладия(II).
Применяется как реагент в органическом синтезе, промышленно важный восстановитель металлов из их руд.
Чрезвычайно ядовит, загрязняет атмосферу городов (продукт неполного сгорания моторного топлива). По тому же механизму, что и кислород, СО присоединяется к атому железа в гемоглобине крови, причем связывается более прочно и тем самым блокирует перенос кислорода в организме, вызывая сильное отравление и остановку дыхания; отсюда тривиальное название СО – угарный газ.
Уравнения важнейших реакций:
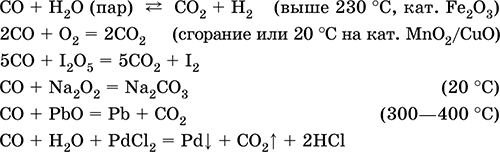
Получение в промышленности: сжигание кокса (см.) при недостатке кислорода, восстановление раскаленным коксом углекислого газа и водяного пара:

Диоксид углерода СO2. Кислотный оксид. Техническое название – углекислый газ. Бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха (можно «переливать» из сосуда в сосуд). Молекула неполярна, имеет линейное строение [С(O)2] (sр‑гибридизация), содержит ковалентные σπ‑связи С=O. Термически устойчив до температуры красного каления. При сжатии (давление = 50 атм) и охлаждении легко переходит в жидкое и твердое («сухой лед») состояния.
Твердый СO2 возгоняется уже при низких температурах. Мало растворим в воде (O,88 л/1 л Н2O при 20 °C); образует моногидрат, который медленно изомеризуется (на 0,4 %) в угольную кислоту. Реагирует со щелочами. Восстанавливается магнием и кальцием. Из воздуха удаляется при контакте с пероксидом натрия (одновременно регенерируется кислород).
Простейшая качественная реакция – угасание горящей древесной лучинки в атмосфере СO2.
Применяется в многотоннажных производствах соды, сахара и карбамида, в пищевой промышленности для газирования безалкогольных напитков и как хладагент.
Содержится в воздухе (0,03 % по объему), воде минеральных источников. Не поддерживает горение и дыхание. Ассимилируется зелеными растениями при фотосинтезе (с помощью хлорофилла и под воздействием солнечных лучей). Ядовит при содержании в воздухе свыше 15 % по объему.
Уравнения важнейших реакций:

Получение в промышленности – при полном сгорании кокса (см.) или при обжиге известняка:
СаСO3 = СаО + СO2 (900–1200 °C)
в лаборатории – при обработке карбонатов (например, кусочков мрамора СаСO3) сильными кислотами:
СаСO3(т) + H2SO4 = CaSO4↓ + Н2O + CO2↑
7.5.3. Карбонаты
Карбонат натрия Na2CO3. Оксосоль. Техническое название кальцинированная сода. Белый, при нагревании плавится и разлагается. Чувствителен к влаге и углекислому газу в воздухе. Образует декагидрат (кристаллическая сода). Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Восстанавливается коксом. Вступает в реакции ионного обмена.








