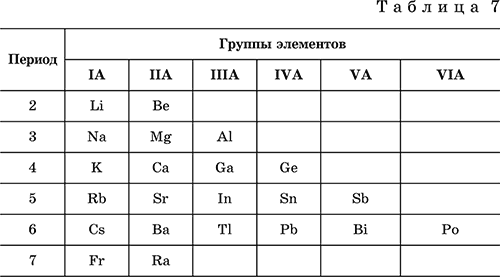
Метагидроксид железа FeO(OH). Амфотерный гидроксид с преобладанием основных свойств. Светло‑коричневый, связи Fe – О и Fe – ОН преимущественно ковалентные.
При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fe2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FeO(OH). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fe(OH)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fe(OH)3 не известно (не получено).
Уравнения важнейших реакций:
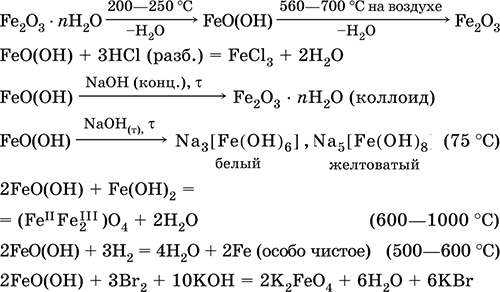
Получение: осаждение из раствора солей железа(III) гидрата Fe2O3 nН2O и его частичное обезвоживание (см. выше).
В природе – оксидная руда железа лимонит Fe2O3 nН2O и минерал гётит FeO(OH).
Феррат калия K2FeO4. Оксосоль. Красно‑фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель. Качественная реакция – образование красного осадка феррата бария. Применяется в синтезе ферритов – промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
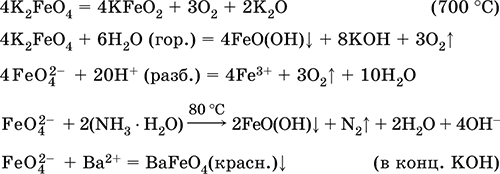
Получение: образуется при окислении соединений железа, например метагидроксида FeO(OH), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fe + 2KOH + 2KNO3 = K2FeO4 + 3KNO2 + H2O (420 °C)
и электролизе в растворе:
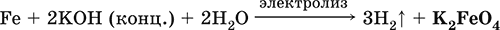
(феррат калия образуется на аноде).
Качественные реакции на ионы Fe2+ и Fe3+. Обнаружение ионов Fe2+ и Fe3+ в водном растворе проводят с помощью реактивов K3[Fe(CN)6] и K4[Fe(CN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, KFeIII[FeII(CN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Fe2+ + К+ + [Fe(CN)6]3‑ = KFeIII[FeII(CN)6]↓
Fe3+ + K+ + [Fe(CN)6]4‑ = KFeIII[FeII(CN)6]↓
Химические названия исходных реактивов и продукта реакций:
K3[Fe(CN)6] – гексацианоферрат (III) калия
K4[Fe(CN)6] – гексацианоферрат (II) калия
KFeIII[FeII(CN)6] – гексацианоферрат (II) железа(III) калия
Кроме того, хорошим реактивом на ионы Fe3+ является тиоцианат‑ион NCS‑, железо (III) соединяется с ним, и появляется ярко‑красная («кровавая») окраска:
Fe3+ + 6NCS– = [Fe(NCS)6]3‑
Этим реактивом (например, в виде соли KNCS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
6.4. Общие свойства металлов. Коррозия
Элементы с металлическими свойствами расположены в IA – VIA группах Периодической системы (табл. 7).