Химические частицы, образованные из двух или нескольких атомов, называются молекулами (реальными или условными формульными единицами многоатомных веществ). Атомы в молекулах химически связаны.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Каждая химическая связь в структурных формулах представляется валентной чертой, например:
H – H (связь между двумя атомами водорода);
H3N – Н+ (связь между атомом азота молекулы аммиака и катионом водорода);
(К+) – (I‑) (связь между катионом калия и иодид‑ионом).
Химическая связь образуется парой электронов (•), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных, неподеленных электронных пар атомов, например:
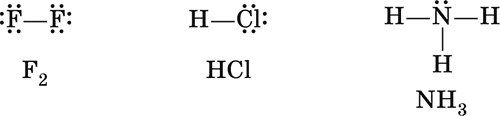
Химическая связь называется ковалентной, если она образована путем обобществления пары электронов обоими атомами.
В молекуле F2 оба атома фтора имеют одинаковую электроотрицательность, следовательно, обладание электронной парой для них одинаково. Такую химическую связь называют неполярной, так как у каждого атома фтора электронная плотность одинакова и в электронной формуле молекулы может быть условно разделена между ними поровну:
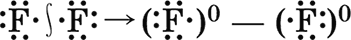
В молекуле хлороводорода НСl химическая связь уже полярная, так как электронная плотность на атоме хлора (элемента с большей электроотрицательностью) значительно выше, чем на атоме водорода:
Ковалентная связь, например Н – Н, может быть образована путем обобществления электронов двух нейтральных атомов:
H · + · H → H – H
или
H ∙ ∙ H
Такой механизм образования связи называется обменным или равноценным.
По другому механизму та же ковалентная связь H – H возникает при обобществлении электронной пары гидрид‑иона H катионом водорода Н+:
H+ + (:H)‑ → H – H
или
H ∙ ∙ H
Катион Н+ в этом случае называют акцептором, а анион Н – донором электронной пары. Механизм образования ковалентной связи при этом будет донорно‑акцепторным, или координационным.
Одинарные связи (Н – Н, F – F, Н – CI, Н – N) называются а‑связями, они определяют геометрическую форму молекул.
Двойные и тройные связи ( 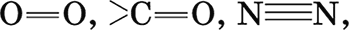

) содержат одну σ‑составляющую и одну или две π‑составляющие; σ‑составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее π‑составляющих.
Физическими (реально измеряемыми) характеристиками химической связи являются ее энергия, длина и полярность.
Энергия химической связи (Есв) – это теплота, которая выделяется при образовании данной связи и затрачивается на ее разрыв. Для одних и тех же атомов одинарная связь всегда слабее, чем кратная (двойная, тройная).
Длина химической связи (lсв) – межъядерное расстояние. Для одних и тех же атомов одинарная связь всегда длиннее, чем кратная.
Полярность связи измеряется электрическим дипольным моментом р – произведением реального электрического заряда (на атомах данной связи) на длину диполя (т. е. длину связи). Чем больше дипольный момент, тем выше полярность связи. Реальные электрические заряды на атомах в ковалентной связи всегда меньше по значению, чем степени окисления элементов, но совпадают по знаку; например, для связи H+I–Cl‑I реальные заряды равны Н+0'17–Сl‑0'17 (двухполюсная частица, или диполь).








