Общая характеристика и хим. свойства ЩМ
Физические свойства
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими tпл. и tкип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водойлитий:
 Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава 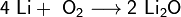
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2: 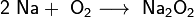
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:  . Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами.
. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. 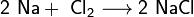
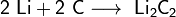 Щелочные металлы растворяются в жидком аммиаке
Щелочные металлы растворяются в жидком аммиаке 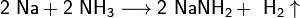
Особенности соединений лития по сравнению с соед.других ЩМ
Малый размер атома лития и, как следствие, высокая поверхностная плотность заряда и низкое координационное число делают химию лития отличной от других щелочных металлов.
Литий образует устойчивый гидрид LiH 2. Литий — единственный из щелочных металлов, дающий устойчивый нитрид Li3N.
3. Литий реагирует с углем, образуя карбиды Li2C2, Li4C3.
4. Гидроксид лития при температуре выше 600 °С начинает разлагаться на оксид и воду, в то время как гидроксиды остальных щелочных металлов не разлагаются при нагревании.
5. При сгорании на воздухе литий образует оксид Li2O.
6. Литий не образует квасцов.
7. Карбонат лития при нагревании (>800 °С) разлагается.
8. Гидроксид, карбонат, ортофосфат и фторид лития малорастворимы в воде.
9. Хлорид, бромид, иодид и перхлорат лития растворимы в этаноле.
10. Литий образует более устойчивые комплексы, чем остальные щелочные металлы.








