Тема: электронная природа химической связи. Понятие об электроотрицательности.
Цель : ознакомить учащихся с электронной природе химической связи, причинами его возникновения; дать понятие об электроотрицательности химических элементов и выяснить ее изменения в периодах и группах; закрепить знания об электронной структуре атомов.
Оборудование: ПСХЭ, таблицы "строение атомов химических элементов периодов", " электроотрицательность атомов химических элементов”.
Ход урока.
Мотивация учебной деятельности
В ходе беседы мы выяснили, что все химические элементы , кроме инертных, имеют незавершенные электронные слои. В процессе образования химических связей атомы химических элементов пытаются завершить их и образовать устойчивую восьмиелек-
тронное строение внешнего электронного слоя. Итак, сегодня на уроке мы должны выяснить принципы завершения внешнего электронного слоя.
Также мы познакомимся с таким понятием как электроотрицательности и ее изменением в периодах и группах.
Изучение нового материала
1) электронная природа химической связи.
На основе таблиц объясняем, как атомы химических элементов завершают свои внешние электронные слои. Обращаем внимание на то, что у неметаллических элементов на внешнем слое 4 и более электронов. Неметаллическим элементам энергетически не выгодно отдавать свои внешние электроны, а потому они присоединяют электроны к 8 и образуют устойчивый октет. В металлических элементов на внешнем электронном слое наоборот небольшое количество электронов от 1 до 3, и поэтому металлические элементы отдают свои внешние электроны . На предпоследнем электронном слое у них также есть устойчивый октет электронов. То есть делаем вывод , что в образовании химических связей непосредственное участие будут принимать электроны внешнего слоя.
2) понятие об электроотрицательности.
Электроотрицательность
В основе образования химических связей лежит явление электроотрицателъности. В ходе химических взаимодействий одни атомы отдают электроны, другие их присоединяют.
Электроотрицательность — это условная величина, характеризующая относительную способность атома приобретать отрицательный заряд.
Фактически электроотрицательность выражает способность атома оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Электроотрицательность атома определяет характер его свойств: сильнее всего металлические свойства проявляются у элементов, атомы которых легко отдают электроны, а неметаллические — соответственно у элементов, атомы которых легко их присоединяют.
Абсолютные значения электроотрицательности элементов выражаются числами, затрудняющими их практическое применение для вычислений, поэтому в химии используют значения относительной электроотрицателъности. Условно за единицу принимают значение электроотрицательности лития (Li).
Чем меньше значение относительной элетроотрицательности, тем ярче выражены металлические свойства элемента. У всех металлов в периодической системе значение относительной электроотрицательности, как правило, меньше 2. У неметаллов это значение, как правило, превышает 2.
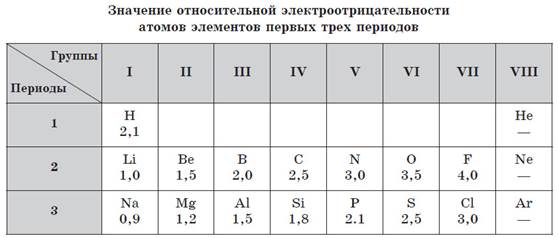
Электроотрицательность элементов также изменяется периодически: в периодах возрастает слева направо, а в главных подгруппах — снизу вверх.
При образовании химических связей электроны переходят или смещаются к атомам элементов, которые обладают большей электроотрицательностью.
Домашнее задание:
1. Порядковый номер химического элемента численно равен …..
(заряду ядра его атома).
1. Вид атомов с одинаковым зарядом ядра ….. (химический элемент).
2. Мельчайшая, химически неделимая частица ….. (атом).
3. В центре атома находится заряженное ….. (ядро).
4. Ядра атомов состоят из ……… и ……. (протонов и нейтронов).
5. Вокруг ядра по замкнутым орбитам вращаются отрицательно заряженные ….. (электроны).
Ответьте письменно на вопросы: (Слайд №12).
1. Что такое электроотрицательность?
2. Как изменяются металлические и неметаллические свойства в периоде, в группе?
3. Какие элементы обладают сильными металлическими свойствами?
4. Какие элементы обладают сильными неметаллическими свойствами?








