Мониторинг терапии непрямыми антикоагу лянтами
Для мониторинга терапии непрямыми антикоагулянтами используют определение протром-бинового времени (ПВ), результат которого выражается в виде MHO - международного нормализованного отношения (см. раздел «Про-тромбиновое время»). ПВ следует определять ежедневно (в крайнем случае, через день) до тех пор, пока не будет подобрана индивидуальная поддерживающая доза и не станут стабильными показатели теста. Затем ПВ оценивают 1 раз в неделю в течение первого месяца лечения, в дальнейшем 1-2 раза в месяц и реже.
В табл. 63 приводятся значения MHO при клинических ситуациях, требующих приема пациентами антикоагулянтов непрямого действия.
Во время подбора дозы антикоагулянта непрямого действия следует периодически определять АЧТВ: оптимальными считаются значения в 1,5-2 раза превышающие верхнюю границу референтной величины. Меньшие результаты свидетельствуют о недостаточном уровне гипокоагуляции, что может наблюдаться при гиперак-
Патология гемостаза
Таблица 63
|
|
тивации факторов внутреннего пути, чаще фактора VIII. В этом случае следует несколько увеличить дозу препарата или временно усилить лечение назначением гепарина. Увеличение АЧТВ более чем в 2 раза резко усиливает риск кровотечения, что требует снижения дозы препарата или прекращения терапии непрямыми антикоагулянтами.
При необходимости быстрого достижения антикоагулянтного эффекта одновременно назначают гепарин и несколько большую дозу непрямого антикоагулянта. В этом случае необходим мониторинг гепаринотерапии по АЧТВ и ежедневный мониторинг терапии антикоагулянтом непрямого действия по MHO. По достижении необходимого терапевтического уровня значений ПВ переходят на поддерживающую дозу препарата, а гепарин отменяют только тогда, когда поддерживающая доза непрямого антикоагулянта не менее 2 дней подряд обеспечивает необходимый уровень гипокоагуляции.
Осложнения терапии непрямыми антикоагу лянтами
Наиболее тяжелым осложнением является усиление тромбоза или возникновение тромбоза подкожных сосудов с развитием некроза тка-
ней - «кумудинового некроза». Возникают эти осложнения у лиц с низкой активностью протеинов S и С. Поскольку эти белки являются вита-мин-К-зависимыми, их активность быстро снижается после начала приема непрямых антикоагулянтов, тогда как их субстрат - факторы V и VIII - не меняет своей активности. Нарушение соотношения фактор-ингибитор может приводить к усилению тромбозов и развитию «кумудинового некроза».
Лечение «кумудинового некроза» заключается в назначении прямых антикоагулянтов и свежезамороженной плазмы как источника протеинов С и S.
Другая группа осложнений - геморрагические проявления при передозировке антикоагулянтов. При этом возможны выраженные кожные геморрагические проявления, преимущественно по гематомному типу, носовые кровотечения, кровотечения из мест инъекций, гематомы мягких тканей, желудочно-кишечные, почечные кровотечения и даже внутричерепные кровоизлияния.
Лечение геморрагических проявлений заключается в снижении дозы или временной отмене непрямых антикоагулянтов, применении свежезамороженной плазмы, криопреципитата или не-
Патология гемостаза
активированных препаратов протромбинового комплекса.
Фибринолитическая терапия
Фибринолитические препараты широко используются при инфаркте миокарда: на протяжении многих лет применяли стрептокиназу и уро-киназу. Однако эти препараты малоэффективны при лечении эмболии легочной артерии и массивного тромбоза глубоких вен бедра. Существенным ограничением применения фибринолитичес-ких препаратов являются геморрагические осложнения, особенно церебральные геморрагии. Природа геморрагических осложнений связана не столько с лизисом фибриновой пробки, сколько с появлением большого количества продуктов деградации фибрина/фибриногена (ПДФ), которые способны повреждать сосудистую стенку, особенно эндотелий, влиять на функции тромбоцитов. Поэтому природа геморрагии при использовании фибринолитических препаратов комплексная. Существенное улучшение результатов фибринолитической терапии достигнуто при внедрении тканевого активатора плазминогена (t-PA), особенно при введении его через катетер при инфаркте миокарда.
В настоящее время в качестве препаратов применяются:
• Стрептокиназа - бактериальный белок, про
дукт жизнедеятельности (3-гемолитического
стрептококка (стрептодеказа).
• t-PA - специфический активатор плазмино
гена, нарабатываемый рекомбинантной тех
нологией (альтеплаза) или генной инженери
ей как дериват t-PA с увеличенным временем
полувыведения из системы циркуляции (ре-теплаза, ланотеплаза) или как другой дериват t-PA с устойчивостью к ингибированию PAI-1 (тенектеплаза).
• Урокиназа - рекомбинантный препарат u-РА или проурокиназы (саруплаза). Фибринолитическую терапию часто сочетают с гепаринотерапией. В результате достигается эффект системного или локального гиперфиб-ринолиза, что может оказать благоприятный эффект по лизису фибринового тромба и реканали-зации окклюзированных сосудов.
Частично деградированный фибриноген способствует снижению вязкости крови и уменыне-
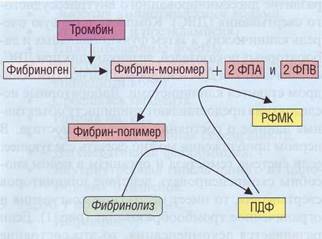
Рис . 143. Гиперфибринолиз сопровождается образованием избыточного количества продуктов деградации фибрина (ПДФ), которые способны вступать во взаимодействие с фибрин-мономерами, нарушая полимеризацию фибрина. При этом образуются растворимые комплексы мономеров фибрина (РКМФ) и проявляется гипокоагулянтный эффект ПДФ
Таблица 64
|
|










