Определение тканевого активатора плазминогена ( t- PA)
Тканевой активатор плазминогена (t-PA) освобождается в кровоток из эндотелиальных клеток сосудистой стенки, где он синтезируется. Поэтому диагностика дефицита t-PA основывается не только на определении концентрации t-PA в крови, но и на способности освобождаться из сосудистой стенки при стрессовых воздействиях, в
частности при манжеточной пробе (дозированном пережатии вен). Сначала определяют базовый уровень t-PA, потом на 10-15 минут на предплечье накладывают жгут или раздувают манжетку, вызывающую венозный стаз, затем берут вторую порцию крови, в которой повторно определяют t-PA. Сравнивают результаты обеих проб. Из-за быстрой инактивации тканевого активатора плазминогена PAI-1 и другими ингибиторами пробы крови необходимо немедленно закислить, чтобы предупредить инактивацию t-PA in vitro . В настоящее время выпускаются специальные пробирки с кислым антикоагулянтом. t-PA имеет суточный ритм, поэтому его необходимо определять так же, как PAI-1.
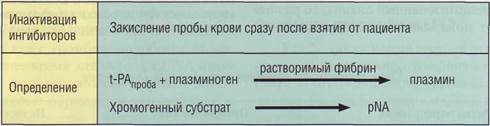
t-PA обладает высокой амидазной активностью, позволяющей эффективно использовать для его определения метод хромогенных субстратов. Однако при низких концентрациях t-PA в плазме требуется проведение дополнительных процедур непрямого определения активности фермента через плазминоген и использование растворимого фибрина (рис. 125).
Определение t-PA проводится у больных с тромбофилией как часть панели тестов на выявление причины тромбофилии, особенно при нагрузочных манжеточных пробах. Повышение t-PA после инфаркта миокарда рассматривается как неблагоприятный фактор. Нарушение освобождения t-PA после венозного стаза описано у больных с тромбозами и патологией почек.
|
|
Рис. 125. Принцип определения тканевого активатора плазминогена (t-PA) хромогенным методом
|
|
Обеспечение диагностики нарушений гемостаза в КДЛ
Тесты активации свертывания крови
Определение D- димеров
D-димеры - это специфические продукты деградации фибрина, входившего в состав тромба. Они образуются в процессе лизиса сгустка крови под влиянием плазмина и некоторых неспецифических фибринолитиков (рис. 60). Концентрация D-димеров в сыворотке пропорциональна активности фибринолиза и количеству лизируемого фибрина. Этот тест позволяет судить об интенсивности процессов образования и разрушения фибриновых сгустков.
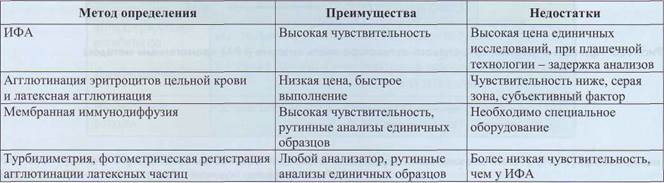
Определение D-димеров проводится иммуно-ферментным методом с использованием монокло-нальных антител, иммунодиффузии, методом тур-бидиметрии, латекс-агглютинации (табл. 32). Во всех методах исследования используются моно-клональные антитела к эпитопам на D-димере, которые образуются при расщеплении нерастворимого фибрина плазмином. Этих эпитопов нет на фибриногене и растворимых фибрин-мономерах, поэтому D-димеры - показатель того, что в процессе фибринолиза расщепляется именно фибрин, а не фибриноген или фибрин-мономеры. Поскольку эти антитела не взаимодействуют с фибриногеном, исследования могут проводиться как в плазме, так и в сыворотке.
Принцип теста, основанный на методе ELISA на твердой фазе (стриппированные планшеты), с нанесенными на поверхность пластика первичными антителами, показан на рис. 126. Так как D-димеры - не стандартизованный аналит, то разные методы могут показывать разные результаты,
несмотря на то, что используются специфические антитела и калибраторы.
На определение D-димеров практически не оказывает влияние техника взятия крови, примесь тромбоцитов, не требуется использования ингибиторов для подавления других факторов.
Повышение уровня D-димеров в крови определяется при возникновении венозных тромбозов, атеротромбозе, тромбоэмболии легочной артерии, ДВС-синдроме, после операций, особенно при большом операционном поле и других состояниях с повышенным образованием
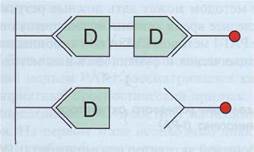
Рис . 126. Принцип метода ELISA для определения D - ди меров . Специфические антитела нанесены на твердую фазу (пластик). С ними взаимодействует субъединица D из пробы и остается иммобилизованной на твердой фазе, Добавляются проявляющие антитела, конъюгированные с ферментом, которые могут взаимодействовать только с D-ди-мерами. Несвязавшиеся антитела отмываются, добавляется субстрат для фермента, по изменению окраски раствора определяется количество D-димеров, D-мономеры, формирующиеся при деградации фибриногена и входящие в состав ПДФ, не определяются тестом на D-димеры

|