Амидолитические методы с использованием хромогенных и флуорогенных субстратов
Применение синтетических хромогенных субстратов явилось прорывом при исследовании отдельных ферментов или ингибиторов, которые не учитываются простыми коагуляционными тестами или очень трудны для стандартизации. Во многих случаях хромогенные субстраты являются специфичными и позволяют определить протеолити-ческую активность отдельных компонентов плазменного гемостаза и их ингибиторов. Эти тесты схожи с тестами клинической химии, поэтому легко автоматизируются и могут выполняться на биохимических анализаторах как в клинико-диагностических, так и в научных лабораториях.
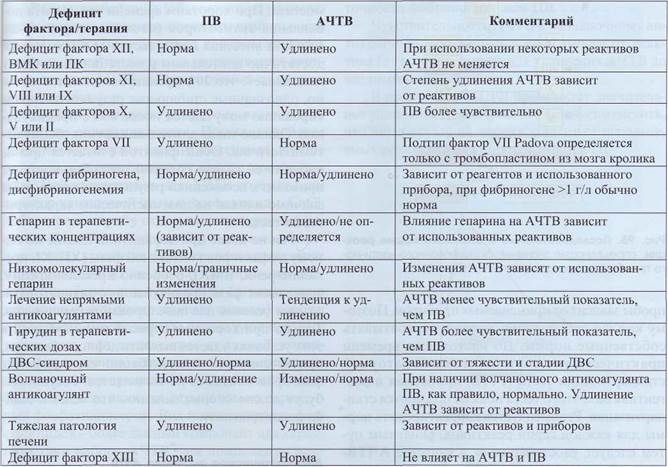
Принцип тестов с хромогенными субстратами представлен на рис. 89. Протеаза расщепляет короткоцепочечный пептид (из 3-10 аминокислот), к которому через эфирную связь пришит хромоген (в нашем случае паранитроанилин -pNA). Комплекс пептид-pNA имеет максимум поглощения в области короткого ультрафиолета, свободный pNA - при 380 нм. Итоговая концентрация pNA пропорциональна активности протеазы и определяется по увеличению поглощения светового пучка с длиной волны 405 нм.
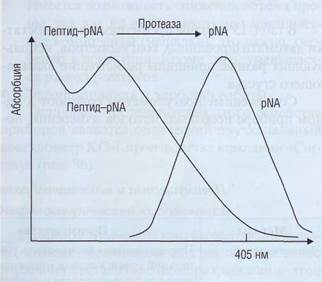
Рис . 89. Принцип определения активности протеолити - ческого фермента ( протеазы ) с использованием хро - могенного субстрата . Максимум поглощения паранитро-анилина, связанного с пептидом, находится в области короткого ультрафиолета, а свободного паранитроанилина -380 нм, При длине волны 405 нм поглощает практически только свободная форма хромогена, на этой длине волны проводится регистрация протеолитической реакции
Обеспечение диагностики нарушений гемостаза в КДЛ
Для оценки активности факторов гемостаза стали использовать флуорогенные субстраты, в
частности 7-амино-4-метилкумарин (АМК), который имеет максимум эмиссии при 440 нм. Флуорогенные субстраты обладают большей аналитической чувствительностью и позволяют измерить специфическую активность компонентов гемостаза в большем диапазоне, чем хромогенные субстраты. Они могут использоваться для определения компонентов гемостаза, присутствующих в плазме в следовых концентрациях или обладающих относительно низкой активностью.
Преимущества использования хромогенных и флуорогенных субстратов:
• Высокая чувствительность метода. pNA или
АМК обладают фотометрическими характе
ристиками, позволяющими использовать ки
нетические методы измерения.
• Высокая специфичность. Для каждой отдель
ной сериновой протеазы системы гемостаза
известна структура участка гидролиза. Моде
лирование в короткоцепочечном пептиде спе
цифической для конкретной протеазы после
довательности из 3 аминокислот позволяет
исключить влияние других протеаз на резуль
таты исследования. При синтезе хромогенных
субстратов для повышения специфичности
используются L- или D-стереоизомеры амино
кислот, а также различные блокирующие груп
пировки, чтобы предупредить деградацию их
неспецифическими аминопептидазами. Кроме того, в тестах используется концентрация хромогенных субстратов в несколько сотен мкмоль/л, что существенно выше, чем константа Михаэлиса (Км) соответствующих ферментов, поэтому скорость реакции не зависит от концентрации субстратов. Факторы, которые необходимо учитывать при использовании хромогенных субстратов в практической клинико-диагностической лаборатории:
• Растворимость субстратов должна быть хо
рошей.
• Реакция должна быстро достигать линей
ность, чтобы использовать соответствующий
набор на биохимических анализаторах, в ко
торых часто бывает ограниченным время
проведения измерения.
• В пробе не должно быть мутности, которую
часто привносит фибрин или денатурирован
ные белки.
Недостатки метода с использованием хромогенных субстратов:
• Высокая стоимость реактивов.
• Возможное завышение результатов при иссле
довании активности витамин-К-зависимых фак
торов у лиц, получающих непрямые антикоа
гулянты либо имеющих дефицит витамина К.
Некоторые хромогенные субстраты, исполь
зуемые для определения активности факторов
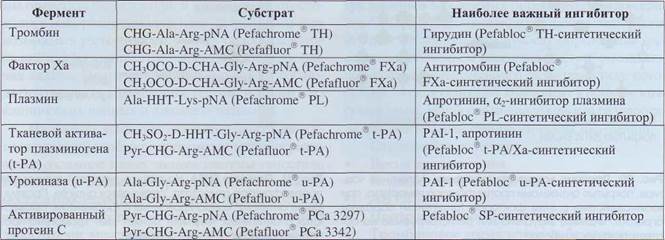
свертывания, представлены в табл. 16.
Таблица 16
Типичные хромогенные и флуорогенные субстраты и ингибиторы, применяемые для выявления активности протеолитических ферментов системы гемостаза

|
Обеспечение диагностики нарушений гемостаза в КДЛ
Иммунохимические методы
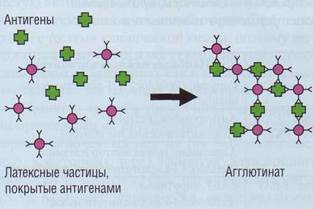
Иммунохимические методы активно начали внедряться в клинико-диагностических лабораториях с целью исследования гемостаза в последнее десятилетие. Они позволяют количественно определять концентрацию конкретного белка, что отличает их от коагуляционных методов и методов с хромогенными субстратами, в которых определяется функциональная активность компонентов, а не их концентрация. Первые тест-системы не позволяли различить активные и неактивные (профакторы) компоненты системы гемостаза. В последнее время предлагается все больше тест-систем для определения концентрации активных компонентов свертывания, их кофакторов, активаторов, ингибиторов, продуктов про-теолитического гидролиза, а также сформировавшихся субстрат-ферментных комплексов. Эти тесты основаны на использовании специфических антител. В современных клинико-диагностических лабораториях доступными стали иммунохимические методы для ручного и автоматизированного использования, основанные на латекс-агглютинации (рис. 90) и методе ELISA (Enzyme-Linked ImmunoSorbent Assay).
Латекс - агглютинация
Латекс-агглютинация выявляется визуально или на автоматизированных нефелометрах. Не-
достатком этого подхода является нелинейность оптического сигнала при турбидиметрическом и нефелометрическом методах регистрации.
Метод ELISA
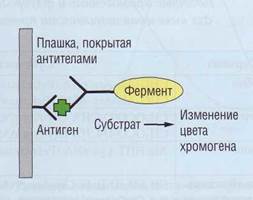
Метод ELISA (рис. 91) для выявления концентрации факторов гемостаза, как правило, использует принцип «сендвича». На стенки микроплашки наносятся антитела к исследуемому фактору гемостаза (твердая фаза). После добавления плазмы происходит осаждение специфического антигена (белка системы гемостаза) на фиксированных антителах. Плашка промывается и заполняется вторичными антителами, взаимодействующими с этим же белком, но по другим эпитопам (антигенным структурам). Вторичные антитела конъюгированы с ферментом (ELISA), радиоактивной меткой (РИА), люминесцентной меткой (ЛИА). В тесте ELISA после отмывки несвязавшихся антител добавляется субстрат ферментативной реакции и хромоген. Изменение светопропускания раствора пропорционально количеству антигена (фактора), осажденного на фиксированных антителах. Методика позволяет оценить этот параметр количественно в концентрации <1 нг/мл, что достаточно для многих компонентов свертывающей системы.
|
|
|
|
Рис . 90. Принцип латекс - агглютинации . Латексные частицы, покрытые антителами против фактора гемостаза, при взаимодействии с этим фактором (антигеном) образуют агрегаты, видимые визуально или регистрируемые на соответствующих приборах
Рис . 91. Принцип ELISA . На плашке, покрытой антителами против фактора гемостаза, связывается антиген, Проявляющие антитела, конъюгированные с ферментом, связываются с антигеном. Фермент меняет цвет хромогена пропорционально количеству антигена
Обеспечение диагностики нарушений гемостаза в КДЛ
В настоящее время значительное развитие получают быстрые качественные и полуколичественные иммунохимические иммунодиффузион-ные методы, основанные на визуальном определении реакции антиген-антитело.
Радиальная иммунодиффузия
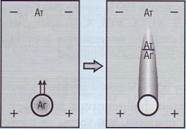
Метод радиальной иммунодиффузии (РИД) основан на образовании колец преципитации в результате взаимодействия специфических антител, содержащихся в геле, с анализируемым антигеном, помещаемым в углубления стандартного размера (рис. 92). В результате диффузии в геле растворимых антигенов кольцо преципитации образуется в зоне оптимального соотношения антиген/антитело. Площадь, ограниченная кольцом преципитации, пропорциональна количеству антигена.
«Ракетный» иммуноэлектрофорез
«Ракетный» иммуноэлектрофорез - иммунологический метод, сочетающий в себе электрофорез и иммунодиффузию (рис. 93). Метод дает возможность различить сходные по электрофоретической подвижности вещества с помощью специфической реакции преципитации между антигеном, помещаемым на гелевую (целлюлозо-ацетатную) пластинку, и соответствующими антителами, которые содержатся в ней. Длина «ракетных» иммунопреци-питатов пропорциональна концентрации антигена. Метод довольно прост в исполнении и обладает относительно высокой точностью.
При фундаментальном подходе к исследованиям компонентов гемостаза применение флуоресцентной или люминесцентной меток повышает чувствительность иммунохимических методов и расширяет спектр определяемых компонентов.
|
|
| Ат | Ат | Ат |
| Ат | Ат | |
| Ат | Ат | Ат |
| Ат | Ат | Ат |
| Ат-Аг | ||
| Ат Щ | О | Ат |
| Ат-Аг | ||
| Ат | Ат | Ат |
Рис . 92. Принцип метода радиальной иммунодиффузии ,
используемый для полуколичественной оценки неко- Рис . 93. Принцип метода «ракетный» иммуноэлектро -
торых факторов гемостаза форез
Скрининговые тесты оценки плазменного звена гемостаза
Лабораторная диагностика нарушений системы гемостаза является одной из самых дорогостоящих в лабораторной практике. Выполнение всех возможных тестов для уточнения характера нарушений для всех пациентов - практически недоступная задача. Поэтому чрезвычайно важно соблюдать этапность проведения тестов, исходить из клинических данных и анамнеза пациента.
На первом этапе для уточнения направленности нарушений необходимо провести тесты, отражающие состояние целых звеньев системы гемостаза. Поскольку в разных лабораториях при анализе гемостаза преследуются разные цели, перечень тестов, входящих в гемостатический скрининг для данной лаборатории, может отличаться от такового в дру-
гих лабораториях. Однако существует набор тестов, традиционно называемых (и рекомендуемых) скри-нинговыми для диагностики состояния системы гемостаза. Обычно к ним относят определение вре мени кровотечения и несколько тестов, оценивающих состояние плазменного звена гемостаза, которые входят как основной компонент в понятие коа- гулограммы. Наиболее полно этапность разработана для диагностики геморрагических нарушений. Скрининговые тесты:
• Время кровотечения.
• Количество тромбоцитов.
• АЧТВ.
• Протромбиновое время (по Квику).
• Тромбиновое время и/или фибриноген.
|
|
Обеспечение диагностики нарушений гемостаза в КДЛ
Для пациентов с тромботическими заболеваниями адекватного скрининга для диагностики нарушений системы гемостаза не разработано. Имеет смысл проведение исследования наиболее значимых маркеров тромбофилии, о которых будет говориться ниже. Однако есть возможность контроля активности самого процесса патологического тромбообразования на основе анализа концентрации маркеров тромбообразования.
Скрининговые тесты на состояние внутреннего и внешнего каскада активации протромбиназы позволяют выявлять нарушения со стороны факторов-субстратов, кофакторов, ингибиторов каскада свертывания, а также действие некоторых
лекарственных препаратов или аутоантител. Основным тестом на состояние внутреннего каскада свертывания плазмы является АЧТВ, на состояние внешнего каскада - ПВ. Их диагностическое значение представлено в табл. 17 и на рис. 94.
Несмотря на то что в тестах АЧТВ и ПВ участвует большинство плазменных факторов, далеко не во всех случаях при патологии того или иного звена или действии лекарственных препаратов эти показатели меняются (табл. 18). Коагу-лограмма - это комплексный анализ по многим тестам, совокупность которых может позволить определить конкретную причину нарушения свертывания крови.
Таблица 17
|
|
· Концентрация фибриногена начинает влиять на результаты тестов при снижении ее ниже определенного порога. Как правило, эти тесты не позволяют количественно определить фибриноген или заподозрить умеренное снижение его концентрации.
 |
Рис . 94. Факторы , влияющие на результаты скрининговых тестов АЧТВ и ПВ . Звездочкой зависимые факторы, на которые влияют антикоагулянты непрямого действия
Обеспечение диагностики нарушений гемостаза в КДЛ
Таблица 18
Изменение А ЧТВ и ПВ при патологии отдельных компонентов плазменного звена гемостаза
и влиянии некоторых лекарственных средств
|
|
| Активированное частичное тромбопластиновое время ( АЧТВ ) |
В названии АЧТВ (иногда его обозначают как активированное парциальное тромбопластиновое время, АПТВ) слово «частичное», или «парциальное», указывает на то, что в тесте используются реагенты, содержащие фосфолипиды, а не тканевые факторы (в этом отличие от ПВ, где используется тканевой тромбопластин). Факторы и взаимные влияния некоторых из них на АЧТВ представлены на рис. 95.
АЧТВ используется как скрининговый тест для оценки внутреннего каскада свертывания плазмы, скрининговой диагностики волчаночного антикоагулянта и слежения за антикоагулянт-ным действием гепаринов. АЧТВ - более значимый тест для первичного выявления патологии,
чем ПВ, так как выявляет относительно часто встречающуюся гемофилию А и В (дефицит факторов VIII и IX соответственно) и наличие волчаночного антикоагулянта.
Лабораторные условия , влияющие на АЧТВ
Нормальные значения теста АЧТВ зависят от используемых реактивов и приборов. Большое значение имеет преаналитическая стадия: принимаемые пациентом лекарственные препараты, правильность взятия крови, использованный антикоагулянт, условия хранения и транспортировки пробы и т. д. Охлаждение пробы ведет к активации контактной фазы in vitro . Стабильность
■
109
Обеспечение диагностики нарушений гемостаза в КДЛ
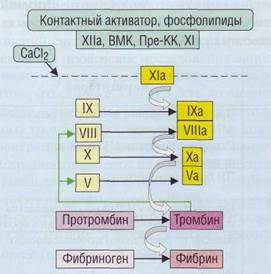
Рис . 95. Последовательные и взаимовлияющие реакции , определяющие значение активированного частичного тромбопластинового времени (АЧТВ)
пробы зависит от применяемых пробирок. Поэтому каждая лаборатория должна нарабатывать собственные нормы. До настоящего времени практически нет системы межлабораторной стандартизации теста АЧТВ, приборная и реа-гентная база этого теста пока не поддаются стандартизации. Рекомендуется корректировать нормы для каждой серии реактивов. Опытным путем следует удостовериться в качестве АЧТВ-реактивов, которые должны отвечать следующим критериям:
• Иметь одинаковые диапазоны нормальных
значений для разных серий реактивов от од
ного производителя.
• Должны выявлять клинически значимое сни
жение факторов свертывания удлинением
времени образования сгустка (т. е. результа
ты должны соответствовать клиническим
проявлениям гипокоагуляции).
• Быть чувствительными к антикоагулянтному
эффекту гепарина, при этом не проявлять
слишком высокой чувствительности при ис
пользовании гепарина в терапевтической
концентрации.
• Выявлять наличие волчаночного антикоагу
лянта, для этого рекомендуется использовать,
в частности, 2 набора с разной чувствитель
ностью к волчаночному антикоагулянту.
Предпочтительно использовать готовые реактивы, что уменьшает ошибку оператора.
Время преинкубации в тесте АЧТВ имеет большое значение для выявления патологии гемостаза. При коротком времени от момента добавления активаторов (каолин и кефалин) до момента внесения СаС12 тест АЧТВ получается достаточно длительным и нестабильным. Опыт показывает, что 30 с преинкубации недостаточно, однозначные стабильные результаты гарантированно получаются после 600 с преинкубации. Однако такая длительная преинкубация нетехнологична. Общепринятой считается преинкубация 60 с, при которой нестабильность не приводит к искажениям результатов, которые бы значимо влияли на диагностические характеристики теста.
Тем не менее при дефицитной плазме по одному из факторов контактной фазы (XII, XI, пре-калликреин, ВМК), особенно прекалликреину, длительная фаза преинкубации с активаторами создает условия для нивелирования результатов. Только при коротком периоде преинкубации в этих условиях удается выявить дефицит фактора, при 60-минутной преинкубации часто дефицит факторов контакта не выявляется. Результаты будут ложно «нормальными», что ведет к ошибочному диагнозу.
Диагностическое значение АЧТВ
Укорочение А ЧТВ иногда определяется у больных с тромбофилией. Это может быть связано с ре-зистентностью фактора V к активному протеину С, повышенным уровнем фактора VIII или активированных факторов свертывания. Однако чаще всего укорочение АЧТВ объясняется нарушениями работы с кровью на преаналитическом этапе.
Удлинение А ЧТВ происходит при:
• врожденном или приобретенном дефиците
факторов II, V, VIII, IX, X, XI, XII, прекал-
ликреина, ВМК;
• снижении активности ф-VIII на фоне болез
ни Виллебранда;
• лечении гепарином, гирудином или апроти-
нином (ингибитор контактной фазы коагу
ляции);
• присутствии в крови ПДФ, волчаночного
антикоагулянта;
Обеспечение диагностики нарушений гемостаза в КДЛ
• нарушении функции печени;
• коагулопатии потребления (ДВС-синдром);
• тяжелой дисфибриногенемии или афибрино-
генемии.
Важно подчеркнуть (обычно это не учитывается), что при хранении снижается стабильность пробы, особенно от больных, которым вводился гепарин. В результате резко увеличивается вариация данных АЧТВ, регистрируемых подряд из одной пробы.
Реактивы, используемые для постановки АЧТВ, не стандартизуются. Поэтому свойства реактивов должны быть известными, лучше пользоваться реактивами от одного производителя. Набор реактивов для АЧТВ содержит активатор контактной фазы и фосфолипиды. СаС12 добавляется в пробу отдельно как стартовый реактив. Контактный активатор - это высокодисперсионная суспензия отрицательно заряженных частиц каолина (белая глина) или эллаговая кислота, полифенол или сульфатиды (отрицательно заряженные сульфатированные липиды) в смеси с каолином. Фосфолипиды используют или синтетические, или выделенные из тканей животных (мозг кролика) или из сои. Лучшие результаты достигаются при использовании смеси разных фосфолипидов, включая отрицательно заряженный фосфатидилсерин. Вид и концентрация фосфолипидов - более важный компонент для характеристики набора АЧТВ, чем компоненты контактной фазы активации. Стабилизация реактива обеспечивается в первую очередь ионной силой раствора и свойствами буферной системы, это во многом влияет на коагуляционные свойства АЧТВ-реактива.
Чувствительность теста А ЧТВ к разным изменениям гемостаза в значительной мере связана со свойствами используемых в тесте реактивов. Большинство тест-наборов АЧТВ (но не все) чувствительно к снижению активности факторов VIII или IX. Однако умеренное снижение активности ф.IХ может не вызывать удлинения АЧТВ при высокой активности ф.VIII, несмотря на наличие геморрагических проявлений у пациента. При дефиците других факторов чувствительность теста значительно варьирует, однако при остатке фактора <10% нормы АЧТВ во всех случаях удлиняется.
Фактор VIII является острофазным белком, повышается при воспалительных реакциях, трав-
мах. Данный факт необходимо учитывать при интерпретации укорочения АЧТВ в этих случаях. АЧТВ - менее чувствительный тест на выявление патологии на общем этапе коагуляции и недостаточности фибриногена, чем ПВ.
Чувствительность АЧТВ к волчаночному антикоагулянту варьирует в зависимости от реактива (от полного отсутствия удлинения АЧТВ до значительного удлинения).
В присутствии ПДФ происходит значительное удлинение АЧТВ (рис. 96). Следует отметить, что ингибирующий эффект зависит от используемых реактивов для определения АЧТВ.
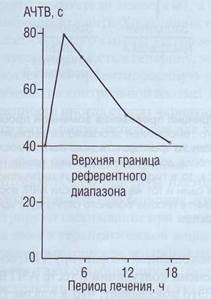
Рис . 96. Изменение АЧТВ из - за накопления ПДФ при лечении стрептокиназой тромбоза глубоких вен бедра. Удлинение АЧТВ значительно превысило референтный диапазон, Результат нельзя объяснить снижением активности отдельных факторов гемостаза. Эффект связан с прямым действием ПДФ на полимеризацию фибрин-мономеров