Влияние физической нагрузки и эмоционального стресса
Физическая нагрузка и эмоциональные переживания сопровождаются изменениями плазменного гемостаза, фибринолиза и функции тромбоцитов. После серии приседаний содержание в плазме фактора Виллебранда (vWF:Ag) увеличивается до 50%о, у спортсменов после бега на 10 км содержание ф.VIII повышается на 60%, vWF -примерно в 3 раза, что приводит к укорочению АЧТВ. Активация фибринолиза после физической нагрузки связана с повышением в плазме тканевого активатора плазминогена (t-PA). Аналогичные изменения наблюдаются у пациентов, перенесших эмоциональный стресс.
Влияние факторов преаналитического этапа на показатели плазменного гемостаза представлено в табл. 10.
Влияние пищи на показатели гемостаза
Практика показывает, что исследование гемостаза необязательно проводить натощак. Легкий завтрак без жира даже показан перед взятием крови на исследование гемостаза.
Характер пищи после длительного периода голодания оказывает влияние на показатели плазменного гемостаза и фибринолиза.
Жирное мясо уменьшает фибринолитическую активность, в то же время бесхолестериновая диета способствует повышению фибринолитичес-кой активности крови.
Фрукты и зеленые овощи в большом количестве способствуют активации фибринолиза в основном за счет уменьшения ингибитора активатора плазминогена (PAI-1).
Рыбная диета в течение нескольких недель сопровождается уменьшением количества и агрегации тромбоцитов, а также снижением фибринолиза. Уменьшение агрегации тромбоцитов объясняется увеличением в их мембране полиненасыщенных жирных кислот, которыми богата рыба и морепродукты.
Витамин С, витамин Е, лук и чеснок могут вызвать нарушения агрегации тромбоцитов.
Витамин К в организме человека частично синтезируется микрофлорой кишечника, частично поступает с пищевыми продуктами. Несмотря на то что при применении per os антибиотиков
Обеспечение диагностики нарушений гемостаза в КДЛ
Влияние различных факторов преаналитического этапа на результаты коагулологических исследований
Таблица 10
| Преаналитические факторы | Влияние |
| Время суток | Снижение содержания факторов свертывания и повышение уровня PAI-1 в ночное время |
| Прием пероральных контрацептивов | Повышение активности большинства факторов свертывания, агрегации тромбоцитов, снижение уровня AT |
| Длительный стаз (более 3 мин) | Увеличение фибринолитической активности, укорочение АЧТВ, ПВ, ТВ, повышение уровня фибриногена, AT |
| Стресс, физическая нагрузка | Повышение фибринолитической активности (уровня t-PA), укорочение АЧТВ, активация фактора VIII, увеличение vWF |
| Положение тела | В положении стоя происходит относительное увеличение содержания факторов свертывания |
| Температура +18... +24 °С в течение 8 часов | Снижение активности факторов VIII, V и IX (удлинение АЧТВ) |
| Температура +4 °С | Увеличение активности факторов VII, XI и XII |
широкого спектра могут возникнуть кровотечения из-за недостатка витамин-К-зависимых факторов, тем не менее для организма важен и пищевой витамин К. Витамин К в больших концентрациях содержится в овощах (шпинате, кабачках), злаках и печени. ПТ может стать патологически удлиненным, если полностью заменить в пище хлеб на помидоры, которые не содержат витамина К. У больных, принимающих непрямые антикоагулянты, исключительно овощная диета в больших количествах требует дополнительной корректировки антикоагулянтного потенциала крови по ПТ. Если такую коррекцию проводить, то овощная диета не будет доставлять особых проблем пациентам, принимающим непрямые антикоагулянты.
Алкоголь влияет на показатели системы гемостаза в зависимости от дозы. После приема алкоголя наблюдается уменьшение антитромбина и фибриногена, повышение ингибитора активатора плазминогена и уменьшение времени кровотечения. Хронический алкоголизм сопровождается уменьшением количества тромбоцитов и нарушением их агрегации, которые однако достаточно быстро восстанавливаются после выхода из запоя.
Кофе даже после 5 чашек не влияет на показатели свертывания крови. Большие дозы кофеина повышают количество t-PA и уменьшают активность PAI-1.
Курение приводит к увеличению агрегации тромбоцитов и их адгезии, повышению β-тром-боглобулина, t-PA, активности PAI-1 и фибриногена, снижению ф.VII.
Кокаин в большой дозе может вызвать настолько сильную активацию и агрегацию тромбоцитов, что это перерастает в тяжелую тромбо-цитопению и ДВС-синдром.
Интерферирующие лекарственные препараты
Оральные контрацептивы повышают активность большинства факторов плазменного гемостаза, увеличивают агрегацию тромбоцитов и снижают уровень протеина С и протеина S. Как правило, сами оральные контрацептивы не вызывают клинических проявлений патологии гемостаза, но они резко увеличивают вероятность тромбозов при наличии наследственных или приобретенных риск-факторов тромбофилий.
Валъпроиковая кислота (используется в препаратах для лечения эпилепсии) может вызвать тромбоцитопению, уменьшение уровня фибриногена, состояние, имитирующее болезнь Виллеб-ранда II типа.
Аспарагиназа (препарат для лечения лимфо-бластных лейкозов) может приводить к снижению фибриногена, уменьшению антитромбина, протеинов С и S, витамин-К-зависимых факторов, снижению плазминогена.
Обеспечение диагностики нарушений гемостаза в КДЛ

Антибиотики широкого спектра действия могут привести к различным отклонениям в показателях гемостаза. Принимаемые внутрь антибиотики вызывают дефицит витамина К в организме за счет подавления активности бактериальной микрофлоры. После назначения высокой дозы пенициллина наблюдалась тромбоцитопе-ния, нарушения функций тромбоцитов, удлинение тромбинового времени.
Анальгетики (нестероидные противовоспалительные, антиревматоидные, жаропонижающие препараты), содержащие ацетилсалициловую кислоту, влияют на функцию тромбоцитов. Необратимое ингибирование циклооксигеназы вызывает подавление, вплоть до полного отсутствия, адгезии тромбоцитов. Другие анальгетики (индо-метацин, фенилбутазон, диклофенак) подавляют агрегацию тромбоцитов в меньшей степени, чем аспирин.
Подбор антикоагулянтов
Материалом для коагулологических исследований является плазма (рис. 69).
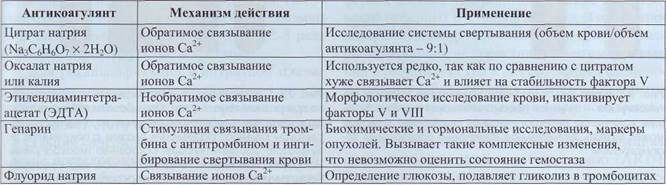
Для получения плазмы или крови для лабораторных исследований используют противосвер-тывающие вещества (табл. 11). Согласно стандарту для производителей DIN ISO Standard 6710 коммерческие пробирки с антикоагулянтом метятся цветом крышки: пробирки с ЭДТА закрыты крышкой светло-лилового (лаванды) цвета, пробирки с гепарином - зеленой, пробирки с цитратом - синей крышкой.
Трехзамещенный цитрат натрия обладает специфической способностью стабилизировать
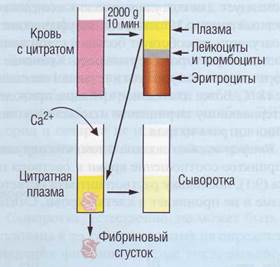
Рис. 69. Получение фракций крови для проведения коагулологических исследований
лабильные факторы свертывания (V и VIII). Цитратная плазма, обогащенная тромбоцитами, используется для изучения их агрегации. В связи с этим цитрат натрия является антикоагулянтом выбора для коагулологических исследований. В соответствии с рекомендацией ВОЗ концентрация цитрата должна быть 109 ммоль.
Кровь смешивают с 3,8% раствором цитрата натрия в соотношении 9:1. На этом этапе могут быть допущены три ошибки.
Первая ошибка - неточность приготовления раствора стабилизатора. Важно учесть, что трехзамещенный 5,5-водный цитрат натрия готовится в концентрации 3,8% (0,11 моль), а 2-водный - в концентрации 3,2%) (0,11 моль). Американский Комитет Стандартизации Клинических Лабораторий
Применение и механизм действия антикоагулянтов
Таблица 11
|
|
Обеспечение диагностики нарушений гемостаза в КДЛ
рекомендует для коагулологических исследовании буферный раствор 3,2% цитрата. Забуферивание антикоагулянта способствует большей стабилизации лабильных факторов свертывания. Хранение раствора цитрата допускается в течение 1 недели при +2...+8 °С. Более длительное хранение приводит к бактериальному загрязнению и снижению концентрации цитрата натрия.
Вторая ошибка связана с тем, что нарушается принятое соотношение крови и раствора цитрата (9:1), поскольку раствор цитрата остается в плазме и не проникает в клетки крови. Считает-
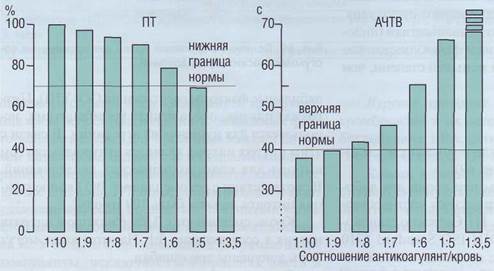
ся, что в пределах разведения крови цитратом 9:1 и 12:1 практически нет различий в результатах коагулологических тестов. Большее количество антикоагулянта по отношению к плазме может вызвать удлинение ПВ и АЧТВ (рис. 70).
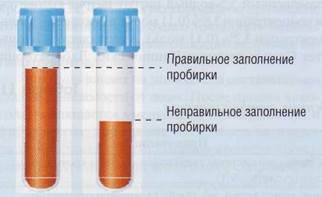
Такая ситуация может возникнуть, когда в приготовленную заранее пробирку с цитратом набрано слишком мало крови (рис. 71).
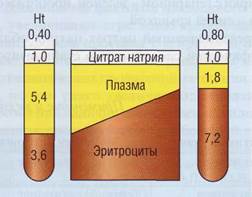
Аналогичная ситуация возникает при разном гематокрите (рис. 72): гематокрит в пределах между 0,25-0,55 (25-55%) несущественно влияет на результаты, при гематокрите свыше 60%
|
|
Рис . 70. Влияние разведе ния крови антикоагулян том на протромбиновый тест (ПТ) и активированное частичное тромбопластино-вое время (АЧТВ), Разведение крови антикоагулянтом сопровождается удлинением ПВ (снижение ПТ) и АЧТВ, при разведении меньшем, чем 8:1, это приводит к регистрации ложноположи-тельного результата
|
|
|
|
Рис . 71. Взято недостаточное количество крови в ан тикоагулянт - типичная преаналитическая ошибка. Большее количество антикоагулянта по отношению к плазме может вызвать значительное изменение показателей ко-агулограммы
Рис . 72. Соотношение объема плазмы и раствора цитрата при разном гематокрите. При высоком гематокрите создаются условия избыточного количества антикоагулянта и слишком сильного разведения плазмы с получением результатов, соответствующих состоянию гипокоагуляции. Наоборот, при низком гематокрите есть высокая вероятность регистрации «ложной» гиперкоагуляции
Обеспечение диагностики нарушений гемостаза в КДЛ
создается избыточная концентрация цитрата в плазме, приводящая к «ложной» гипокоагуля-ции. Напротив, при снижении гематокрита (ниже 25%) обнаруживается «ложная» гиперкоагуляция, кровь при смешивании с цитратом в отношении 9:1 может свернуться в пробирке еще до исследования. Высокий гематокрит - физиологическая характеристика крови новорожденных, у взрослых высокий гематокрит возникает при полицитемиях (эритремиях), сердечной недостаточности.
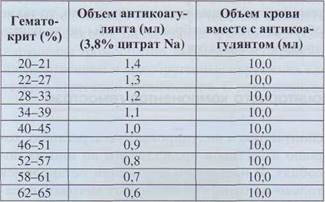
Перерасчет объема стабилизатора в соответствии с гематокритным показателем позволяет избежать этой ошибки (табл. 12). Если же у больного нет значительного сгущения крови или, наоборот, анемизации, приемлемо стандартное соотношение крови и цитрата (9:1).
Таблица 12
Соотношение объема антикоагулянта и венозной крови для постановки коагулограммы
Третья ошибка. Наиболее частой погрешностью при взятии крови является плохое или недостаточное перемешивание ее со стабилизатором. Для предотвращения этого требуется немедленно после заполнения пробирки кровью до требуемого объема закрыть ее крышкой (не резиновой) или чистой полиэтиленовой пленкой и 2-3 раза медленно перевернуть (не встряхивая).
Для рекальцификации к цитратной плазме добавляют определенное количество хлорида кальция. Причиной изменения времени свертывания может стать несоответствие добавляемого кальция содержанию цитрата: коагулологи-ческие исследования являются более чувствительными к избытку кальция в плазме (высокий
гематокрит, слишком мало крови), чем к его недостатку (низкий гематокрит, слишком много крови).
Для некоторых тестов рекомендуются специальные антикоагулянты. При исследовании функции тромбоцитов практически любой антикоагулянт может быть источником ошибок. ЭДТА, флуорид и гепарин не используются при проведении традиционных тестов коагулограммы.
Сыворотка
Сыворотка, естественно, не может быть использована в тестах, основанных на определении выпадения фибрина. Кроме того, сыворотка практически не содержит факторов II, V, VIII и XIII, которые удаляются со сгустком, в сыворотке частично сохраняются ф.VII, -IX, -X и -XII. Сыворотку можно использовать для исследования некоторых компонентов, на определение которых оказывают интерферирующий эффект компоненты плазмы, в частности, в сыворотке можно определять содержание продуктов деградации фибрина/фибриногена (ПДФ).
Хранение и центрифугирование
Кровь в пробирке необходимо тщательно перемешать, перевертывая пробирку, при этом не допускается образования пены. Нельзя трясти пробу, так как это может вызвать денатурацию белков и активацию тромбоцитов.
Сразу же после взятия крови происходит изменение активности компонентов системы свертывания и фибринолиза. В пробе, не закрытой пробкой, возрастает рН из-за потери СО2. Следствием этого является увеличение времени свертывания. На стабильность рН пробы влияет буферная система эритроцитов, а также использование буферных растворов цитрата. В пробе крови, хранящейся при комнатной температуре и закрытой пробкой, не происходит заметных изменений в результатах ПВ и АЧТВ. Эффект физиологического забуферивания за счет эритроцитов исчезает в открытой пробирке при попадании в нее атмосферного воздуха.
Согласно международным рекомендациям срок доставки проб в лабораторию (ARUP Laboratories, 2002) для исследования показате-
Обеспечение диагностики нарушений гемостаза в КДЛ
лей гемостаза не должен превышать 45 минут
после взятия крови у пациента. Стабилизированную кровь до центрифугирования (в том числе и в процессе транспортировки) хранят при комнатной температуре (+18... +25 °С). Транспортировка крови на большие расстояния и ее частое встряхивание искажают результаты исследования. Кровь нельзя хранить во льду (что делается в некоторых клиниках), так как это может привести к холодовой активации фактора XII (процесс запускается через контактную фазу и развивается достаточно часто) и вызвать значительные изменения функции тромбоцитов.
Центрифугирование для получения плазмы должно проводиться при ускорении 1500-2000 g в течение 10 минут, при этом получается плазма, «бедная» тромбоцитами. Если пробы необходимо заморозить перед проведением теста, то после размораживания рекомендуется повторно от-центрифугировать пробу и работать с суперна-тантом. Это делается для удаления остатков разрушенных тромбоцитов, фосфолипидов и белков их мембран, которые могут влиять на некоторые коагуляционные тесты.