Внутренний путь активации фибринолиза
Внутренний путь активации фибринолиза начинается в комплексе реакций контактной активации свертывания крови. Калликреин активирует проурокиназу с образованием активного фермента урокиназы. Кроме калликреина, активация проурокиназы до активной двухцепочеч-ной формы u-РА происходит под воздействием ф.ХIIа и -ХIа, плазмина (положительная обратная связь) и усиливается при связывании с уроки-назным рецептором. В связи с этим у пациентов с дефицитом прекалликреина, XII фактора (болезнь Хагемана) или высокомолекулярного кини-ногена (ВМК), у которых, казалось бы, из-за не-
достатка плазменных факторов должна быть склонность к кровотечениям, наоборот, в результате неполноценной активации фибринолиза имеется тенденция к тромбозам.
Определение u-РА для диагностики нарушений гемостаза практически не проводится, так как диагностическое значение этого фермента пока недостаточно ясно. Однако u-РА является опухолевым маркером карциномы яичника и, вероятно, других опухолей, поэтому имеются коммерческие ELISA-наборы, которые используются для определения u-РА как опухолевого маркера.
Внешний путь активации фибринолиза
Плазминоген имеет высокое сродство к выпавшему фибрину за счет присутствия на фибрине специфических лизин-связывающих участков (сайтов). Эндотелиальные клетки синтезируют и освобождают в систему циркуляции тканевой активатор плазминогена (t-PA). Изучение процесса высвобождения t-PA из клеток показало, что основным стимулятором этого является брадики-нин, который отщепляется от высокомолекулярного кининогена калликреином. Таким образом, процесс активации факторов контактной фазы является основным физиологическим пусковым механизмом фибринолиза. Этот процесс резко усиливается при остановке кровотока и образовании фибрина. t-PA обладает высоким сродством к фибрину. На фибрине формируется комплекс фибрин -тканевой активатор - плазминоген (рис. 58) - наиболее специфическое и эффективное действующее начало фибринолиза. Фибрин, особенно частично деградированный фибрин, служит кофактором t-PA-индуцированной протеолитической активации плазминогена. В результате образования это-
го комплекса плазминоген переходит в активный плазмин, который разрушает пептидные связи в фибрине/фибриногене.
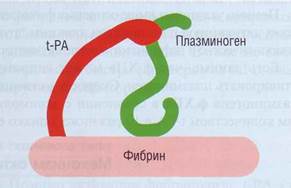
Рис . 58. Активация плазминогена при формировании комплекса фибрин - тканевой активатор - плазминоген на фибрине. Фибрин служит кофактором t-PA-индуцированной протеолитической активации плазминогена. На поверхности фибрина присутствует лизин-связывающий сайт, необходимый для активации плазминогена тканевым активатором
Система фибринолиза
Ингибиторы фибринолиза
|
|
Участки действия основных ингибиторов фибринолиза представлены на рис. 59.
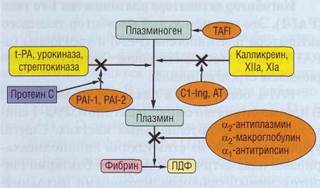
Рис . 59. Ингибиторы фибринолиза , показаны участки основного ингибирующего эффекта, Практически все ингибиторы фибринолиза являются белками острой фазы. TAFI - тромбин-активируемый ингибитор фибринолиза, t-PA- тканевой активатор плазминогена, Cl-Ing -ингибитор 1-го компонента комплемента, AT - антитромбин III, PAI-1, PAI-2 - ингибиторы тканевого активатора плазминогена (тип 1 и 2), ПДФ - продукты деградации фибрина/фибриногена
α г- антиплазмин, α г- макрогло6 улин, α г антитрипсин
α г -антиплазмин (α г-АП) в физиологических условиях быстро инактивирует плазмин, образуя неактивные комплексы. оц-АП имеет высокое сродство к плазмину, взаимодействует с ним, удаляя свободный плазмин из системы циркуляции. В результате время полужизни свободного плаз-мина составляет всего 0,1 секунды. Если же плазмин успевает соединиться с выпавшим фибрином, то взаимодействие плазмин-α г-АП резко снижается (примерно в 50 раз). Недостаточность α г-АП проявляется кровотечениями, так как накапливающийся активный плазмин ускоренно разрушает фибрин и фибриноген. α г-АП - белок острой фазы, однако при массивной активации фибринолиза, в частности при ДВС-синдроме, может наблюдаться истощение α г-АП. Приобретенная недостаточность α г-АП встречается значительно чаще, чем врожденная.
α г -макроглобулин. Этот ингибитор был описан в разделе «Ингибиторы системы свертывания крови». Это неспецифический ингибитор. При активации фибринолиза образующийся из плазминогена (концентрация в плазме свыше 1,5 мкмоль) плазмин в первую очередь связывается α г-антиплазми-ном (концентрация в плазме около 1 мкмоль). После полного насыщения α г-антиплазмина дальнейшая нейтрализация плазмина осуществляется за счет α г-макроглобулина. Кроме того, α г-макро-глобулин инактивирует другие ферменты систе-
мы фибринолиза: урокиназу (u-РА), тканевой активатор плазминогена (t-PA), плазменный каллик-реин, компоненты комплемента, бактериальные и лейкоцитарные протеазы, такие, как эластаза и ка-тепсины.
α1 - aHmumpuncuH . На его долю приходится более 80% антипротеазной активности крови. В сыворотке α1 -антитрипсин содержится в концентрации 1,4-3,2 г/л, или около 52 ммоль/л. Это основной ингибитор сериновых протеаз: трипсина, хи-мотрипсина. Помимо этого, он принимает участие в инактивации плазмина, калликреина, ренина, урокиназы. Благодаря небольшим размерам он может проникать и функционировать в тканях (легкие, бронхи). α1-антитрипсин - белок острой фазы, его выработка увеличивается при реакциях, запускаемых через фактор некроза опухолей, ин-терлейкин-1, интерлейкин-6, а также при высокой концентрации эстрогена в сыворотке в последнем триместре беременности, при приеме эстроген-со-держащих противозачаточных препаратов.
Все 3 описанных ингибитора совместно предупреждают появление плазмина в системе циркуляции в свободном виде, исключая его деградирующий эффект на фибриноген, а также на факторы свертывания VIII, V и другие плазменные белки. Деятельность этих ингибиторов является важным условием поддержания гемостати-ческого баланса.
Система фибринолиза