Материал Кейс-задачи по количественному анализу
Метрология — наука об измерениях, методах и средствах обеспечения их единства и способах достижения требуемой точности. По ГОСТ 31954-2012 «Вода питьевая. Методы определения жёсткости» для анализа комплексонометричесим методом отбирают не менее 200 см3 в емкость, изготовленную из полимерных материалов или стекла. Срок хранения пробы воды - не более 24 ч.
Для увеличения срока хранения пробы и для предотвращения осаждения из воды карбонатов кальция (что характерно для подземных или бутилированных вод) пробу подкисляют кислотой до рН<2. При определении подкисление проводят соляной кислотой. Контроль рН проводят по универсальной индикаторной бумаге или с использованием рН-метра. Срок хранения подкисленной пробы воды - не более 1 мес.
В две лаборатории были отправлены для исследования жёсткости образцы подкисленных проб, срок хранения 10 дней, однако испытательные лаборатории выдали результаты, отличающиеся более, чем допустимо по метрологическим характеристикам метода, указанным в вышеназванном ГОСТе.
Таблица 3.3. Стандартная ошибка комплексонометрического метода определения жёсткости

Предложите не менее семи способов конструктивного решения обеспечения качества аналитических результатов испытательных лабораторий.
Кейс-технология
Современный информационно-технологический век характеризуется законом Мура, который гласит, что каждые 18 месяцев количество информации удваивается. Это означает, что каждые 1,5 года необходимо учиться снова, а, следовательно, то обучение, которое ориентировано главным образом на запоминание и сохранение материала в памяти, только отчасти сможет удовлетворять современным требованиям. Возникает проблема формирования таких качеств мышления, которые позволили бы, самостоятельно усваивать постоянно возобновляющуюся информацию, развитие таких способностей, которые, сохранившись и после завершения образования. «В 90-х годах обновление целей образования переместило акцент на развитие умений сотрудничества; психологическиекачества толерантности; терпимости к чужому мнению; коммуникативные умение вести диалог, искать и находить содержательные компромиссы».
Гуманистическая педагогика рассматривает школьника как сознательного и активного участника учебно-воспитательного процесса, отдаёт приоритет общему развитию интеллектуальных качеств по сравнению с овладением определённым объемом информации, и ставит своей целью развитие школьника в свободную и активную личность, способную к самосовершенствованию и самореализации и готовую для плодотворной деятельности в человеческом обществе
Принято считать, что техника кейс-метода была разработана в начале 20-х годов прошлого века в Гарвардской бизнес-школе и получил развитие в Чикагской школе Эрнст Берджесс, европейской бизнес-школе во Франции. Однако основы этой методики лежат в глубокой древности. Одним из первых кейсологов был Сократ, который много веков назад понял, что знание, полученное человеком в готовом виде, менее ценно для него и потому не так долговечно, как продукт собственного мышления. Задачу учителя он видел в том, чтобы помочь своим слушателям самостоятельно «родить» знания, которые в каком-то смысле уже содержатся в их головах
Тысячелетия спустя использование метода, прародителем которого был
Сократ, назовут ментальным переломом в образовании и получит названия метод кейсов, или проектов, или проблемный метод.
Решение кейсов рекомендуется проводить в 5 этапов: Первый этап – знакомство с ситуацией, ее особенностями; Второй этап – выделение основной проблемы (основных проблем), выделение факторов и персоналий, которые могут реально воздействовать; Третий этап – креативное предложение концепций или тем, в частности для «мозгового штурма»; Четвертый этап – анализ последствий принятия того или иного решения; Пятый этап – решение кейса – предложение одного или нескольких вариантов (последовательности действий), указание на возможное возникновение проблем, механизмы их предотвращения и решения, защита проекта.
Таким образом, кейс-технология может включать пять основных этапов:
Таким образом, кейс-технология может включать пять основных этапов:
1) ВОПРОС. Найти в рассматриваемом материале проблему или задачу, требующую интегрированного знания, исследовательского поиска для ее решения, приводящего к созданию определенного продукта (кейса). Кейс строится как личностно-ориентированный, доступный студентам, с
2) ПЛАН по самостоятельной (индивидуальная и групповая) деятельность обучающихся.
3) Структурирование содержательной части проекта (с указанием поэтапных результатов). СБОР ДАННЫХ:
- обзорная работа, получение теоретических данных, биометрический анализ научной литературы – устанавливается срок;
- исследовательская работа, практическое получение данных – посмотреть на подготовленный обзорный материал под другим углом зрения, основанном на полученных данных,
и придумать новое название кейсу- устанавливается срок (см. рис. Как решать кейс);
4) АНАЛИЗ и техническое задание – сформулировать практическую, теоретическую, познавательную значимость предполагаемых результатов, оригинальность и новизну продукта и пути решения проблемы – устанавливается срок;
- проектирование - указать возможность продолжения и коммерциализации работы (доработки проектного продукта, решения смежных проблем) – устанавливается срок;
5) презентация результата – устанавливается срок) с РЕКОМЕНДАЦИЯМИ в выводе.
Как отмечалось во введение к учебно-методическому пособию, аналитическая химия, наподобие двуликого Януса представляет собой неразделимые теоретическую и практическую часть. Однако, как теория, так практические навыки только тогда будут действительно «приобретены», а не «пройдены», когда после репродуктивного уровня, или выполнения заданий по аналогии, произойдёт продуктивный уровень осмысления, поэтому кейс-задачи должны быть разнообразными, неожиданными, сочетающими несколько тем, затронутых в представленном учебно-методическом пособии и требовать поиск новейшей информации, идти «в ногу со временем», и не могут быть раскрыты в учебно-методическом пособии, в котором представлен только пример кейс-задачи.
СПИСОК
литературных источников
1. Саушкина А. С. Способы расчета в фармацевтическом анализе: учебное пособие для вузов / А. С. Саушкина. — 3-е изд., стер. — СПб: Лань, 2021. — 428 с.
2. Цитович И. К. Курс аналитической химии: учебник / И. К. Цитович. - Изд. 7-е, стер. - СПб. [и др.]: Лань, 2004. — 495 с.
3. Васильев В.П. Аналитическая химия. Ч. 2. Физико-химические методы анализа. Учебник для химико-технологических специальностей вузв / В.П. Васильев.– М.: Высшая школа, 2009. – 387 с.
4. Физико-химические методы анализа. Электронное учебное пособие для вузов. – АлтГТУ, 2011 . – Режим доступа http://www.chem-astu.ru, свободный.
5. Бурова, Т.Е. Экологическая биотехнология : учеб. пособие / Т.Е. Бурова, О.Б. Иванченко;.— Санкт-Петербург : ГИОРД, 2018.— 176. с
6. Физико-химические методы анализа. Лабораторный практикум : учеб.-метод. пособие для студентов химико-технологических специальностей / Е. В. Радион [и др.]; под ред. Е. В. Радион. – Минск : БГТУ, 2010. – 110 с.
7. Основы аналитической химии: краткий курс лекций /Сост. И.В.Кашленко/ Омский аграрный техникум ФГБОУ ВО Омский ГАУ. – Омск, 2015. – 45 с.
8. Определение содержания фосфатов в воде Минск Белорусский государственный университет Химический факультет Кафедра радиационной химии и химико-фармацевтических технологий Методические указания к лабораторной работе, 2018. – 22 с.
9. МУ 08-47/088 Определение массовых концентраций витамина В2 методом дифференциальной вольтамперометрии. Витаминзированные корма и подкормки Аттестована в соответствии с ГОСТ Р 8.563.
10. МУ 08-47/113 Методика выполнения измерений массовой концентрации витамина С методом инверсионной вольтамперометрии. Продукты детского питания, соки, фрукты, ягоды. Аттестована в соответствии с ГОСТ Р 8.563.
11. Аналитическая химия: методическое пособие к лабораторным работам по курсу / сост. А. Е. Гришенкова, Н. Б. Рыжова, Е.
Хайдукова Е.В., А. Л. Новокшанова. - Вологда–Молочное: ВГМХА, 2018. – 42 с.
12. Бовыкина В.С., Бланк Т.Л., Щеглова М.Н. и др. Лабораторный практикум по аналитической химии. Учеб.-метод. пособ. По специальностям «Зоотехния» и «Ветеринария» (Вологодск. гос. молочнохоз. акад. им. Н.В. Верещагина, каф. неорган. и аналит. химии). Вологда, пос. Молочное: ВГМХА, 2010. – 102 с.
Содержание
ВВЕДЕНИЕ..................................................................................................................................................................... 3
Глава 1 количественный анализ. физические методы анализа
1.1 Определение плотности
1.1.1 Определение плотности пикнометром............................................................................................................ 10
1.1.2 Определение плотности с помощью ареометра............................................................................................. 13
1.1.3 Определение плотности с помощью плотномера........................................................................................... 15
1.2 Определение показателя «влажность» или «потеря массы при высушивании» ................... 11
1.2.1 Определение влажности биологически-активной добавки........................................................................... 12
1.2.2. Определение показателя потеря массы при высушивании в растительном сырье..................................... 18
Вопросы и задания для самоконтроля по главе 1................................................................................................................... 18
Примерные исследовательские темы по главе 1..................................................................................................................... 19
Глава 2 количественный анализ. Химические методы анализа
2.1 Гравиметрия............................................................................................................................................................ 20
2.1.1 Определение содержания серы гравиметрией по методу осаждения........................................................... 22
2.2 Особенности различных вилов титриметрического анализа......................................................... 45
2.2 1 Кислотно-основное титрование, основанное на реакции нейтрализации...................................................... 28
2.2.1.1.Приготовление рабочего раствора соляной кислоты................................................................................. 30
2.2.1.2 Приготовление стандартного раствора тетра бората натрия...................................................................... 32
2.2.1.3.Определение точной молярной концентрации эквивалента раствора соляной кислоты......................... 33
2.2.1.4 Определение щелочных продуктов в растворе........................................................................................... 34
2.2.3 Окислительно-восстановительное титрование методом перманганатометрии........................................... 36
2.2.3.1 Приготовление рабочего раствора перманганата калия............................................................................. 68
2.2.3.2 Приготовление стандартного раствора оксалата натрия............................................................................ 38
2.2.3.3 Определение точной молярной концентрации эквивалента раствора перманганата............................... 39
2.2.3.4 Определение железа двухвалентного методом перманганатометрии....................................................... 38
2.3 Осадительное титрование аргентометрическим способом. Определение массы хлорид-иона...................... 40
2.4 Комплексонометрическое титрование с ЭДТА................................................................................................. 42
2.4.1 Определение общей жесткости воды.............................................................................................................. 43
2.4.2 Определение количества ионов Са2+ в воде(жесткость по кальцию)........................................................... 45
2.4.3 Определение количества ионов Mg2+ в воде(жесткость по магнию)........................................................... 45
Вопросы и задания для самоконтроля по главе 2................................................................................................................... 18
Примерные исследовательские темы по главе 2..................................................................................................................... 19
Глава 3 количественный анализ. физико-химические методы анализа
3.1 Классификация методов ФХМА.................................................................................................................... 23
3.2 Электрохимические методы анализа......................................................................................................... 27
3.2.1 Потенциометрия. Закон Нернста..................................................................................................................... 30
3.2.1.1. Определение рН растворов кислот, оснований и гидро-лизующихся солей на иономере ЭВ-74 или на рН-150М 34
3.2.1.2. Определение рН молока и молочных продуктов...................................................................................... 40
3.2.1.3 Определение рН образцов почв................................................................................................................... 42
3.2.1.4 Определение рН образцов почв................................................................................................................... 44
3.2.1.5 Раздельное определение компонентов в бинарных смесях с помощью автоматического титрования.. 47
3.2.2 Вольамперометрическое определение витаминов В1, С в биологических объектах.................................. 48
3.3 отпические методы анализа...................................................................................................................... 50
4.3.1 Фотоколориметрический метод анализа. Закон Бугера-Ламберта-Беера.................................................... 57
4.3.2. Фотоколориметрическое определение содержания ионов меди в растворе............................................... 60
3.3.3 Фотоколориметрическое определение содержания фосфатов в пробах воды............................................ 66
Вопросы и задания для самоконтроля по главе 3................................................................................................................... 70
Примерные исследовательские темы по главе 3..................................................................................................................... 77
Материал Кейс-задачи по количественному анализу.............................................................................. 78
Кейс-технология.......................................................................................................................................................... 79
СПИСОК литературных источников...................................................................................................................... 80
ПРИЛОЖЕНИЕ 1 Правила работы и техника безопасности в лаборатории........................................ 82
ПРИЛОЖЕНИЕ 2 Основные виды химической посуды.................................................................................... 83
ПРИЛОЖЕНИЕ 3 Основные виды аналитического оборудования.............................................................. 86
Приложение 1
Основные правила работы и техника безопасности в лаборатории
1. Для работы в лаборатории необходим халат.
2. Принимать пищу и пить воду в лаборатории можно только в специально отведённом месте, где нет химических реактивов.
3. Перед началом эксперимента необходимо изучить свойства применяемых в опыте веществ и методику выполнения эксперимента.
4. Работы, связанные с использованием или получением летучих и неприятно пахнущих веществ, а также с концентрированными кислотами выполняются только в вытяжном шкафу при включенной тяге.
5. При работе с концентрированными кислотами или щелочами необходимо использовать защитные очки или защитную маску.
6. При разбавлении концентрированных кислот кислоту добавляют в воду.
7. Нельзя пробовать на вкус химические вещества и их растворы, необходимо правильно нюхать вещества с расстояния, направляя струю воздуха от вещества рукой к себе.
8. Склянки с веществами и растворами должны быть снабжены этикетками с чёткими надписями названий веществ.
9. Ядовитых веществ не должно быть в учебной химической лаборатории. В случае просыпания вещества, или разбивания стеклянной посуды, вещество, осколки собирают при помощи специальной щётки на совок.
10. Перед началом использования электрических приборов, нужно проверить их заземление и исправность.
11. При попадании на кожу химических веществ или их растворов, место попадания промывают большим количеством водопроводной воды, затем действуют в соответствии с инструкцией, которой снабжена медицинская аптечка в лаборатории.
12. При нагревании веществ и их растворов необходимо использовать термостойкую посуду, избегать резкого изменения температуры. По окончании работы следует убрать рабочее место, вымыть посуду, выключить электрические приборы, сдать место дежурному студенту и преподавателю.
Приложение 2
Основные виды химической посуды

| 
| 
|
| |
| 1 | 2 | 3 | 4 | |

| 
| 
|
| |
| 5 | 6 | 7 | 8 | |

| 
| 
|
| |
| 9 | 10 | 11 | 12 | |

| 
| 
|
| |
| 13 | 14 | 15 | 16 | |

| 
| 
|
| |
| 17 | 18 | 19 | 20 | |
|

|

|
| |
| 21 | 22 | 23 | 24 | |

|

|
|
| |
| 25 | 26 | 27 | 28 | |

|

| 
|
| |
| 29 | 30 | 31 | 32 | |

| 
|

|
| |
| 33 | 34 | 35 | ||
|
|

|
| ||
| 36 | 37 | 38 | ||
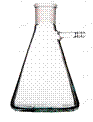
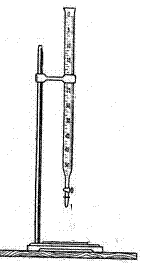
1 - колба круглая плоскодонная; 2 - колба круглая круглодонная; 3 - колба круглая круглодонная двугорлая со шлифом; 4 - колба коническая круглодонная; 5 - колба коническая плоскодонная (Эр); 6 – колба Бюнзена; 7 – колба Вюрца; 7- мерная колба; 9 - мерный цилиндр; 10 – химический стакан; 11 – мензурка; 12 – стеклянный бюкс; 13 – металлический бюкс; 14 – фарфоровый тигель; 15 – металлический тигель; 17 – чашка Петри; 17 – пробирка; 18 – пробирка со шлифом; 19 – пробирка эппендорф; 20 - пробирка с газоотводной трубкой в штативе; 21 – бюретка в штативе; 22- пробирки в штативе; 23 – автоматическая бюретка; 24 – дозатор полуавтомат стеклянный; 25 – эксикатор; 26 – дозатор автоматическая пипетка; 27 – капельница; 28 – склянка; 29 – склянка Вульфа для дистиллированной воды; 30 – кристаллизатор; 31 – пипетки Мора; 32 – часовое стекло; 33 – химический холодильник (змеевиковый холодильник, холодильник Димрота спиральный); 34 – шпатель лабораторный; 35 – груша; 36 - бикс; 37 – кювета; 38 – фиксаналы, или стандарт-титры.
Приложение 3
Примеры аналитического оборудования
|
| 
| ||
| РН-150 МИ pH-метр | Иономер ЭВ-74 | ||
|
| 
| ||
| Колориметр фотоэлектрический концентрационный КФК-2 | Спектрофотометр ПЭ-5300ВИ | ||
|
| 
| ||
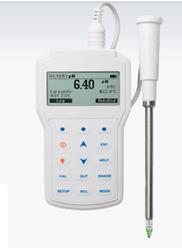
| pH метр для сыра - AQUA-LAB | рН-метр для почвы HI99121 | ||
|
| 
| ||
| Газовый хроматограф | Бумажный хроматограф | ||

|
|
| |
| Рефрактометр ИРФ-454 Б2М | Титратор автоматический или блок автоматического титрования TitroLine 7000 | ВЭЖХ хроматограф KNAUER | |

|
|

| |
| сахариметр СУ-5 | ИК-спектрометр | Атомно-абсорбционный спектрометр | |
|
| 
|

| |
| Кулонометр Эксперт-006 | Кондуктометр | Вольтамперметрический комплекс СТА | |