В сильнощелочной среде восстановление MnO4‾ идет до Mn6+, малиново-фиолетовая окраска раствора переходит в зеленую. Молярная масса эквивалента будет равна молярной массе (2.12)
MnO4‾ + 1 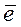
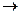 MnO42‾
MnO42‾
f э = 1, Мэ (KMnO4) = М (KMnO4) = 158 г/моль (2.12)
Окислительная способность перманганата калия в кислой среде горазда выше, чем в щелочной или нейтральной. Поэтому титрование перманганата калия, чаще всего, проводят в кислой среде.
2.2.3.1 Приготовление рабочего раствора перманганата калия
Титрование перманганата калия проводят без индикатора, так как одна капля раствора KMnO4 даже при концентрации его, равной 0,01 моль/л окрашивает в конце титрования раствор в отчетливо розовый цвет. Перманганат калия всегда содержит примеси продуктов его восстановления (MnO2). Кроме того, он легко разлагается под влиянием восстановителей – аммиака, органических веществ, попадающих в воду с пылью. Вследствие этого концентрация раствора KMnO4 первое время после приготовления несколько уменьшается. Следовательно, раствор перманганата калия готовят как рабочий с последующей стандартизацией.
Рассчитать объем V концентрированного раствора KMnO4, необходимого для приготовления 400 мл KMnO4, с Сэ = 0,02 моль/л.
Отмерить в стакан на 400 мл вычисленный объем концентрированного KMnO4 и разбавить дистиллированной водой до метки. Приготовленный раствор перелить в склянку на 500 мл и тщательно перемешать.
2.2.3.2 Приготовление стандартного раствора оксалата натрия
Для установки титра раствора KMnO4 используется Na2C2O4, или H2C2O4·2 H2O, или (NH4)2C2O4·H2O.
Окисление ионов C2O42– происходит по схеме:
C2O42‾ – 2 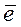
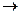 2 СО2
2 СО2
Следовательно молярная масса эквивалента рассчитывается по формуле 2.13 .
f э = ½ ,
Мэ (Na2C2O4) = f э ×М (Na2C2O4) = 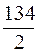 = 67 г/моль (2.13)
= 67 г/моль (2.13)
Рассчитать массу навески Na2C2O4, для приготовления 200 мл раствора Сэ = 0,02 моль/л.
Начертить таблицу № 2. Результаты взвешивания записать в таблицу. Рассчитать точную массу навески (m) оксалата натрия Na2C2O4, молярную концентрацию эквивалента (Сэ) приготовленного раствора и титр (Т) раствора.
2.2.3.3 Определение точной молярной концентрации эквивалента раствора перманганата калия
2 KMnO4 + 5 Na2C2O4 + 8 H2SO4 = 2 MnSO4 + 5 Na2SO4 + K2SO4 + + 10 CO2 + 8 H2O

 MnO4– + 8 H+ + 5
MnO4– + 8 H+ + 5 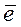
 Mn2+ + 4 H2O 2
Mn2+ + 4 H2O 2
C2O42‾ – 2 
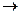 2 СО2 5
2 СО2 5
2 MnO4‾ + 5 C2O42‾ + 8 H+ = 2 Mn2+ + 10 CO2 + 8 H2O
Подготовить бюретку к работе. В бюретке – перманганат калия KMnO4. В отличие от бесцветных растворов, нулевое положение и остальные отчеты ведутся с KMnO4 не по нижнему, а по верхнему мениску.
Ополоснуть пипетку Мора раствором оксалата натрия. В коническую колбу для титрования пипеткой Мора отмерить 20 мл раствора Na2C2O4 и 10 мл 2 н раствора H2SO4. Раствор нагреть на электроплитке до t  70°С. Не кипятить. Титруем горячий раствор Na2C2O4. Из бюретки по каплям добавляем KMnO4 до бледно-розовой окраски. Первые капли KMnO4 обесцвечиваются очень медленно, каждую следующую каплю прибавляем только после того, как исчезнет окраска от предыдущей капли. Титрование проводят не менее трех раз, до близких данных. Рассчитать молярную концентрацию эквивалента перманганата калия по формуле 2.14.
70°С. Не кипятить. Титруем горячий раствор Na2C2O4. Из бюретки по каплям добавляем KMnO4 до бледно-розовой окраски. Первые капли KMnO4 обесцвечиваются очень медленно, каждую следующую каплю прибавляем только после того, как исчезнет окраска от предыдущей капли. Титрование проводят не менее трех раз, до близких данных. Рассчитать молярную концентрацию эквивалента перманганата калия по формуле 2.14.
Сэ (KMnO4) = 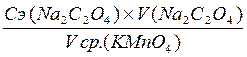 ; моль/л (2.14)
; моль/л (2.14)
2.2.4.3 Определение железа двухвалентного методом
перманганатометрии
KMnO4 + FeSO4 + H2SO4 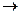 MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
Закончить уравнение реакции восстановления KMnO4 раствором FeSO4.
Контрольная задача выдается в колбе для титрования (титрование разовое). К исследуемому раствору FeSO4 добавить 10 мл 2 н раствора H2SO4 (не греть) и сразу же титровать раствором KMnO4 до бледно-розовой окраски.
Рассчитать массу Fe2+ в растворе по формуле 2.15.
m (Fe2+) = 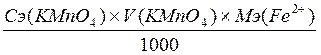 ; г (2.15)
; г (2.15)
2.3 Осадительное титрование аргентометрическим способом
Определение массы хлорид-иона
Метод основан на реакции осаждения ионов Сl‾ и Br‾ катионами серебра с образованием малорастворимых осадков.
Ag+ + Сl‾ = AgСl↓
Ag+ + Br‾ = AgBr↓
Рабочим раствором является раствор нитрат серебра. Нитрат серебра неустойчив при хранении, поэтому его готовят как стандартизованный раствор.
1. Приготовление раствора нитрата серебра
M(AgNO3) = 169,9 г/моль; Мэ(AgNO3) = М = 169,9 г/моль.
Нитрат серебра является дефицитным реактивом, поэтому его готовят с концентрацией 0,01 – 0,02 моль/л. Раствор хранят в склянках из темного стекла. На свету нитрат серебра разлагается с выделением свободного серебра.
Рассчитанную навеску нитрата серебра взвешивают на технических весах, переносят в мерную колбу, растворяя ее в небольшом количестве воды, а затем доводят объем водой до метки.
2. Приготовление стандартного раствора хлорида натрия.
М (NaCl) = 58,5 г/моль, Мэ(NaCl) = 58,5 г/моль.
Рассчитанную навеску NaCl взвешивают на аналитических весах и переносят в мерную колбу, растворяя ее в небольшом количестве воды, а затем доводят объем водой до метки.
Молярную концентрацию эквивалента раствора NaCl рассчитывают по формуле 2.16.
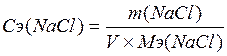 (2.16)
(2.16)
3. Стандартизация раствора нитрата серебра.
Бюретку заполняют раствором нитрата серебра. В колбу для титрования помещают 20,00 мл стандартного раствора NaCl и добавляют 1 мл 5%-ного раствора K2CrO4 и титруют раствором AgNO3 при энергичном перемешивании. Титрование заканчивают, когда чисто желтый цвет жидкости со взмученным в ней осадком приобретает красно-бурый оттенок.
Содержимое колбы после окончания титрования сливают в специально предназначенный для этого сосуд.
Молярную концентрация эквивалента AgNO3 рассчитывают по формуле 2.17.
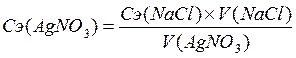 (2.17)
(2.17)
Определите массу хлорид-аниона в контрольном растворе.
К выданному контрольному раствору хлорида добавьте 1 мл 5% раствора K2CrO4 и оттитруйте раствором нитрата серебра.
Рассчитывают массу хлорид анионов по формуле 2.18.
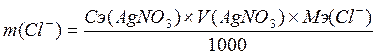 (2.18)
(2.18)
2.4 Комплексонометрическое титрование с ЭДТА
Комплексонометрический метод основан на реакции образования внутрикомплексных соединений ионов металлов с некоторыми органическими веществами. При этом образуется устойчивое, хорошо растворимое в воде внутрикомплексное соединение. Комплексоны – это аминополикарбоновые кислоты, например, нитрилотриуксусная кислота: CH2-COOH HOOC-CH2- +NН CH2-COOH- комплексон I;
Этилендиаминтетрауксусная кислота (ЭДТУ)- комплексон II: HOOC-CH2 CH2-COOH НN + - CH2-CH2- +NН HOOC-CH2 CH2-COOH;
Двунатриевая соль – этилендиаминтетраацетат натрия (ЭДТА, комплексон III или трилон Б.
В практике анализа наиболее часто применяют комплексон III (ЭДТА) – двунатриевая соль этилендиаминтетрауксусной кислоты (комплексон III или трилон-Б), Na2С10H14О8N2 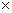 2H2O (сокращенно Na2[H2Y]).
2H2O (сокращенно Na2[H2Y]).

 HOOCH2C CH2COONa
HOOCH2C CH2COONa

 N – CH2 – CH2 – N
N – CH2 – CH2 – N 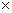 2 Н2О
2 Н2О
NaOOCH2C CH2COOH
Образование комплексоном III внутрикомплексного соединения с ионами Са2+ и Mg2+ происходит путем замещения металлом атомов водорода карбоксильных групп и одновременно взаимодействия катиона с атомами азота аминогрупп (за счет образования координационной связи):

 HOOCH2C CH2COONa
HOOCH2C CH2COONa

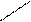 N – CH2 – CH2 – N + МgCl2
N – CH2 – CH2 – N + МgCl2 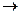
NaOOCH2C CH2COOH



 Мg
Мg
 | |||
 | |||

 OOCH2C CH2COONa
OOCH2C CH2COONa
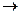

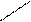 N – CH2 – CH2 – N + 2 НCl
N – CH2 – CH2 – N + 2 НCl
 NaOOCH2C CH2COO
NaOOCH2C CH2COO
(сплошными линиями здесь показаны обычные связи, а стрелками – координационные).
Мэ (MgCl2) = f э × M (MgCl2); f э = ½ , эквивалент z=2, т.к. в ходе реакции вытесняется два иона водорода.
Точка эквивалентности определяется при помощи индикаторов. Такими индикаторами являются эриохром черный и мурексид. Это органические красители, образующие с катионами металлов окрашенные комплексные соединения.
2.4.1 Определение общей жесткости воды
Природная вода из-за наличия в ней различных растворимых солей кальция и магния всегда обладает определённой жесткостью. Общей жесткостью воды называют сумарную жёсткость, обусловленную наличием в ней ионов кальция и магния, включая постоянную и временную жёсткость. Жесткостью устранимой (временной) называется такая, которая устраняется кипячением и неустранимой (постоянной) - которая не устраняется кипячением.
Устранимая жесткость обусловлена наличием в воде гидрокарбонатов кальция и магния, которые при кипячении разлагаются с выделением углекислого газа и осадка карбонатов
Са(НСО3)2 = СаСО3 + СО2 + Н2О
Mg(HCO3)2 = MgCO3 + СО2 + Н2О
Постоянная жесткость воды обусловлена присутствием в воде сульфатов и хлоридов кальция и магния, определяется титрованием воды соляной кислотой, которая переводит гидрокарбонаты в хлориды:
Са(НСО3)2 + 2 НСl = СаСl2 + 2 СО2 + Н2О
Mg(HCO3)2 + 2 НСl = MgCl2 + 2 СО2 + Н2О
Комплексонометрически определяют Индикатор хромоген черный специальный ЕТ-00 (С20Н13О7N3S) в щелочной среде образует анион HJnd2– , имеет синюю окраску. С катионами Са2+ и Mg2+ он образует комплекс винно-красного цвета:
Ме2+ + HJnd2– 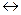 МеJnd– + Н+
МеJnd– + Н+
синий винно-
красный
При последующем титровании комплексоном III этот комплекс разрушается: ионы металла связываются комплексоном в более прочное комплексонное соединение, а анионы индикатора переходят в раствор, сообщая ему синюю окраску:
МеJnd– + [Н2Y] 2– 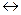 [ MeY] 2– + HJnd2– + H+
[ MeY] 2– + HJnd2– + H+
винно- бесцвет- бесцвет- синий
красный ный ный
В результате этого винно-красная окраска раствора сменяется синей. Наиболее четко она изменяется в щелочной среде, при рН 8 – 10. Поэтому к титруемому раствору добавляют аммонийную буферную смесь (NH4OH + NH4Cl), которая нейтрализует выделяющиеся при реакции ионы Н+.
Основные химическая посуда, реактивы:
Мерный цилиндр на 50 мл, колбы Эрленмейера на 200 мл для титрования; бюретка на 20 или 25 мл в штативе с бюреточной воронкой; трилонон-Б (комплексон III) Сэ=0,05 моль/л, р-р NaOН 2н, аммонийная буферная смесь (NH4OH + NH4Cl), индикаторы мурексид и эрихром черный в сухом виде.
Ход работы:
1. Заполнить бюретку трилоном-Б (комплексон III) с Сэ = 0,05 моль/л.
2. В коническую колбу на 250 мл с помощью мерного цилиндра отмерить 50 мл водопроводной воды, отмерить 50 мл дистиллированной воды и тоже внести в колбу.
3. Добавить 10 мл аммонийной буферной смеси и на кончике шпателя индикатор хромоген черный (эриохром черный Т), все перемешать. Цвет раствора должен быть винно-красный.
4. Титровать воду раствором трилона Б до перехода винно-красной окраски в сине-зеленую. Повторить титрование 2 – 3 раза.
Рассчитать общую жесткость воды по формуле 2.19.
Ж (Са+Mg)= 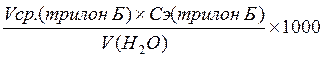 ; ⁰Ж (2.19)
; ⁰Ж (2.19)
2.4.2 Определение количества ионов Са2+ в воде
(жесткость по кальцию)
1. Заполнить бюретку трилоном-Б (комплексон III) с Сэ = 0,05 моль/л.
2. В коническую колбу на 250 мл с помощью мерного цилиндра отмерить 50 мл водопроводной воды, отмерить 50 мл дистиллированной воды и тоже внести в колбу.
3. Добавить 10 мл 2 н. раствора NaOH и на кончике шпателя индикатор мурексид, все перемешать. Цвет раствора должен быть малиновым.
4. Титровать воду раствором трилона-Б до перехода малиновой окраски в фиолетовую.
5. Повторить титрование 2 – 3 раза.
6. Рассчитать жесткость воды по кальцию по формуле 2.20.
Ж (Са) = 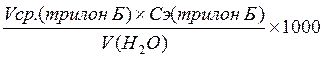 ; ⁰Ж (2.20)
; ⁰Ж (2.20)
2.4.3 Определение количества ионов Mg2+ в воде
(жесткость по магнию)
Рассчитать жесткость по магнию по формуле 2.21.
Ж (Mg) = Ж общ. – Ж (Са2+); ⁰Ж (2.21)
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). По ГОСТ различают воду:
• мягкую жесткость ее меньше 2 °Ж;
• средней жесткости жесткость 2 – 10 °Ж;
• жесткую жесткость больше 10 °Ж.
Наиболее оптимальной для постоянного употребления считается вода с соотношением Са; Mg равным примерно 1:0,5.
Сделайте вывод о пригодности воды по жёсткости для питья и её нутрционном балансе кальция к магнию.
Вопросы и задания для самоконтроля по главе 3
4. Укажите каким методом можно провести следующие исследование:
- титруемую кислотность молока;
-титруемую кислотность малинового сока;
- общую жесткость воды;
- жёсткость воды по кальцию;
- жесткость воды по магнию.
Примерные исследовательские темы по главе 2
5. Отбор проб для определения плотности различных биологических объектов.
6. Произведите самостоятельно отбор пробы воды по стандарту и исследуйте общую жесткость, жесткость по кальцию, определите жёсткость по магнию.
7. Найдите методику приготовления и самостоятельно, под присмотром преподавателя, приготовьте раствора комплексона III.
8. Выберите свой биологический объект исследования (растительное сырьё, биологически-активная добавка, корм для животных, почва, минеральное удобрение и др.), изучите особенности его исследования, определите в нём рН сделайте вывод о соответствии ожидаемого и фактического результата.
9. Подготовьте свой видеоролик по наиболее трудному для вашего восприятия материалу по химическим методам количественного анализа.








