6. Рассчитать точную массу навески, взятую для приготовления раствора.
7. Обмыть воронку горячей дистиллированной водой из промывалки, объем в колбе не должен превышать ⅓ колбы.
8. Добиться полного растворения вещества в колбе, затем остудить раствор под струей холодной воды.
9. Долить раствор в колбе холодной дистиллированной водой так, чтобы нижний край мениска лежал ровно на метке.
10. Закрыть колбу пробкой, раствор тщательно перемешать в течение 3 – 5 минут.
11. Рассчитать молярную концентрацию эквивалента (Сэ) приготовленного раствора и титр (Т) раствора Na2B4О7 ∙10 Н2О по формулам 2.8 и 2.9.
Сэ = 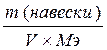 , (моль/литр) (2.8)
, (моль/литр) (2.8)
Т = 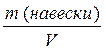 ,( г/мл) (2.9)
,( г/мл) (2.9)
2.2.1.3 Определение точной молярной концентрации эквивалента раствора соляной кислоты
Рабочий раствор соляной кислоты по п. 3.1.1. готовится с примерной концентрацией, без использования аналитических весов или фиксанала. Для его стандартизации рабочего раствора соляной кислоты используем титрование стандартным раствором борной кислоты:
Na2B4О7 + 2 HCl + 5 Н2О + 2 NaOH = 2 NaСl + 4 Н3BO4
Выбор индикатора: при достижении точки эквивалентности в растворе находится слабая борная кислота.
рН = ½ рК (к-ты) – ½ lgС (к-ты) = 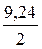 – ½ lg 5
– ½ lg 5  10–2 = 5,3
10–2 = 5,3
Среда раствора кислая, для титрования подойдет индикатор метиловый красный рТ = 5,5. Титрование можно проводить и с метилоранжем, т.к. его показатель титрования рТ = 4, не выходит за пределы скачка титрования.
Для выполнения работы необходимы технические и аналитические весы, ареометр.
Основные химическая посуда, реактивы:
Мерные колбы на 200 и 500 мл для приготовления растворов; солевая воронка; колбы Эрленмейера на 100 мл для титрования; бюретка на 20 или 25 мл в штативе с бюреточной воронкой; химические стаканы для взвешивания борной кислоты и слива из бюретки; хлороводород ч.д.а.; борная кислота х.ч.
Ход работы:
1. Вылить из бюретки воду. Ополоснуть бюретку дважды небольшим количеством приготовленного раствора соляной кислоты. Наполнить бюретку этим раствором выше нулевого деления. Удалить пузырьки воздуха из капилляра бюретки.
2. Установить раствор в бюретке на нулевом делении. Для этого необходимо налить в нее кислоты несколько выше нулевого деления, снять воронку и выпустить избыток кислоты. Всякий раз, устанавливая раствор в бюретке на нулевом делении, не забывайте снимать воронку, так как капли с воронки будут изменять уровень жидкости в бюретке. Следите за тем, чтобы не было пузырьков воздуха в капилляре бюретки. Бюретка готова к работе, если уровень раствора установлен на нулевом делении и в капилляре отсутствуют пузырьки воздуха.
3. Приготовление «свидетеля». Отмерить цилиндром 40 мл дистиллированной воды, перенести в коническую колбу, добавить две капли метилоранжа и прилить из бюретки 1-2 капли кислоты до появления оранжевого окрашивания. Приготовленный «свидетель» используют в качестве образца при титровании, добиваясь, чтобы окраска титруемого раствора и «свидетеля», была одинаковой.
4. Ополоснуть пипетку Мора дважды небольшим количеством раствора тетрабората натрия. Набрать раствор в пипетку Мора выше нулевого деления, закрыть отверстие пипетки указательным пальцем и установить нулевое положение. В коническую колбу для титрования отмерить пипеткой Мора 20,00 мл раствора Na2B4О7, добавить 1–2 капли индикатора метилоранжа. Раствор окрасится в светло-желтый цвет.
5. Оттитровать раствор буры раствором соляной кислотой. В колбу с раствором буры осторожно приливать раствор кислоты, постоянно перемешивая содержимое колбы круговыми движениями. Первые порции раствора (13 – 15 мл) можно приливать струей. Дальнейшее титрование нужно вести осторожно по каплям до появления оранжевой окраски не исчезающей в течение 30 секунд.
6. По делениям бюретки определить объем кислоты, пошедший на титрование с точностью до сотых долей мл. Титрование повторить 2–3 раза для получения сходящихся результатов. Рассчитать средний объем кислоты:
V1 (HCl) =
V2 (HCl) =
V3 (HCl) =
 Vср. (HCl) =
Vср. (HCl) =
(Разность между титрованиями не должна превышать более чем 0,1 мл, если разность между титрованиями будет больше, чем 0,1 мл, то это титрование в расчет не берется). После каждого титрования колбу вымыть под струей холодной воды и затем ополоснуть дистиллированной водой. Долить раствор HCl в бюретку и установить на нулевом положении
7. Зная молярную концентрацию эквивалента раствора буры, объем раствора буры, взятый для титрования; средний объем раствора кислоты, пошедший на титрование, рассчитать молярную концентрацию эквивалента раствора соляной кислоты по формуле 2.10.
Сэ (HCl) = 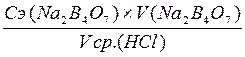 ; моль/л (2.10)
; моль/л (2.10)
2.2.1.4 Определение щелочных продуктов в растворе
Этот анализ является контрольным, по его результатам судим о правильности стандартизации раствора HCl.
Стандартизованный раствор соляной кислоты может служить для определения содержания вещества в растворах щелочей и гидролитически щелочных солей.
КОН + HCl = КCl + H2O
m (КОН) = Сэ(КОН) × V(КОН) × Мэ(КОН)
Учитывая то, что Сэ(КОН) × V(КОН) = Сэ(HCl) × V(HCl) , массу КОН можно определить следующим образом:
m (КОН) = Сэ(HCl) × V(HCl) × Мэ(КОН)
Контрольная задача КОН выдается в конической колбе для титрования. Добавить 1–2 капли индикатора метилоранжа. В бюретке раствор HCl довести до нулевого положения. Оттитровать раствор КОН раствором кислоты до оранжевой окраски.
По полученным данным рассчитать массу КОН в растворе
2.2.3 Окислительно-восстановительное титрование методом перманганатометрии
Окислительно-восстановительное титрование (редокститрование) – метод титриметрического определения веществ, основанный на изменении редокс-потенциала системы при протекании окислительно-восстановительной реакции в процессе
титрования. Методы титрования растворами окислителей объединяют в группу оксидиметрии, на титровании растворами восстановителей – редуциметрии. Методытакже классифицируют в зависимости от природы титранта, например метод, основанный
на окислении перманганатом, называется перманганатометрия, на окислении иодом –иодометрия, на окислении бихроматом – бихроматометрия; на восстановлении аскорбиновой кислотой – аскорбинометрия, на восстановлении соединениями титана(III)
– титанометрия и т.д. Широкое применение методов окислительно-восстановительного титрования в практике обусловлено многими их достоинствами, среди которых – высокая точность, хорошая воспроизводимость, экспрессность и т.д. Для обнаружения конечной точки титрования применяют безиндикаторный, индикаторные и инструментальные методы. Примером безиндикаторного метода может служить фиксирование конечной точки титрования по появлению или исчезновению розовой окраски титруемого раствора в перманганатометрии.
Метод перманганатометрии основан на реакциях восстановления ионов перманганата. Восстановление может проводиться как в кислой среде, так и в щелочной или нейтральной среде.
В сильнокислых растворах перманганат-ион (имеющий малиново-фиолетовую окраску) восстанавливается до иона двухвалентного марганца (бесцветная окраска).
MnO4‾ + 8 H+ + 5 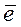
 Mn2+ + 4 H2O
Mn2+ + 4 H2O
Фактор эквивалентности перманганата калия в кислой среде f э = 1/5, молярная масса эквивалента KMnO4, молярная масса эквивалента вычисляется по формуле 2.11.
Мэ (KMnO4) = f э ×М = 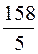 = 31,61 г/моль. (2.11)
= 31,61 г/моль. (2.11)
Окислительный потенциал пары MnO4‾/Mn2+ сильно зависит от рН раствора и определяется по формуле:
Е = Е0 = 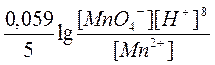
В нейтральной или слабощелочной средах восстановление MnO4‾ идет согласно уравнению реакции:
MnO4‾ + 3 H2О + 3 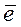
 MnО(ОН)2
MnО(ОН)2  + 4 ОH‾
+ 4 ОH‾
f э = ⅓, Мэ (KMnO4) = f э × М = 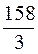 = 52,6 г/моль.
= 52,6 г/моль.
т. е. ион MnO4‾ восстанавливается до Mn4+.
Образуемый MnO(OH)2 представляет собой бурый осадок, присутствие которого в растворе затрудняет определение точки эквивалентности.








