Глава 2 количественный анализ. Химические методы анализа
Химические методы (химический анализ) основаны на проведении химической реакции между изучаемым образцом и специально подобранными реактивами. В химических методах аналитический сигнал, возникающий в результате химической реакции, наблюдают, главным образом, визуально.
Основными химическими методами анализа являются гравиметрия и титриметрия. Определение показателя «влажность» или
«потеря массы при высушивании» уже являлась простейшей формой метода гравиметрического метода анализа - без проведения химической реакции и/или осаждения. В следующих разделах представлены лабораторные работы для изучения более трудоёмких химических методов анализа.
2.1 Гравиметрия
Сущность гравиметрического анализа (гравиметрии) заключается в определении массы продукта химической реакции. Измеряют взвешиванием на аналитических весах массу вещества, называемого гравиметрической формой.
Гравиметрия является наиболее простым, точным, хотя и продолжительным методом анализа. Метод широко применяют для количественного определения неорганических и органических веществ.
Гравиметрический анализ выполняют с использованием методов отгонки или осаждения.
Метод отгонки. В этом методе определяемая часть анализируемого объекта должна быть летучей или должна превращаться в летучее соединение по той или иной химической реакции. Отгонка в свою очередь может выполняться как в прямом, так и в косвенном вариантах. Примером прямого метода может служить определение СО2 в карбонатных породах. В этом случае навеску образца обрабатывают кислотой: СО2 отгоняют в предварительно взвешенный сосуд, содержащий поглотитель (натронную известь – смесь NaOH, CaO, или аскарит – асбест, пропитанный NaOH). По увеличению массы сосуда судят о содержании СО2 в анализируемом образце. В косвенном методе о содержании летучего компонента судят по убыли массы взятой навески анализируемого вещества. Таким способом часто определяют содержание воды. Для этого навеску анализируемого образца высушивают при определенной температуре и по убыли массы судят о содержании воды. Естественно, что в анализируемом веществе должны отсутствовать другие, летучие при данной температуре, компоненты.
Метод осаждения. Наибольшее значение в гравиметрии имеет метод осаждения. При этом определяемый компонент выделяют из раствора в виде малорастворимого соединения (или в виде элемента), которое после соответствующей обработки взвешивают. В методах осаждения анализируемое вещество вначале растворяют, затем переводят в осадок (осаждаемая форма). Затем осаждаемую форму вещества отфильтровывают, промывают, прокаливают, в результате прокаливания получается – весовая форма.
FeCl3 + 3 NH3·Н2О = Fe(OH)3↓ + 3 NH4Cl
Осаждаемая форма
2 Fe(OH)3 → Fe2O3 + 3 Н2О
Весовая форма
По массе весовой формы рассчитывают массу определяемого элемента и выражают его содержание в процентах в анализируе-мом веществе.
Если химический состав осаждаемой формы может быть неопределенным, то основное требование к гравиметрической форме заключается в том, что она должна иметь постоянный состав, отвечающий определенной химической формуле. Таким образом, в гравиметрии имеют дело с малорастворимыми веществами. Не всякие осадки могут быть использованы в гравиметрии, к ним предъявляется ряд требований.
Требования к осадкам в гравиметрии:
1. Осадок должен быть практически нерастворимым, т.е. определяемый элемент (ион) должен выделятся в осадок количественно, (осаждение считается количественным, когда остаточная масса осаждаемого вещества остается за пределами точности взвешивания аналитических весов (0,0002 г.)).
2. Осадок должен выделяться в форме, удобной для его отделения от раствора и промывания, он должен быть крупнокристаллическим или хорошо скоагулированным. Важно, чтобы он был однородным по дисперсности (размерам частиц).
3. Осадок должен быть чистым, по возможности не содержать посторонних примесей (аналитик должен иметь возможность оценивать его чистоту). Растворимость осадков Степень полноты осаждения определяется растворимостью осаждаемого вещества во время образования, фильтрования и промывания осадка. Растворимость малорастворимого соединения зависит от многих факторов. Основные из них: присутствие в осаждаемом растворе электролитов, кислотность раствора, присутствие комплексообразующих веществ, температура, природа растворителя.
2.1.1 Определение содержания серы гравиметрией
по методу осаждения
Определение содержания сульфат-ионов(серы) позволяет освоить и приобрести навыки количественного анализа вещества по методу осаждения кристаллического осадка. Сущность метода: образование малорастворимого кристаллического осадка ВаSO4 (ПР = 1,1 . 10-10) по реакции:
Ва+2 + SO4 -2 = ВаSO4 ↓
При выполнении анализа необходимо соблюдать следующие меры предосторожности: проверить заземление сушильного шкафа и муфельной печи; помещать и доставать тигель в шкаф и печь с помощью тигельных щипцов. Нельзя брать тигли пальцами во избежание ожога и загрязнения тигля, а также помещать горячие тигли на дерево или пластикат; после работы необходимо тщательно мыть руки.
Для выполнения работы необходимы муфельная печь; аналитические весы, 2 класса.
Основные химическая посуда, реактивы:
фарфоровый тигель; эксикатор; стакан вместимостью 150 - 250 мл; воронка; бюретка; хлорид бария, ВаСI2, 0,2 М раствор; хлороводородная кислота, НСI, 2 М раствор; фильтр “синяя лента”.
Ход работы:
1. Заранее прокаливают тигель и доводят его до «постоянной массы». Для этого взвешивают тигель сначала на технохимических, а затем на аналитических весах с точностью ± 0,1 мг и ставят его прокаливать в муфельную печь на 30 минут при температуре 800 0С. После этого тигель щипцами вынимают из печи, помещают в эксикатор на 20 – 30 мин для охлаждения (крышку эксикатора закрыть через 10 – 15 секунд), затем взвешивают с точностью ± 0,1 мг. Прокаливание, охлаждение, взвешивание повторяют до «постоянной массы» “т”.
2. У преподавателя получают контрольную задачу в стакане вместимость 150 мл. Предварительно стакан моют, ополаскивают дистиллированной водой (сушить стакан не надо), приклеивают этикетку с фамилией студента. В стакан добавляют 50 – 60 мл воды, 2 мл 2 М раствора НСI и нагревают на плитке до кипения (кипятить нельзя!). Осаждение: Гравиметрическая форма совпадает с осаждаемой формой.
3. Для фильтрования берут плотный фильтр («синяя лент») диаметром 7 - 11 см., сворачивают его, вставляют в чистую воронку (край воронки должен быть выше края фильтра на 1 см), смачивают дистиллированной водой из промывалки и плотно прижимают к стенкам воронки, особенно в местах, где находятся складки фильтра (рис.2.1, 2.2).
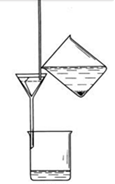
4. Воронку с фильтром помещают в кольцо штатива и подставляют под нее чистый стакан, касаясь внутренней стенки стакана концом трубки воронки. Сначала декантируют прозрачную жидкость (рис.3), что ускоряет фильтрование в десятки раз. Для этого осторожно снимают бумагу со стакана с осадком и вынимают палочку так, чтобы не взмутить осадок. Порцию прозрачной жидкости над осадком по палочке, медленно, чтобы не взмутить осадок, сливают из стакана на фильтр (декантация). Уровень жидкости в воронке должен быть на 0,5 см ниже края фильтра. Стакан с остатком раствора медленно приводят в более вертикальное положение, ставят на стол в наклонном положении (чтобы не взмутить осадок). Когда порция жидкости пройдет полностью через фильтр, снова по палочке, осторожно приливают на фильтр новую порцию прозрачной жидкости. Промывание осадка. Когда прозрачная жидкость почти вся будет слита, к осадку в стакан прибавляют 5-7 мл дистиллированной воды. Осторожно взболтав осадок (не размазывать его по стенкам стакана), дают ему отстояться и сливают отстоявшуюся жидкость по палочке на фильтр. Такое промывание декантацией проводят 3-4 раза, давая возможность каждой порции жидкости полностью стекать. В последний раз взмученный осадок из стакана осторожно по палочке, по возможности сразу весь, переносят на фильтр.
5. Остатки осадка в стакане полностью (в 2-4 приема) смывают тонкой струей воды из промывалки на фильтр. Здесь и затем при промывании осадка необходимо следить, чтобы содержимое воронки во всех случаях было на 0,5 см ниже края фильтра.
6. Свободную поверхность воронки, затем по кругу верхнюю часть фильтра промывают водой из промывалки. Каждая порция жидкости должна полностью стекать. Промывка ведется 4-6 раз до отрицательной реакции на хлорид-ион: к порции фильтрата (около 0,5 мл), собранной в пробирку, добавляют 1 каплю 2 моль/л AgNO3. Мути не должно быть, возможна легкая опалесценция. Объем фильтрата необходимо записать в журнале для последующего учета потерь осадка за счет его растворения. Обычно он составляет около 200 мл =0.2 л.
7. Высушивание и прокаливание. Фильтр с осадком извлекают из воронки за край, где сложено 3 слоя, и слегка отжимают. Затем загибают края и помещают в тигель, предварительно доведённый до «постоянной массы» “т”. Тигель с фильтром ставят на 5- 10 минут в сушильный шкаф при температуре 1200С, а затем с ещё влажным фильтром переносят в муфельную печь и ставят у её входа, приоткрыв дверцу. После того, как фильтр обуглится и истлеет (появление пламени не допускать!), тигель переставляют в самую горячую часть печи (осторожно! не уроните другие тигли). Прокаливание ведут 20 – 30 минут при температуре 8000С. Затем тигель осторожно вынимают и ставят в эксикатор, который закрывают крышкой через 5 – 10 секунд. После охлаждения в течение 20 – 30 минут в эксикаторе повторно взвешивают на аналитических весах. И так до получения «постоянной массы», то есть, когда разница в массе будет не более 0,2 – 0,3 мг. Таким образом, получают массу ”р”.
8. Запись данных. Данные записывают с точностью ± 0,1 мг по форме:
масса тигеля (пустого): 1-е взвешивание т1= 14,8674 г
2-е взвешивание т2 = 14,8670 г
3-е взвешивание т3= 14,8672 г и т.д.
Масса тигеля с сульфатом бария: 1-е взвешивание р1= 15,3774 г
2-е взвешивание р2= 15,3726 г
3-е взвешивание р3=15,3724 г и т.д.
Масса ВаSO4: М = (р3-т3) = 15,3724 – 14,8672=0,5052 г.
Потери при промывании осадка: П= ν . М . (ПР) 1/2 = 0,2. 233,4. (1,1. 10-10) 1/2=0,0005 г, где = ν – объем промывных вод; М- молярная масса ВаSO4; (ПР)1/2 - растворимость сульфата бария, моль/л.
Расчеты содержания SO4 2- ведут, используя 4 – 5 значащих цифр по форме: Х=(М+П) . (М SO4--/МВаSO4) = (М+П) . ФSO4 -- /ВаSO4 = (М+П). (96,06/233,4) = 0,5057 . 0,04116= 0,02081 г сульфат- иона, где ФSO4-- / ВаSO4 фактор пересчета SO4 2- по ВаSO4.
Окончательный результат округляют до десятых мг, в данном примере – до 0,0208 г. Получив у преподавателя данные по содержанию SO4 2- , проводят статистическую обработку результатов анализа по двум проворностям.
| 
| 
|
| Рис 2.1. Правильно сложенный бумажный фильтр | Рис 2.2. Правильно вложенный а воронку фильтр | Рис 2.3. Фильтрование через бумажный фильтр |
2.2 Особенности различных видов
титриметрического анализа
Титриметрический (объемный) анализ среди химических методов занимает одно из лидирующих положений по совокупности свойств: доступности (вместо аналитических весов можно использовать фиксанал или стандарт-титр, из аналитической посуды основное — это бюретка).
Титриметрический анализ (титриметрия) — метод количественного анализа, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом, концентрация которого неизвестна или известна неточно.
Другими словами, титриметрический анализ является одним из методов количественного анализа, в котором количество вещества определяют путем точного измерения объема раствора реагента (титранта), вступившего в химическую реакцию с
определяемым веществом (титруемым веществом).
Основной закон титриметрии: вещества реагируют между собой в равных количествах при выражении количества вещества через молярные концентрации эквивалента:
Cэ1V1 = Cэ2V2, (2.1)
где Cэ1 – молярная концентрация эквивалента раствора определяемого вещества,
Cэ2 – молярная концентрация эквивалента титранта,
V1 – объем раствора определяемого вещества,
V2 – объем раствора титранта.
Концентрация раствора реагента должна быть точно известна. Раствор реагента с точно известной концентрацией называют стандартным раствором. Различают первичные и вторичные стандарты. Первичные стандарты получают растворением точной
навески реагента и разбавлением полученного раствора до определенного объема.
Первичные стандарты (стандартные растворы) должны удовлетворять ряду требований: 1) быть химически чистыми, 2) строго отвечать химической формуле, 3) быть устойчивыми как в твердом виде, так и в растворе.
Концентрацию вторичных стандартов, которые также называют стандартизированными растворами, устанавливают титрованием подходящими первичными стандартами.
Титрованием называют процесс постепенного добавления из бюретки раствора реагента в титруемый раствор до того момента, пока его количество не станет равным количеству реагирующего с ним определяемого вещества (до достижения точки стехиометричности или точки эквивалентности).
Для определения этого момента в исследуемый раствор обычно добавляют индикатор, который изменяет окраску при состояния системы, очень близком к точке стехиометричности. Изменение окраски индикатора свидетельствует о необходимости прекратить титрование. Момент прекращения титрования называют точкой конца титрования. Концентрации веществ в точке конца титрования и в точке эквивалентности очень близки, но не равны, что зависит от области перехода индикатора. Интервал перехода окраски индикаторов должен лежать внутри скачка титрования.
Индикаторы - химические, вещества, введение которых в анализируемый раствор позволяет установить точку эквивалентности по легко заметному признаку (изменению цвета) при титровании из бюретки (рис. 2.4.).

Рис. 2.4. Титрование из бюретки
Индикаторы химические делят обычно на 5 групп: кислотно-основные; окислительно-восстановительные; комплексонометрические; адсорб-ционные; хемилюминесцентные.
Кислотно-основные индикаторы — вещества, изменяющие свою окраску при изменении водородного показателя(pH) среды. Эти индикаторы химические, рассматриваемые (по теории В. Оствальда) как слабые органические кислоты или основания.
При проведении анализа индикатор выбирают таким образом, чтобы интервал перехода окраски индикатора включал то значение pH, которое раствор должен иметь в точке эквивалентности. В таблице 2.1 Приведены распространённые в лабораторной практике ислотно-основные индикаторы в порядке возрастания значений pH, вызывающих изменение окраски. Римские цифры в квадратных скобках отвечают номеру перехода окраски (для индикаторов с несколькими точками перехода).
Часто используют комбинированные индикаторы, состоящие из нескольких, индикаторов. Например, в составе индикатора Ташира: смесь метилового красного (0,1 % в воде) и метиленового синего (0,1% в этаноле). При значениях рН раствора, меньших 4,0, цвет этого индикатора фиолетовый, а при значениях, больших 6,0 - зеленый.
Титриметрический анализ может быть основан на различных типах химических реакций:
- кислотно-основное титрование — реакции нейтрализации (ацидиметрия (H3O+), алкалиметрия (OH-));
- окислительно-восстановительное титрование (перманганатометрия (KMnO4), иодометрия (I2), хроматометрия (K2Cr2O7), броматометрия (KBrO3)— ОВ- реакции;
- осадительное титрование (аргентометрия (AgNO3), меркурометрия (Hg2(NO3)2)) — реакции, протекающие с образованием малорастворимого соединения, при этом изменяются концентрации осаждаемых ионов в растворе;
- комплексонометрическое титрование — реакции, основанные на образовании прочных комплексных соединений, например, с комплексоном (обычно ЭДТА), при этом изменяются концентрации ионов металлов в титруемом растворе.
Таблица 2.1. Значения рН перехода некоторых индикаторов
| Индикатор и номер перехода | х [3] | Цвет более | Интервал pH и номер перехода | Цвет более | ||
| Малахитовый зелёный | жёлтый | 0,1-2,0 [l] | сине-зелёный | |||
| Метиловый фиолетовый | жёлтый | 0,13–0,5 [I] | зелёный | |||
| Крезоловый красный [I] | красный | 0,2–1,8 [I] | жёлтый | |||
| Метиловый фиолетовый [II] | зелёный | 1,0–1,5 [II] | синий | |||
| Тимоловый синий [I] | к | красный | 1,2–2,8 [I] | жёлтый | ||
| Тропеолин 00 | o | красный | 1,3–3,2 | жёлтый | ||
| Метиловый фиолетовый [III] | синий | 2,0–3,0 [III] | фиолетовый | |||
| (Ди)метиловый жёлтый | o | красный | 3,0–4,0 | жёлтый | ||
| Бромфеноловый синий | к | жёлтый | 3,0–4,6 | сине-фиолетовый | ||
| Конго красный | синий | 3,0–5,2 | к | красный | ||
| Метиловый оранжевый | o | красный | 3,1–(4,0)4,4 | (оранжево-)жёлтый | ||
| Бромкрезоловый зелёный | к | жёлтый | 3,8–5,4 | синий | ||
| Бромкрезоловый синий | жёлтый | 3,8–5,4 | синий | |||
| Лакмоид | к | красный | 4,0–6,4 | синий | ||
| Метиловый красный | o | красный | 4,2(4,4)–6,2(6,3) | жёлтый | ||
| Хлорфеноловый красный | к | жёлтый | 5,0–6,6 | красный | ||
| Лакмус (азолитмин) | красный | 5,0–8,0 (4,5-8,3) | синий | |||
| Бромкрезоловый пурпурный | к | жёлтый | 5,2–6,8(6,7) | фиолетовый | ||
| Бромтимоловый синий | к | жёлтый | 6,0–7,6 | синий | ||
| Феноловый красный | о | жёлтый | 6,8–(8,0)8,4 | ярко-красный | ||
| Крезоловый красный [II] | к | жёлтый | 7,0(7,2)–8,8 [II] | тёмно-красный | ||
| α-Нафтолфталеин | к | жёлто-розовый | 7,3–8,7 | синий | ||
| Тимоловый синий [II] | к | жёлтый | 8,0–9,6 [II] | синий | ||
| Фенолфталеин[4] [I] | к | бесцветный | 8,2–10,0 [I] | малиново-красный | ||
| Нильский голубой | синий | 10,1–11,1 | красный | |||
| Диазофиолетовый | жёлтый | 10,1–12,0 | фиолетовый | |||
| Малахитовый зелёный | сине-зелёный | 11,6-13,6 [ll] | бесцветный | |||
| Индигокармин | синий | 11,6–14,0 | жёлтый | |||
2.2.1 Кислотно-основное титрование, основанное на реакции нейтрализации
В основе метода лежит реакция нейтрализации – соединение ионов водорода и гидроксид-ионов с образованием малодиссоциирующих молекул воды. Этим методом, пользуясь титрованными растворами щелочей, определяют количество или концентрацию растворов кислот. С помощью растворов кислот находят концентрацию оснований. Метод пригоден также для определения содержания солей, гидролизующихся в растворе с образованием кислотной или щелочной среды.
Точку эквивалентности в методе нейтрализации определяют при помощи индикаторов. Наиболее часто применяют следующие индикаторы: метиловый оранжевый, метиловый красный, лакмус и фенолфталеин. Поведение их в растворе объясняет ионная теория индикаторов, предложенная В. Оствальдом в 1894 году. Согласно этой теории, индикаторы – это слабые органические кислоты или слабые органические основания, у которых недиссоциированные молекулы имеют одну окраску, а образуемые ими ионы – другую. Например, если обозначить молекулу фенолфталеина через HJnd, а анион через Jnd‾ , то уравнение диссоциации будет иметь следующий вид:
HJnd 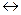 H+ + Jnd‾
H+ + Jnd‾
бесцветный малиновый
В щелочном растворе процесс диссоциации индикатора смещается в сторону образования ионов индикатора, и раствор индикатора имеет малиновый цвет. В кислой среде равновесие смещается в сторону обратной реакции, т.е. индикатор будет находиться в виде недиссоциированных молекул и раствор индикатора бесцветный. Аналогичным образом можно объяснить поведение лакмуса, молекулы которого окрашены в красный цвет, а анионы – в синий.
Прибавление к любому раствору раствора кислоты или щелочи влечет за собой изменение концентрации ионов водорода в нем, а, следовательно, и рН раствора.
Каждый индикатор изменяет окраску в определенном, характерном только для него интервале значений рН (табл. 2.2.). Интервал значений рН, в пределах которого индикатор изменяет свою окраску, называется областью перехода индикатора (рН). В ходе титрования раствор приливают до отчетливого изменения окраски индикатора. Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение рН, лежащее внутри области перехода индикатора. Значение рН, при котором заканчивается титрование с данным индикатором, называется показателем титрования индикатора (рТ).
Таблица 2.2. Характеристика некоторых индикаторов,
применяемых в методе кислотно-основного титрования
| Название индикатора | Окраска индикатора | Область перехода, рН | Показатель титрования рТ | |
| недиссоц. молекул | анионов | |||
| Метиловый оранжевый | красная | жёлтая | 3,1 – 4,4 | 4,0 |
| Метиловый красный | красная | жёлтая | 4,4 – 6,2 | 5,5 |
| Лакмус | красная | синяя | 5,0 – 8,0 | 7,0 |
| Фенолфталеин | бесцветная | малиновая | 8,0 – 10,0 | 9,0 |
При взаимодействии эквивалентных количеств кислоты и щелочи не всегда полученный раствор будет иметь строго нейтральную среду. Величина рН раствора в точке эквивалентности зависит от природы титруемых кислот и оснований. Если основание и кислота сильные, то точка эквивалентности будет совпадать с точкой нейтрализации.
Например: NaOH + HCI = NaCI + Н2О
Если основание слабое, а кислота сильная, то точка эквивалентности будет в кислой среде.
Например: NH4OH + НС1 = NH4C1 + Н2О
Если основание сильное, а кислота слабая, то титрование заканчивается в щелочной среде.
Например: NaOH + СН3СООН = CH3COONa + Н2О
Основное требование при выборе индикатора заключается в том, чтобы показатель титрования его находился по возможности ближе к рН раствора в точке эквивалентности. Например, при титровании сильной кислоты сильным основанием наиболее точные результаты будут при использовании лакмуса. При титровании слабого основания сильной кислотой - метилового оранжевого и метилового красного, при титровании слабой кислоты сильным основанием - фенолфталеина.
2.2.1.1 Приготовление рабочего раствора соляной кислоты
Хлороводород (соляная кислота) не отвечает требованиям к установочным веществам, поэтому её растворы готовят стандартизованными.
Для выполнения работы необходимы технические и аналитические весы, ареометр.
Основные химическая посуда, реактивы:
Мерные колбы на 200 и 500 мл для приготовления растворов; солевая воронка; колбы Эрленмейера на 100 мл для титрования; бюретка на 20 или 25 мл в штативе с бюреточной воронкой; химические стаканы для взвешивания буры и слива из бюретки; концентрированный раствор НСl – 15-20%; бура (Na2B4О7 ·10Н2О) категории х.ч.
Ход работы:
Измерить ареометром плотность концентрированного раствора HCl. Исходя из плотности раствора HCl, по справочным таблицам определить молярную концентрацию С и массовую долю 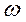 HCl. Рассчитать объем концентрированного раствора HCl, необходимый для приготовления 500 мл HCl с Сэ = 0,05 моль/л.
HCl. Рассчитать объем концентрированного раствора HCl, необходимый для приготовления 500 мл HCl с Сэ = 0,05 моль/л.
Пример расчета.
 |
V1(HCl) = 500 мл По плотности раствора HCl
Сэ1 (HCl) = 0,1 моль/л в справочных таблицах
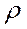 2(HCl) = 1,10 г/мл находим:
2(HCl) = 1,10 г/мл находим:

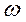 2(HCl) = 20,39 %
2(HCl) = 20,39 %
V2 (NaOH) = ? С2 (HCl) = 6,15 моль/л
Расчет необходимого объема концентрированного раствора HCl можно проводить 2 методами, используя или массовую долю исходного раствора HCl, или его эквивалентную концентрацию.
Находим массу вещества HCl, содержащуюся в 500 мл 0,1 н раствора:
m ( HCl ) = Сэ 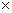 V
V 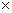 Мэ ; (2.2)
Мэ ; (2.2)
m (HCl) = 0,1 моль/л 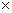 0,5 л
0,5 л 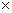 36,5 г/моль = 1,825 г ;
36,5 г/моль = 1,825 г ;
Рассчитаем, в каком объеме раствора HCl 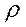 2(HCl) = 1,10 г/мл содержится 1,825 г соляной кислоты:
2(HCl) = 1,10 г/мл содержится 1,825 г соляной кислоты:
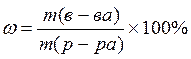 (2.3) m (р-ра) = V
(2.3) m (р-ра) = V 
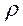 , г (2.4)
, г (2.4)
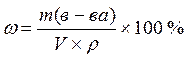 (2.5)
(2.5) 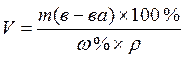 , мл (2.6)
, мл (2.6)
По формуле 2.6 вычисляем:
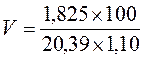 = 8,1 мл
= 8,1 мл
Отмерив цилиндром вычисленный объем концентрированного раствора HCl, переносим его в мерную колбу вместимостью 500 мл и разбавляем дистиллированной водой до метки. Полученный раствор перелить в склянку на 500 мл и тщательно перемешать.
2.2.1.2 Приготовление стандартного раствора
тетрабората натрия
В качестве установочного вещества для определения титра кислоты используют тетраборат натрия Na2B4О7 ·10Н2О, безводный карбонат натрия Na2СО3 , йодат калия KJO3. Наиболее удобен тетработат натрия, так как путем перекристаллизации при 60°С и высушивании на воздухе эту соль легко получить химически чистой, точно соответствующей формуле Na2B4О7 ·10Н2О.
Na2B4О7 + 2 HCl + 5 Н2О = 4 Н3ВО3 + 2 NaCl
f э (Na2B4О7) = ½; М (Na2B4О7 ·10Н2О) = 381,4 г/моль;
Мэ (Na2B4О7 ·10Н2О) = 190,7 г/моль.
Пример расчета.
Рассчитать массу навески Na2B4О7·10Н2О для приготовления 200 мл раствора с Сэ = 0,1 моль/л.
 |
V (Na2B4О7 ·10Н2О) = 200 мл М (Na2B4О7 ·10Н2О) = 381,4 г/моль
Сэ (Na2B4О7 ·10Н2О) = 0,1 моль/л
 fэ(Na2B4О7 ·10Н2О) = ½
fэ(Na2B4О7 ·10Н2О) = ½
m (Na2B4О7 ·10Н2О) = ? Мэ (Na2B4О7 ·10Н2О) = 190,7 г/моль
m (Na2B4О7 ·10Н2О) = Сэ × V × Мэ (2.7)
m (Na2B4О7 ·10Н2О) = 0,1 × 0,2 × 190,7 = 3,814 г.
Рассчитать массу навески Na2B4О7 ·10Н2О для приготовления 200 мл раствора с Сэ = 0,05 моль/л.
Для приготовления раствора тетрабората натрия необходимо взвесить рассчитанную навеску соли.
Таблица 3. Результаты взвешивания.
| Масса пустого стаканчика на технических весах (г) | Масса стаканчика с навеской на технических весах (г) | Масса стаканчика с навеской на аналитических весах (г) | Масса стаканчика с остатками навески на аналитических весах (г) | Точная масса навески (г) |
| 1 | 2 | 3 | 4 | 5 |
| Масса пустого стаканчика + масса рассчитанной навески = | (из 3 – 4) |
1. Взвесить пустой стаканчик на технических весах.
2. Взвесить стаканчик с навеской на технических весах.
3. Взвесить стаканчик с навеской на аналитических весах.
4. Перенести навеску с помощью солевой воронки из стаканчика в мерную колбу на 200 мл.
5. Взвесить стаканчик с остатками навески на аналитических весах.








