Вопросы для контроля знаний.
1. Какие способы фиксирования конечной точки титрования можно ис- пользовать при выполнении лабораторных работ по окислительно-восстановительному титрованию?
2. Приведите примеры первичных и вторичных стандартных растворов в перманганатометрии, укажите их факторы эквивалентности и напишите соответствующие полуреакции.
3. Приведите примеры вспомогательных растворов в перманганатометрии и иодометрии, укажите их роль.
4. Приведите примеры первичных и вторичных стандартных растворов в иодометрии, укажите их факторы эквивалентности и напишите соответствующие полуреакции.
5. Приведите примеры вспомогательных растворов в иодометрии, укажите их роль.
6. Почему при проведении иодометрических определений необходимо избегать действия света и температуры?
7. Как определяют фактор эквивалентности и молярную массу эквивалента в окислительно-восстановительном титровании?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Основная литература
1. Аналитическая химия [Электронный ресурс]: учебное пособие/ А.И. Апарнев [и др.].— Электрон. текстовые данные.— Новосибирск: Новосибирский государственный технический университет, 2011.— 104 c.— Режим доступа: http://www.iprbookshop.ru/44656.
2. Аналитическая химия [Электронный ресурс]: учебное пособие/ О.Б. Кукина [и др.].— Электрон. текстовые данные.— Воронеж: Воронежский государственный архитектурно-строительный университет, ЭБС АСВ, 2014.— 162 c.— Режим доступа: http://www.iprbookshop.ru/30833.
3. Егорова, О.А. Основы качественного и количественного анализа [Электронный ресурс]: конспект лекций/ Егорова О.А.— Электрон. текстовые данные.— М.: Российский университет дружбы народов, 2013.— 144 c.— Режим доступа: http://www.iprbookshop.ru/22231.
Дополнительная литература
1. Мельникова, М.А. Практикум по общей и аналитической химии : учеб. пособие/ М.А. Мельникова; АмГУ, ИФФ. – Благовещенск: Изд-во
Амур. гос. ун-та, 2008. – 128 с.
2. Васильев, В. П. Аналитическая химия: учеб.: рек. Мин. обр. РФ. Кн. 1 :
/ В.П. Васильев. – М.: Дрофа, 2009. – 368 с.
3. Васильев, В. П. Аналитическая химия: учеб.: рек. Мин. обр. РФ. Кн. 2:
Физико-химические методы анализа / В.П. Васильев. – М.: Дрофа,
2009. – 384 с.
4. Харитонов, Юрий Яковлевич. Аналитическая химия (аналитика): В 2 кн.: учеб. для вузов: рек. Мин. обр. РФ. Кн. 1: Общие теоретические основы. Качественный анализ, 2003. – 616 с.
5. Трифонова, А.Н. Аналитическая химия [Электронный ресурс] / А.Н.
Трифонова, И.В. Мельситова. – Минск: Вышэйшая школа, 2013. – 160 с.
6. Лурье, Ю. Ю. Справочник по аналитической химии [Текст] / Ю. Ю. Лурье. - 6-е изд., перераб. и доп. – М. : Химия, 1989. – 448 с. – Предм. указ.: с. 436-447.
7. Алыкова, Т.В. Аналитическая химия объектов окружающей среды. Лабораторные работы. Вопросы. Задачи [Текст] / Т.В. Алыкова. – М.: Кнорус, 2016. – 196 с.
8. Аналитическая химия [Электронный ресурс]: сборник лабораторных работ для студентов технических направлений дневной и заочной форм обучения / – Электрон. текстовые данные. – Новосибирск: Новосибирский государственный технический университет, 2014. – 62 c. – Режим доступа: http://www.iprbookshop.ru/45072.
9. Попова, Л.Ф. Аналитическая химия с основами физико-химического анализа. Лабораторный практикум. Учебно-методическое пособие.
[Электронный ресурс] / Попова Л.Ф. – Архангельск, 2014. – 114 с.
10. Коваленко, И.А., Супиченко, Г.Н. Аналитическая химия. Лабораторный практикум. [Электронный ресурс] / Ступиченко Г.Н. – Минск:
БГТУ, 2005. – 90 с.
11. Алемасова, А.С., Енальева, Л.Я. Лекции по аналитической химии. Уч. пособие. [Электронный ресурс] / Алемасова А.С., Енальева Л.Я. – Донецк: ДонНУ, 2007. – 284 с.
12. Аналитическая химия [Электронный ресурс]: сборник лабораторных работ для студентов технических направлений дневной и заочной форм обучения / — Электрон. текстовые данные.— Новосибирск: Новосибирский государственный технический университет, 2014.— 62 c.— Режим доступа: http://www.iprbookshop.ru/45072.
13. Кудряшова, А.А. Химические реакции в аналитической химии с примерами и задачами для самостоятельного решения [Электронный ресурс]: учебное пособие / Кудряшова А.А.— Электрон. текстовые данные.— Самара: РЕАВИЗ, 2011.— 75 c.— Режим доступа:
http://www.iprbookshop.ru/10157. — ЭБС «IPRbooks»
14. Сизова, Л.С. Аналитическая химия. Титриметрический и гравиметрический методы анализа [Электронный ресурс]: учебное пособие / Сизова Л.С., Гуськова В.П. – Электрон. текстовые данные. – Кемерово: Кемеровский технологический институт пищевой промышленности, 2006. – 132 c. – Режим доступа: http://www.iprbookshop.ru/14355. – ЭБС
«IPRbooks»
15. Егорова, О.А. Основы качественного и количественного анализа [Электронный ресурс]: конспект лекций / Егорова О.А. – Электрон. текстовые данные. – М.: Российский университет дружбы народов,
2013. – 144 c. – Режим доступа: http://www.iprbookshop.ru/22231. – ЭБС
«IPRbooks»
16. Соколовский, А. Е. Аналитическая химия. Лабораторный практикум: учеб.-метод. пособие по дисциплинам «Аналитическая химия» и «Аналитическая химия и физико-химические методы анализа» для студентов химико-технологических специальностей / А. Е. Соколовский [и др.]. – Минск: БГТУ, 2012. – с. 106.
ПРИЛОЖЕНИЕ 1
ОСНОВНЫЕ ПРАВИЛА БЕЗОПАСНОСТИ И РАБОТЫ В ХИМИЧЕСКОЙ
ЛАБОРАТОРИИ
При выполнении лабораторных работ по аналитической химии используются концентрированные кислоты, щелочи, щелочные металлы, токсичные органические вещества. При небрежном отношении к работе возможны несчастные случаи, попадание опасных веществ в глаза, на кожу, ожоги, возникновение пожаров. При работе в химической лаборатории необходимо строго соблюдать требования техники безопасности. Студенты несут ответственность за соблюдение правил поведения в химической лаборатории, техники безопасности при работе с химическими реактивами, посудой, оборудованием.
Все студенты обязаны выполнять общие правила поведения в химической лаборатории.
В химической лаборатории нельзя находиться в верхней одежде. Студенты должны работать в халатах, волосы должны быть убраны. Во время работы в лаборатории соблюдать чистоту, тишину и порядок, не отвлекать и не мешать выполнять работу другим студентам. Студенты могут находиться в лаборатории только с разрешения преподавателя или лаборанта. Не допускается присутствие в лабораториях посторонних лиц во время проведения работ.
Рабочее место должно содержаться в чистоте и порядке, его не следует загромождать бумагами, посудой и реактивами. Запрещается класть на рабочие столы одежду, вещи, сумки и любые посторонние предметы. Нельзя загромождать проходы между рабочими столами. В лаборатории запрещается принимать пищу и напитки, курить.
Категорически запрещается пробовать химические реактивы на вкус. Запах соединений определяют, осторожно направляя его пары легким движением руки. Нельзя подносить сосуд к носу и делать глубокий вдох.
Нельзя заглядывать в склянки и бутылки сверху, все наблюдения необходимо вести через боковую стенку сосуда. Необходимо следить, чтобы химические реактивы не попали на одежду, кожу. Во время работы нельзя подносить руки к лицу, глазам, волосам. Перед проведением каждой операции необходимо убедиться в исправности посуды и оборудования, правильном выборе химических реактивов. Лабораторные работы выполняются по два человека. Запрещается выполнять химический эксперимент одному.
Перед началом работы в химических лабораториях работающие должны изучить методику выполнения лабораторной работы, инструкции к приборам, последовательность выполнения операций. Прослушать текущий инструктаж преподавателя по проведению лабораторной работы.
Во время работы студенты должны соблюдать общие правила поведения и работы в химических лабораториях, выполнять требования техники Продолжение приложения 1
безопасности при работе со щелочными металлами, кислотами и щелочами, нагревательными приборами, стеклянной посудой; меры противопожарной безопасности.
1. Использовать химические реактивы, указанные в лабораторной работе, обращая внимание на формулы веществ, их концентрации и последователь- ность использования. Запрещается пользоваться реактивами без этикеток или с сомнительными надписями на них.
2. Часть реактивов находится на рабочих столах студентов. Это неопасные вещества, не обладающие токсичным действием – растворы кислот, оснований, солей, твердые соли, простые вещества, индикаторы. Вещества, представляющие опасность находятся в вытяжном шкафу – концентрированные кислоты и щелочи, раствор брома воде, щелочные металлы, горючие или токсичные вещества.
3. Реактивы, находящиеся в вытяжном шкафу нельзя переносить на рабочее место. Все работы с ними необходимо проводить только в вытяжном шкафу. Возле вытяжного шкафа не следует создавать толчею, мешать друг другу.
4. Реактивы сразу после использования закрывать теми же пробками, сразу ставить на место. Передавать реактивы можно только в закрытом состоянии. Запрещается ходить с реактивами по аудитории.
5. Перед помещением реактивов в пробирку необходимо убедиться в ее чистоте и целостности. Нельзя использовать загрязненную или треснутую посуду.
6. Необходимый объем растворов измеряется мерными пробирками, пипетками или другой мерной посудой. Лишнее количество реактивов нельзя выливать обратно в склянку. Нельзя засасывать реактивы в пипетку ртом, нужно пользоваться резиновой грушей или дозатором.
7. При работе с кислотами следует наливать кислоту в воду. Запрещается наливать воду в кислоту, так как может произойти выброс кислоты вследствие сильного разогревания смеси.
8. При работе со щелочными металлами необходимо соблюдать особую осторожность, не допуская их соприкосновения с водой. Вынимать металлический натрий и калий следует только сухим пинцетом. Щелочные металлы нельзя брать руками. Керосин с поверхности кусочков металла удаляют фильтровальной бумагой. В реакции используют кусочки не больше горошины. Нельзя наклоняться над стаканом во время реакции.
9. Категорически запрещается выбрасывать остатки щелочных металлов в канализацию, урну.
10. В качестве нагревательных приборов используют электрические плитки с закрытой спиралью; водяные бани; спиртовки.
11. Перед зажиганием спиртовки следует убедиться, что она исправна, фитиль вытащен на нужную высоту, а горловина и держатель фитиля сухие. Ес Продолжение приложения 1
ли спиртом смочен держатель фитиля и горловина спиртовки, при зажигании может произойти взрыв паров внутри.
12. Спиртовку можно зажигать только спичками, запрещается зажигать одну спиртовку от другой. Гасить спиртовку можно только одним способом – накрывать пламя фитиля колпачком. Нельзя задувать пламя, так как при этом
может произойти небольшой взрыв смеси паров спирта с воздухом и горящий спирт выбросится в лицо.
13. Горящую спиртовку нельзя наклонять, перемещать, ходить с ней по аудитории во избежание разлива и загорания спирта.
14. Пробирки, используемые для нагревания должны быть чистыми, сухими и целыми. Пробирка не должна быть наполнена содержимым более чем на треть.
15. Пробирку закрепляют в держалке в верхней части пробирки. Пробирку с содержимым предварительно прогревают во избежание ее растрескивания. Отверстие пробирки при нагревании должно быть направлено в сторону от всех работающих.
По окончании работы необходимо:
1. Проверить и привести в порядок рабочее место, приборы и аппараты, вымыть руки.
2. Грязную посуду складывают на специальные противни. Не следует оставлять грязную посуду на рабочем столе.
3. Содержимое пробирок после лабораторной работы сливают в специально отведенные емкости. Нельзя выливать химические реактивы в канализацию.
При возникновении очага возгорания необходимо немедленно сообщить об этом преподавателю.
При загорании твердых горючих веществ (мебель, пол, стены и т. д.) в качестве средств пожаротушения применяют песок, накидки из толстой ткани, огнетушители пенные и порошковые, воду. При возгорании ЛВЖ и ГЖ (спирт, бензол, и др.) применяют песок, накидки, любые огнетушители. Для тушения щелочных и щелочноземельных металлов используют сухой песок или порошковые огнетушители. Применять воду, пенные и углекислотные огнетушители нельзя. Для тушения электроприборов, находящихся под напряжением, применяют накидки, песок, порошковые и углекислотные огнетушители. Нельзя тушить водой и пенными огнетушителями.
При ожогах химическими веществами, особенно кислотами и щелочами, пораженный участок кожи быстро промывают большим количеством воды, затем на обожженное место накладывают примочку: при ожогах кислотой – из 2%-ного раствора питьевой соды, при ожогах щелочью – из слабого
1–2%-ного раствора уксусной кислоты.
Продолжение приложения 1
При попадании брызг кислоты в глаза, их немедленно нужно промыть большим количеством воды и затем 3%-ным раствором питьевой соды. После этого пострадавшего необходимо немедленно доставить в медпункт.
При порезах рук стеклом необходимо удалить из раны мелкие осколки, затем промыть раны 2%-ным раствором перманганата калия или спиртом и, смазав йодной настойкой, забинтовать.
При воспламенении одежды необходимо загасить огонь на горящем (не бегать!), набросив на него одеяло, халат, пальто и т.д. Погасив огонь, приступить к оказанию первой помощи.
Ядовитые вещества могут попасть в организм через пищеварительный тракт, дыхательные пути, иногда через кожу и слизистые оболочки. При всех случаях отравления необходимо доставить пострадавшего в медпункт или вызвать скорую помощь.
ПРИЛОЖЕНИЕ 2
Таблица 1 Точность измерения основных величин и правила записи результатов измерения*
| Измеряемая величина | Средство измерения | Пример записи | Точность измерения |
| V, мл (при использовании точной мерной посуды) | Пипетка Бюретка Мерная колба | 25,00 мл 12,45 мл 100,0 мл | 0,05 мл 0,1 мл |
| V, мл (при использовании мерной посуды с ориентировочными делениями) | Мерный стакан Мерный цилиндр Мензурка | 200 мл 15 мл 30 мл | 1 мл |
| m, г | Технические весы | 0,10 г | 0,01 г |
| Аналитические весы | 0,1023 г | 0,0001 г |
Таблица 2 Точность расчета величин*
| Рассчитываемая величина | Точность расчета | Пример записи |
| m, г | 0,0001 г | 0,1200 г |
| V, мл | 0,05 мл | 12,35 мл |
| , %, , [доли ед.] | 0,01 % | 8,65 % 0,0865 |
| 0,0001 | ||
| Атомная масса, молярная масса, г/моль | С точностью, указанной в таблице Д. И. Менделеева | 126,033 г/моль |
| С, моль/л | 4 значащие цифры (цифры, начиная с первой ненулевой) | 0,1025 М 0,09168 г/л 0,005286 г/мл 6,728 ммоль |
| *, г/л | ||
| Т, Т(А/В), г/мл | ||
| n, моль, ммоль |
* А. Е. Соколовский, Н. Ф. Шакуро, А. К. Болвако, Е. В. Радион. Аналитическая химия. Лабораторный практикум : учеб.-метод. пособие по дисциплинам «Аналитическая химия» и «Аналитическая химия и физико-химические методы анализа» для студентов химико-технологических специальностей / А. Е. Соколовский [и др.]. – Минск: БГТУ, 2012. – с. 106.
ПРИЛОЖЕНИЕ 3
ФАРФОРОВАЯ ПОСУДА

ПРИЛОЖЕНИЕ 4
СТЕКЛЯННАЯ ПОСУДА
ПРИЛОЖЕНИЕ 5
ПОСУДА И ОБОРУДОВАНИЕ ОБЩЕГО И
СПЕЦИАЛЬНОГО НАЗНАЧЕНИЯ
ПРИЛОЖЕНИЕ 6

ПРИЛОЖЕНИЕ 7
КРИВАЯ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
(титрование сильной кислоты сильным основанием)
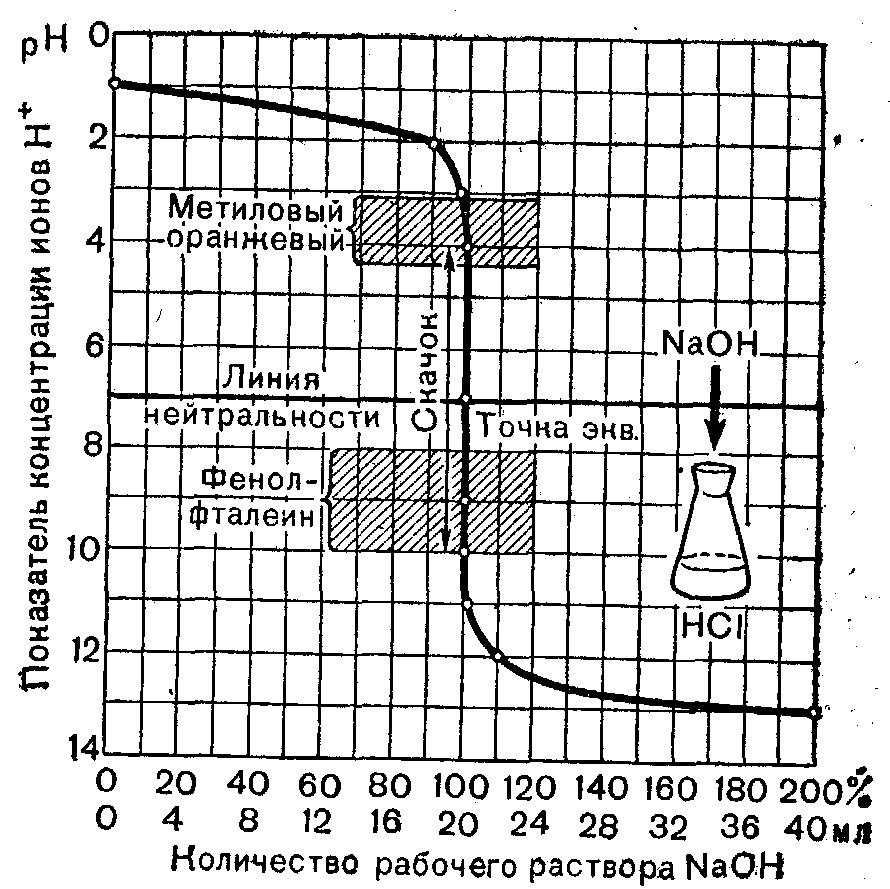
ПРИЛОЖЕНИЕ 8
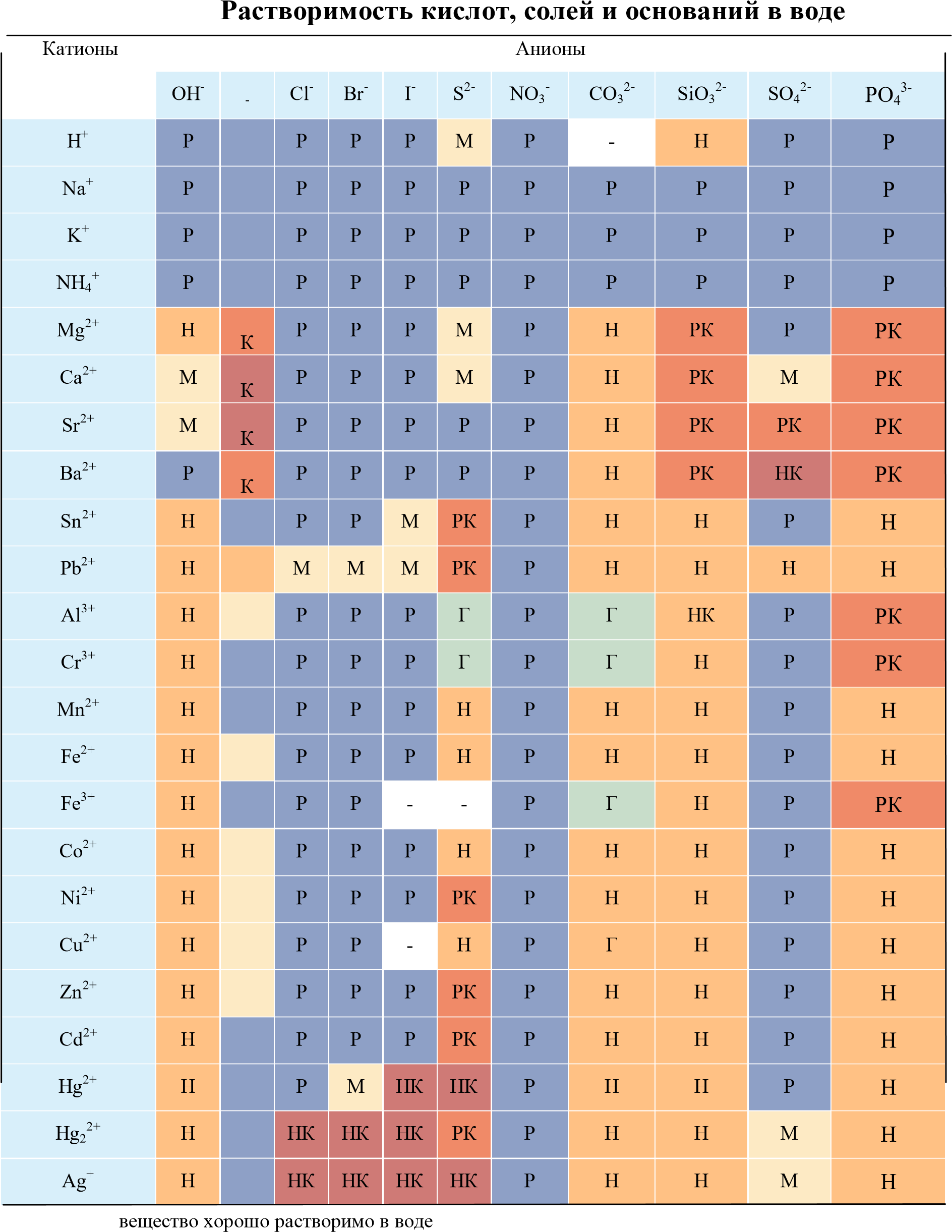
малорастворимо практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах
| Р |
| М |
| Н |
| РК |
| НК |
| Г |
нерастворимо в воде и растворяется только в сильных неорганических кислотах нерастворимо ни в воде, ни в кислотах
полностью гидролизуется при растворении и не существует в контакте с водой - вещество вообще не существует
ПРИЛОЖЕНИЕ 9
ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ ТРУДНОРАСТВОРИМЫХ
ВЕЩЕСТВ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ
| Вещество | ПР | Вещество | ПР |
| AgBr | 5,3•10–13 | FeS | 5,0•10–18 |
| AgCN | 1,4•10–16 | HgS | 1,6•10–52 |
| AgSCN | 1,0•10–12 | Hg2Cl2 | 1,3•10–18 |
| AgCl | 1,78•10–10 | Mg(OH)2 | 7,1•10–12 |
| Ag2CO3 | 1,2•10–12 | MgS | 2,0•10–15 |
| Ag2CrO4 | 1,1•10–12 | Mn(OH)2 | 1,9•10–13 |
| Ag2Cr2O7 | 1,0•10–10 | MnS | 2,5•10–10 |
| AgI | 8,3•10–17 | NiCO3 | 1,3•10–7 |
| Ag3PO4 | 1,3•10–20 | Ni(OH)2 | 2,0•10–15 |
| A1(OH)3 | 3,2•10–34 | PbCO3 | 7,5•10–14 |
| ВаСО3 | 4,0•10–10 | PbCl2 | 1,6•10–5 |
| BaC2O4 | 1,1•10–7 | PbCrO4 | 1,8•10–14 |
| ВаСгО4 | 1,2•10–10 | РbI2 | 1,1•10–9 |
| BaSO4 | 1,1•10–10 | Pb(OH)2 | 7,9•10–16 |
| СаСО3 | 3,8•10–9 | PbS | 2,5•10–27 |
| СаС2О4 | 2,3•10–9 | PbSO4 | 1,6•10–8 |
| CaSO4 | 2,5•10–5 | Sb2S3 | 1,0•10–30 |
| CdS | 1,6•10–28 | H2SiO3 | 1,0•10–10 |
| Сг(ОН)3 | 6,3•10–31 | SnS | 2,5•10–27 |
| Сu(ОН)2 | 8,3•10–20 | SrCO3 | 1,1•10–10 |
| CuS | 6,3•10–36 | SrC2O4 | 1,6•10–7 |
| FeCO3 | 3,5•10–11 | SrSO4 | 3,2•10–7 |
| Fe(OH)2 | 7,1•10–16 | Zn(OH)2 | 1,4•10–17 |
| Fe(OH)3 | 6,3•10–38 | ZnS | 8,0•10–26 |
ПРИЛОЖЕНИЕ 10
СТАНДАРТНЫЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ ПРИ 25 0С
| Окисленная форма | Восстановленная форма | Уравнение реакции | φо, В |
| Li+ | Li (тв) | Li+ + ē ⇄ Li | –3,02 |
| К+ | К (тв) | K+ + ē ⇄ K | –2,92 |
| Ва2+ | Ва (тв) | Ba2++2ē ⇄ Ba | –2,90 |
| Sr2+ | Sr (тв) | Sr2+ + 2ē ⇄ Sr | –2,89 |
| Са2+ | Са (тв) | Ca2+ + 2ē ⇄ Ca | –2,87 |
| Na+ | Nа (тв) | Na+ + ē ⇄ Na | –2,71 |
| Mg2+ | Mg (тв) | Mg2+ + 2ē ⇄ Mg | –2,34 |
| А13+ | Al (тв) | Al3+ + 3ē ⇄ Al | –1,67 |
| Мn2+ | Мn (тв) | Mn2+ + 2ē ⇄ Mn | –1,05 |
| SO42– | SO32– | SO42– + H2O +2 ē ⇄ SO32– + 2OH– | –0,90 |
| NO3– | NO2 (г) | NO3– + H2O + ē ⇄ NO2 + 2OH– | –0,85 |
| Zn2+ | Zn (тв) | Zn2+ + 2ē ⇄ Zn | –0,76 |
| Cr3+ | Сг (тв) | Сг3+ + 3ē ⇄ Сг | –0,71 |
| AsO43– | AsO2– | AsO43– + 2Н2O + 2ē ⇄ АsО2– + 4OH– | –0,71 |
| Fe(OH)3 | Fе(ОН)2 (тв) | Fe(OH)3 + ē ⇄ Fe(OH)2 + OH– | –0,56 |
| Fe2+ | Fе (тв) | Fe2+ + 2ē ⇄ Fe | –0,44 |
| Cd2+ | Cd (тв) | Cd2+ + 2ē ⇄ Cd | –0,40 |
| Co2+ | Со (тв) | Co2+ + 2ē ⇄ Co | –0,28 |
| Ni2+ | Ni (тв) | Ni2+ + 2ē ⇄ Ni | –0,25 |
| NO3– | NO (г) | NO3– + 2H2O + 3ē ⇄ NO + 4OH– | –0,14 |
| Sn2+ | Sn (тв) | Sn2+ + 2ē ⇄ Sn | –0,14 |
| Pb2+ | Рb (тв) | Pb2+ + 2ē ⇄ Pb | –0,13 |
| CrO42– | Cr(OH)3 | CrO42– + 4H2O + 2ē ⇄ Cr(OH)3 + 5OH– | –0,12 |
| 2H+ | H2 | 2Н+ + 2ē ⇄ Н2 | ±0,00 |
| NO3– | NO2– | NO3– + H2O + 2ē ⇄ NO2– + 2OH– | +0,01 |
| S(тв) | H2S | S + 2H+ + 2ē ⇄ H2S | +0,14 |
| Sn4+ | Sn2+ | Sn4+ + 2ē ⇄ Sn2+ | +0,15 |
| Co(OH)3 | Co(OH)2 | Co(OH)3 + ē ⇄ Co(OH)2 + OH– | +0,20 |
| SO42– | H2SO3 | SO42– + 4H+ + ē ⇄ H2SO3 + H2O | +0,20 |
| Cu2+ | Сu (тв) | Cu2+ + 2ē ⇄ Cu | +0,34 |
| Co3+ | Со (тв) | Co3+ + 3ē ⇄ Co | +0,43 |
| H2SO3 | S (тв) | H2SO3 + 4H+ 4ē ⇄ S + 3H2O | +0,45 |
| Ni(OH)3 | Ni(OH)2 | Ni(OH)3 + ē ⇄ Ni(OH)2 + OH– | +0,49 |
Продолжение приложения 10
| Окисленная форма | Восстановленная форма | Уравнение реакции | φо, В |
| СlО4– | Cl– | СlO4– + 4Н2О +8ē ⇄ С1– +8ОН– | +0,51 |
| I2 | 2I– | I2 + 2ē ⇄ 2I– | +0,53 |
| МnО4– | МnО42– | МnО4– + ē ⇄ МnО42– | +0,54 |
| МnО4– | МnО2 (тв) | МnО4– + 2Н2О + 3ē ⇄ МnО2 + 4ОН– | +0,57 |
| МnО42– | МnО2 (тв) | МnО42– + 2Н2O + 2ē ⇄ МnО2 + 4ОН– | +0,58 |
| ВrО3– | Вr– | ВrО3– + 3H2O + 6ē ⇄ Br– + 6OH– | +0,60 |
| O2 | Н2О2 | O2 + 2H+ + 2ē ⇄ H2O2 | +0,68 |
| H2SeO3 | Se | H2SeO3 + 4H+ + 4ē ⇄ Se + 3H2O | +0,74 |
| Fe3+ | Fe2+ | Fe3+ + ē ⇄ Fe2+ | +0,77 |
| NO3– | NO2 (г) | NO3– + 2H+ + ē ⇄ NO2 + H2O | +0,81 |
| NO3– | NH4+ | NO3– + 10H+ + 8ē ⇄ NH4+ + 3H2O | +0,87 |
| NO3– | NO (г) | NO3– + 4H+ + 3ē ⇄ NO +2H2O | +0,96 |
| HNO2 | NO (г) | HNO2 + H+ + ē ⇄ NO + H2O | +0,99 |
| Вг2 (ж) | 2Br– | Br2 + 2ē ⇄ 2Br– | +1,08 |
| IO3– | I– | IO3– +6 H+ + 6ē ⇄ I– + 3H2O | +1,09 |
| МnО2 (тв) | Mn2+ | MnO2 + 4H+ + 2ē ⇄ Mn2+ + 2H2O | +1,28 |
| СlO4– | Cl– | СlO4– + 8Н+ + 8ē ⇄ Сl– + 4H2O | +1,34 |
| С12 (г) | 2Сl– | Cl2 + 2ē ⇄ 2Cl– | +1,36 |
| Cr2O72– | 2Cr3+ | Cr2O72– + 14H+ + 6ē ⇄ 2Cr3+ + 7H2O | +1,36 |
| ClO3– | Cl– | ClO3– + 6H+ + 6ē ⇄ Cl– + 3H2O | +1,45 |
| РbО2 (тв) | Pb2+ | РbО2 + 4Н+ + 2ē ⇄ Рb2++ 2Н2О | +1,46 |
| HClO | Cl– | HClO + Н+ + 2ē ⇄ Сl– + Н2О | +1,50 |
| МnО4– | Mn2+ | MnO4– + 8H+ + 5ē ⇄ Mn2+ + 4H2O | +1,52 |
| Н2O2 | H2O | H2O2 + 2H+ + 2ē ⇄ 2H2O | +1,77 |
| Со3+ | Co2+ | Co3+ + ē ⇄ Co2+ | +1,84 |
| F2 (г) | 2F– | F2 + 2ē ⇄ 2F– | +2,85 |
ПРИЛОЖЕНИЕ 11
КОНСТАНТЫ НЕСТОЙКОСТИ КОМПЛЕКСНЫХ ИОНОВ
| Уравнение диссоциации комплексного иона | Константа нестойкости |
| [Ag(CN)2]– ⇄ Ag+ + 2CN– | 1,0•10–21 |
| [Ag(NH3)2]+ ⇄ Ag+ + 2NH3 | 6,8•10–8 |
| [Ag(S2O3)2]– ⇄ Ag+ + 2S2O32– | 1,0•10–18 |
| [AlF6]3– ⇄ Al3+ + 6F– | 5,0•10–18 |
| [Cd(CN)4]2– ⇄ Cd2+ + 4CN– | 7,7•10–18 |
| [CdI4]2– ⇄ Cd2+ + 4I– | 7,9•10–7 |
| [Cd(NH3)4]2+ ⇄ Cd2+ + 4NH3 | 2,8•10–7 |
| [Co(CNS)4]2– ⇄ Co2+ + 4CNS– | 5,5•10–3 |
| [Co(NH3)6]2+ ⇄ Co2+ + 6NH3 | 4,1•10–5 |
| [Cu(CN)2]– ⇄ Cu+ +2CN– | 1,0•10–24 |
| [Cu(CN)4]3– ⇄ Cu+ + 4CN– | 5,1•10–31 |
| [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3 | 9,3•10–13 |
| [Fe(CN)6]4– ⇄ Fe2+ + 6CN– | 1,0•10–24 |
| [Fe(CN)6]3– ⇄ Fe3+ + 6CN– | 1,0•10–31 |
| [HgCl4]2– ⇄ Hg2+ + 4Cl– | 6,0•10–16 |
| lHg(CN)4]2– ⇄ Hg2+ + 4CN– | 3,0•10–42 |
| [Hg(CNS)4]2– ⇄ Hg2+ + 4CNS– | 1,3•10–22 |
| [HgI4]2– ⇄ Hg2+ + 4I– | 1,4•10–30 |
| [Ni(CN)4]2– ⇄ Ni2+ + 4CN– | 1,0•10–22 |
| [Ni(NH3)6]2+ ⇄ Ni2+ + 6NH3 | 9,8•10–9 |
| [Zn(CN)4]2– ⇄ Zn2+ + 4CN– | 1,0•10–16 |
| [Zn(CNS)4]2– ⇄ Zn2+ + 4CNS– | 5,0•10–2 |
| [Zn(NH3)4]2+ ⇄ Zn2+ + 4NH3 | 2,0•10–9 |
| [Zn(OH)4]2– ⇄ Zn2+ + 4OH– | 7,1•10–16 |








